UDI上线 | We are ready!
2024-02-04 09:43:21, 英盛生物 山东英盛生物技术有限公司
第三类医疗器械(含体外诊断试剂)将于2022年6月1日全面实施UDI管理,这是我国医疗器械行业向科学化、法治化、国际化、现代化全面提升的又一重要里程碑。英盛生物作为分子诊断平台和临床质谱平台均有三类注册产品的企业,持续关注国家法规政策进展,已提前完成相关产品的UDI上线准备工作,确保供应产品合规性,提升产品可追溯性,助力IVD行业可持续发展。
UDI简介
■ UDI(Unique Device Identification),中文名称:医疗器械唯一标识,是一串由符号、数字或者字母组成的代码,一般附着在医疗器械产品和包装上,具备全球唯一性,可用于医疗器械产品的精准识别,便于监管和追溯,所以也被称为医疗器械产品的“数字身份证”。

■ 根据相关编码规则,UDI由产品标识(DI)和生产标识(PI)两部分组成。产品标识(DI)是识别注册人/备案人、医疗器械型号规格和包装的唯一代码,是从数据库获取医疗器械相关信息的“关键字”,是唯一标识的必须部分;生产标识(PI)包括与生产过程相关的信息,如产品批号、序列号、生产日期和失效日期等,可与产品标识联合使用,满足医疗器械流通、使用环节精细化识别和记录的需求。UDI存在于医疗器械产品生产、流通、使用的整个生命周期中,是精准识别医疗器械信息的基础。
法规依据
序号
法规政策名称
文件编号
1
关于印发医疗器械唯一标识系统试点工作方案的通知
国家药监局2019第56号公告
2
医疗器械唯一标识系统规则
国家药监局2019年第66号公告
3
医疗器械唯一标识系统基础术语
Y/T 1681-2019
4
医疗器械唯一标识基本要求
YY/T 1630-2018
5
医疗器械唯一标识数据库基本数据集
YY/T 1752-2020
6
医疗器械唯一标识数据库填报指南
YY/T 1753-2020
7
关于深入推进试点做好第一批实施医疗器械唯一标识工作的公告
国家药监局2020年第106号公告
8
关于做好第二批实施医疗器械唯一标识工作的公告
国家药监局2021年第114号公告

英盛方案
■ 英盛生物作为国内临床质谱领域技术开发、质量控制及技术服务的先行者,所生产的医疗器械(含体外诊断试剂)包含多种三类和二类产品,经过深入的法规研究和精心准备,现已全部完成三类产品的UDI上线准备工作,并纳入公司质量管理体系,2022年6月1日起,生产的所有三类产品将施加UDI编码,其他二类产品也在持续准备中。
■ 英盛生物第一阶段完成7个三类注册证产品的UDI编码工作,包含新生儿筛查3个规格型号的串联质谱试剂盒和4个类别的耳聋基因分子诊断试剂盒。
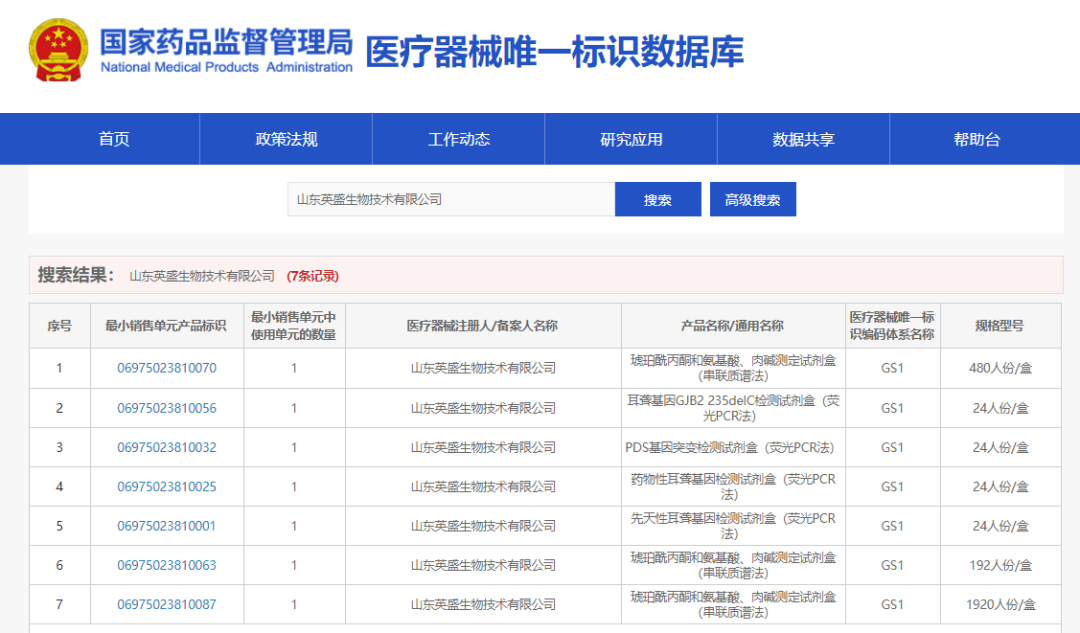
■ 国家UDI政策的实施,与英盛生物的“产品全生命周期管理”和“一站式解决方案”的服务理念高度一致。UDI上线,我们已准备就绪,将以最可靠的产品品质接受监管机构、医疗机构、以及公众的全面考核!
供稿:英盛生物运营中心
如有侵权请联系作者删除
转载请在下方留言或联系后台工作人
往期 · 推荐
走进“治疗药物浓度监测”人体不可缺少的智力元素—碘元素高通量组学技术推进代谢综合征研究质谱技术助力职业病及危害因素监测英盛生物完成数亿元C轮融资 深度布局临床质谱多技术平台政策标准丨多项质谱设备增配,助力妇幼健康发展硬核科普 | 秒懂ICP-MS的前世今生
YS
扫二维码|关注我们
微信号|英盛生物
期待您的关注
06-05
2025版《中国药典》收官在即,变化要点有哪些?要注意哪些方面?06-05
吸附管采集固定污染源废气中的VOCs时的采样流量要求?06-05 检测家
内卷加剧,检测机构如何破局应对?06-05
【人民日报国际】在收获与播种交织的芒种中国时刻,张轶昊谈创新。06-05
德国元素耗材之星 | 固体压样器/液体封样器06-05
夏日焕新 谱写新章 | 德米特第四届“互动日”惊喜而至06-05
祝贺嫦娥六号月背采样成功 | 盘点标乐助力月球样品分析06-05
2024年德国元素巡检活动 | 第一站:成都站!免费申请06-04
会议通知|第一届小动物活体成像技术前沿与应用网络研讨会06-04
蛋白质组学从发现组学跃入临床怀抱的跨越之旅06-04
内毒素检测的思考 - 采用药典方法同时减少鲎试剂的使用06-04 Sievers分析仪
检测家十周年特惠 | 赛默飞、岛津、沃特世 系列产品租六送一!06-04
转发:上海交通大学李林森团队&德克萨斯大学奥斯汀分校刘宜晋团队EES发文:多尺度相关成像揭示快速充电电池中的顺序性和不均匀性退化06-04 TESCAN中国
颠覆认知 “质”的飞跃 | 持续引领行业,赛默飞重磅新品发布06-03
携手同行,共创未来|纽迈2024团建活动圆满结束06-03
研发创新:杨培强与纽迈分析的科研旅程06-03
【圆满举办】2024中药材及饮片质量安全检测技术培训交流会(甘肃站)06-03 检测家
一地发布 检验检测「黄金十条」!通过全国重点实验室认定,最高资助1000万!06-03
实验室溶剂混溶表06-02