经典项目文章 | EP3在小鼠肝纤维化模型中增强NK细胞对肝星状细胞的粘附和细胞毒性
2023-05-30 15:30:53, 欧易生物 上海欧易生物医学科技有限公司
2022年4月14日,天津医科大学申毓军团队在Journal of Experimental Medicine(IF:17.579)发表EP3在小鼠肝纤维化模型中增强NK细胞对肝星状细胞的粘附和细胞毒性的研究论文。

文章题目:EP3 enhances adhesion and cytotoxicity of NK cells toward hepatic stellate cells in a murine liver fibrosis model
期刊:Journal of Experimental Medicine
发表时间:2022年4月
材料:EP3F/F和NKp46CreEP3F/F小鼠中脾脏DP NK细胞
方法:欧易生物10× Genomics scRNA-seq

自然杀伤(NK)细胞通过抑制活化的肝星状细胞(HSC)在肝纤维化(LF)中表现出抗纤维化特性。前列腺素E2 (PGE2)在先天免疫和适应性免疫中发挥双重作用。作者发现e -前列腺素3受体(EP3)在肝纤维化小鼠和肝硬化患者的NK细胞中明显下调。NK细胞特异性EP3缺失加重了小鼠LF模型的肝纤维化。EP3的缺失选择性地降低了CD27+CD11b+双阳性(DP) NK亚群对活化的肝星状细胞的细胞毒性。机制上,EP3的缺失通过调节Itga4-VCAM1的结合,削弱了DP NK细胞对肝星状细胞的粘附性和细胞毒性。EP3通过pkc介导的Spic T191位点磷酸化,促进Spic核易位,从而上调NK细胞中Itga4的表达。磺胺酮激活EP3可减轻CCL4诱导的小鼠肝纤维化。因此,EP3是NK细胞对肝星状细胞的粘附和细胞毒性所必需的,并可能作为LF管理的治疗靶点。

为了探索NK细胞中PG受体的功能,作者首先分析了来自BDL和CCL4处理小鼠的肝NK细胞中PG受体的表达,并观察到两种LF模型中肝NK细胞中EP3和EP4的表达一致降低。进一步通过实验发现,EP3的缺失可能会损害LF中NK细胞的功能,NK细胞中EP3的缺失通过削弱NK DP亚群的活性来加剧LF。
为了深入分析NK细胞中EP3介导的分子改变,使用NK DP细胞进行单细胞RNA测序(scRNA-seq)。t分布随机邻居包埋(t-SNE)分析显示DP NK细胞中有5个具有特定标记基因的簇(图1A和B)。以对照细胞为参照,在EP3缺陷NK细胞中共鉴定出75个差异表达基因(deg),包括12个上调基因和63个下调基因。在前30个基因本体论(GO)术语(图1C)中,有6个术语与NK细胞粘附直接相关:异型细胞-细胞粘附、白细胞-细胞粘附、局部粘附、细胞表面、蛋白质结合和蛋白质同二聚体。京都基因和基因组百科(KEGG)证实了粘附通路的富集(图1D),基因集富集分析(GSEA)进一步揭示了EP3缺陷NK细胞中粘附信号通路的下调(图1E)。然后作者将粘附基因集与前50个下调基因进行交叉,发现了5个典型的粘附相关基因(图1F和G),两者也通过定性RT-PCR得到证实EP3缺乏和EP3过表达的NK细胞(图1H和I)。其中,Itga4与Itgb1或Itgb7亚基结合形成整合素,通过与靶细胞上的VCAM-1、MadCAM-1、纤连蛋白和骨桥蛋白等配体结合,在调节淋巴细胞粘附和迁移中发挥重要作用。在肝星状细胞中,活化的肝星状细胞中VCAM1和纤连蛋白的表达显著增加(图1J)。有趣的是,EP3缺失显著削弱了DP NK细胞对板结合VCAM1的粘附,但没有影响纤连蛋白的粘附(图1K)。通过F-actin染色测定,EP3缺失的NK细胞在VCAM1接合后也表现出缺陷的薄片状突起形成(图1L和M)。
作者从CCL4处理的小鼠中观察到肝脏DP NK细胞中Itga4的表达显著下调,而HSCs中VCAM1的表达显著上调。NK细胞中EP3的缺失抑制了DP NK细胞中Itga4的表达,但对激活的HSC中VCAM1的表达没有明显影响(图4N和O)。敲低Itga4(图1P)可以消除过表达EP3的NK细胞对VCAM1的增强粘附(图1Q),减弱过表达EP3的DP NK细胞对激活的HSC的增强附着和细胞毒性(图1R和1S)。在肝星状细胞中沉默VCAM1(图1T)阻止了EP3过表达的DP NK细胞与活化的肝星状细胞之间的粘附(图1U),随后减少了NK细胞介导的活化肝星状细胞的裂解(图1V)。这些结果表明,EP3通过Itag4/VCAM1结合促进DP NK细胞与活化的肝星状细胞的粘附和杀伤。
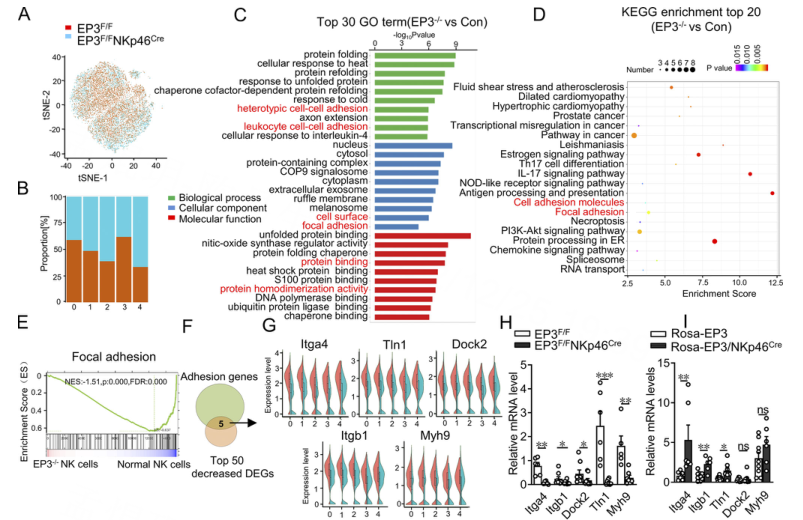
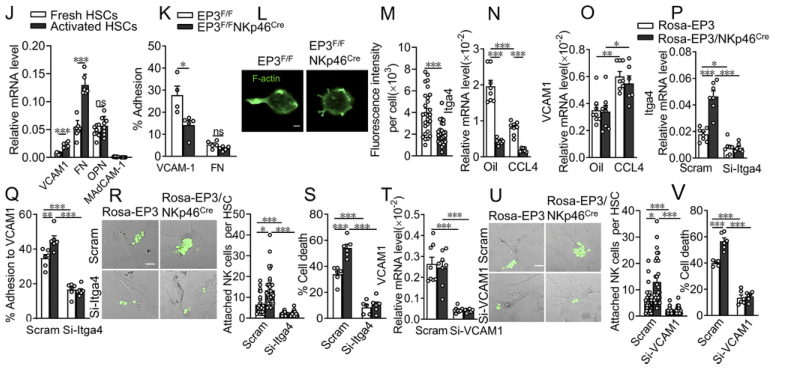
图1 EP3的激活通过Itga4-VCAM1的结合促进DP NK细胞与活化的肝星状细胞的粘附
为了进一步探索EP3介导的NK细胞粘附的分子机制,作者进行了单细胞调节网络推断和聚类(SCENIC)分析,以确定DP NK细胞中EP3/Itga4信号转导的关键转录调控因子。EP3缺失导致DP NK细胞中Spic和E2f7活性显著下降,Bcl11a活性升高(图2A)。与对照细胞相比,EP3缺失的DP NK细胞中Spic mRNA(图2B)和蛋白水平(图2C)没有明显变化。在正常的DP NK细胞中,EP3激动剂选择性地促进Spic从细胞质转位到细胞核,但在EP3缺陷细胞中没有作用(图2D-F)。Spic的沉默(图5G)消除了EP3过表达诱导的Itga4表达的增加(图2H),增强了与VCAM1的粘附(图5I),并与激活的HSC结合(图2J和2K)。在CCL4处理的小鼠中,NK细胞中Spic的缺失消除了NK细胞中EP3过表达的抗纤维化作用(图2L-P)。这些数据表明EP3的激活通过增加spic介导的Itga4在DP NK细胞中的表达来增强DP NK细胞对活化肝星状细胞的粘附和裂解,从而减弱了LF。

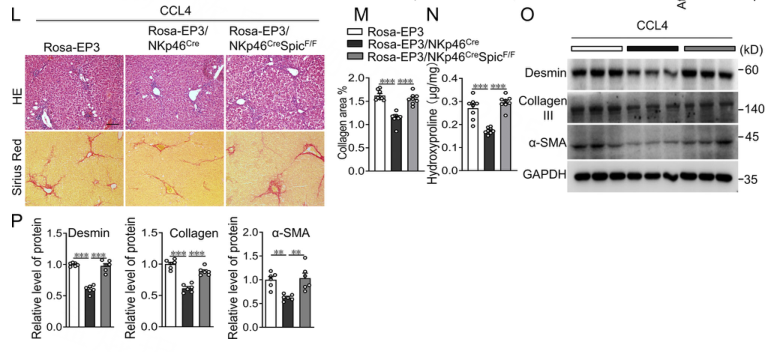
图2 在DP NK细胞中,EP3介导的Itga4表达需要TF Spic
作者又进一步通过实验证明,EP3是LF中人类NK功能的重要调节因子,蛋白激酶C (PKC)可能直接磷酸化NK细胞T191上的Spic,增强NK细胞对活化的HSC的粘附性和细胞毒性,以EP3为靶点可能是LF的一种治疗策略。

作者证明EP3介导的NK细胞激活通过PKC/Spic/Itga4信号通路对小鼠损伤诱导的LF提供保护,激活NK细胞中的EP3可能是对抗LF的一种治疗策略。
在本研究中,作者发现肝硬化患者血液NK细胞中EP3表达下调,LF小鼠模型中肝NK细胞表达下调。NK细胞特异性的EP3缺失加重了小鼠四氯化碳(CCL4)和胆管结扎(BDL)诱导的LF,CD27+CD11b+双阳性(DP) NK亚群对活化的肝星状细胞的细胞毒性降低。DP NK细胞过继转移减弱了EP3缺陷小鼠CCL4诱导的LF。在机制上,EP3的激活通过促进Itga4与VCAM1在肝星状细胞上的结合,增强了DP NK细胞对肝星状细胞的粘附和细胞毒性。EP3通过Ca2+/PKC/Spic信号通路转录上调NK细胞中Itga4的表达。EP3激动剂对小鼠LF减毒的治疗。总之,作者的研究结果揭示了EP3通过增强DP NK细胞对肝星状细胞的粘附性和细胞毒性来对抗LF的保护作用。
猜你想看
1、项目文章 | 单细胞和空间转录组测序助力人类早期椎间盘形成的单细胞时空图谱构建
2、项目文章 | 一项关于ABS患者产生内源性乙醇的潜在致病菌的病例研究
3、经典项目文章 | 欧易单细胞转录组测序助力解析磨玻璃结节肺腺癌的发病机制
4、项目文章 | 多组学探究肝癌微环境中影响免疫治疗好坏的肿瘤免疫屏障
05-13 销售部 周建新
5月15日-17日,欧美克与您相约上海国际医药原料药/中间体/包装/设备交易会API05-13 欧美克仪器
【每天学点粒度知识】磷酸铁锂浆料粒度分析05-13
Topsizer Plus丨中国粒度检测与分析技术的巅峰之作05-13 欧美克仪器
母亲节——感恩母亲,致敬时代女性05-12
母亲节|我嘴上说“您注意身体”,其实心里是这三个字05-12
母亲节 | 坚守科技生命线,赋能中国智造 以爱之名,致敬母亲05-12
药物安全不容忽略之包材检测05-11 德国耶拿
母亲节 | 有一种爱,以“分离”为目的的无声告白05-11 Yeddy Zhang
春夏之交 总裁中国行05-11 市场部
合成多肽的反相纯化 | 艾塞那肽纯化案例05-11 市场部
把握方向盘,开好行车道的脂质体药物05-11 Viny
【同聚力,共成长】益世科生物助力生物制药行业高质量发展05-11
【CN-3】5月20日,来和小E上演一场浪漫的青岛之约吧!05-11
一切伟大皆源于ta05-11
国际认可 | 盛瀚再助东京工业大学论文发表,登国际舞台05-11 SHINE
祝贺!张磊博士获得中国化学试剂工业协会授予的突出贡献奖和创新贡献奖05-10
展会邀请 | 点成诚邀您5月20-22日于青岛参加全国制药机械博览会CIPM05-10 点成生物科技
聚焦天隆|中国食品药品检定研究院相关领导莅临天隆科技开展调研工作05-10
滑坡监测:减少灾害风险的“安全锁”05-10 专业的