Eur Heart J | 血管新内膜时间蛋白质组学发现血管损伤的治疗新靶点
2023-05-05 16:53:36, 景杰生物 杭州景杰生物科技股份有限公司

景杰生物 | 报道
支架内再狭窄(In-stent restenosis,ISR)是冠状动脉支架术后并发症。支架植入导致血管损伤,使得植入段新内膜(neointima)形成,是引发支架内再狭窄的主要原因之一。预防新内膜的形成对心血管疾病,特别是冠状动脉、颈动脉或外周动脉的动脉粥样硬化的治疗策略具有重要的临床意义。
为了检测血管重塑的关键驱动因素,德国心脏中心心脏病学系Thorsten Kessler与德国马普所所长Matthias Mann等合作团队,对血管损伤后单股动脉组织开展了时间分辨率的蛋白质组学图谱研究,研究揭示了血管新生内膜形成过程中蛋白质组变化,并发现一个潜在靶点——TRPC6,可用于预防动脉支架手术后继发的新生内膜形成造成的再狭窄。研究成果以“A proteomic atlas of the neointima identifies novel druggable targets for preventive therapy”为题发表于心血管领域的顶级期刊 European Heart Journal。

一般而言,人体血管组织不容易取样,尤其是在新内膜形成开始时。相比之下,小鼠是以标准化方式研究血管损伤影响的理想生物体。因此,研究人员使用金属丝对小鼠左股动脉进行抓挠诱导血管损伤,并在三个不同时间点(3d、7d和14d,生物学重复n=6)收集股动脉组织进行高精度蛋白质组学定量。研究共定量到4836个蛋白质,值得注意的是,在任一时间点,血管损伤后的股动脉比未损伤的股动脉多定量约700-1100个蛋白质。这反映了血管损伤后发生的强烈的蛋白质组反应。对不同时间点的差异蛋白GO分析结果表明了血管损伤早期的特定途径激活。响应血管损伤而上调的蛋白质主要参与免疫反应、细胞粘附、细胞活化、细胞外基质、增殖和迁移相关的途径。血管损伤时显著下调蛋白质主要是糖蛋白(特别是参与细胞-细胞接触的糖蛋白)和细胞连接蛋白。
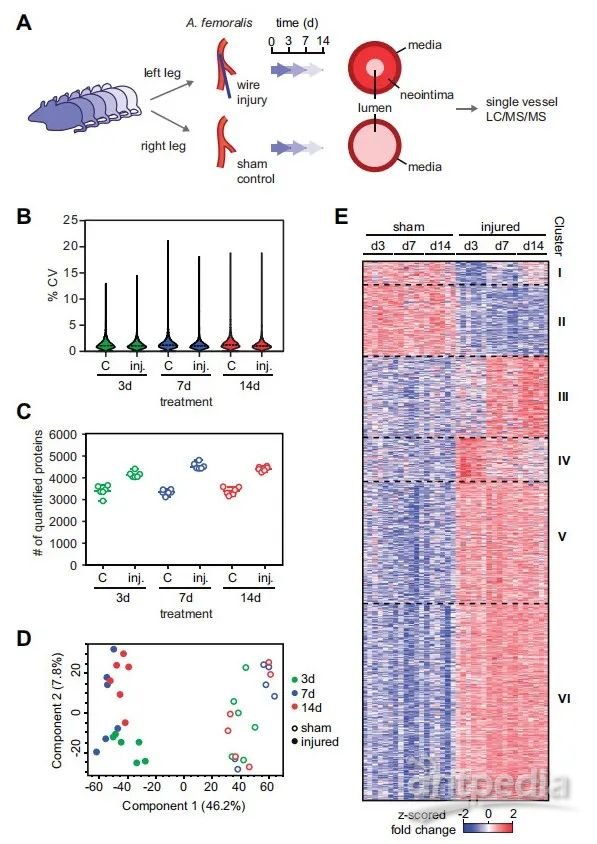
图1 新内膜形成过程的深度蛋白质组学分析
基于时间分辨率的蛋白质组学图谱,能够定义具有早期,晚期或瞬时调节的蛋白质,以响应血管损伤。例如,凝血途径的蛋白多糖蛋白在损伤后3天特异性和短暂地上调,而软骨相关的ECM蛋白Col12a1和Acan在损伤后14天特异性上调。此外,研究人员重点关注了与细胞外基质(ECM)重塑和平滑肌细胞(SMC)迁移相关的蛋白变化,发现血管损伤后ECM核心蛋白大量下调而大量迁移因子持续高表达。
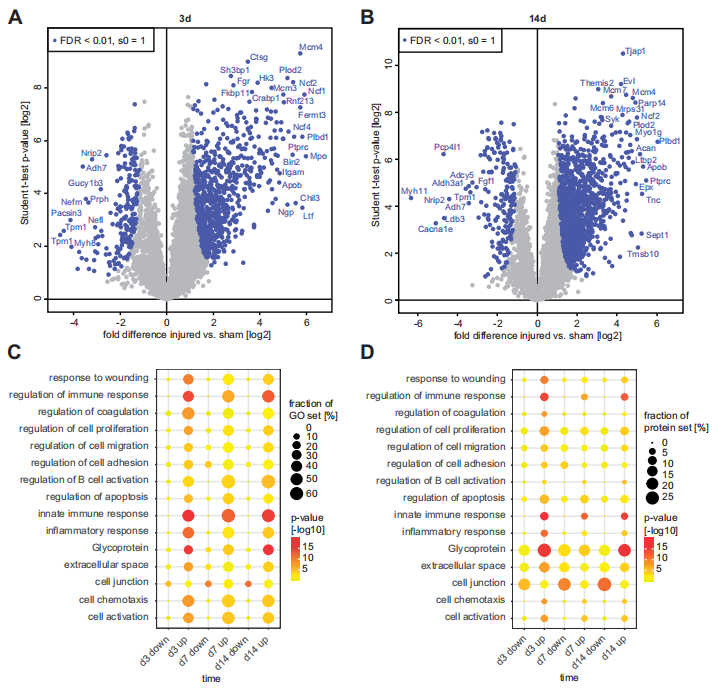
图2 血管损伤后细胞外基质重塑的时间分辨分析
基于蛋白质组学图谱数据,研究人员进一步寻找可能用于药理学应用的新靶点。新靶点需要满足以下五个预先指定的标准:(i)血管损伤后表达增加,(ii)早期表达水平最高,(iii)在非损伤组织中低表达或检测不到,(iv)与细胞迁移相关,以及(v)有对应可用的药理学抑制剂。基于以上标准,研究发现了一种在内皮和动脉平滑肌细胞(以及中性粒细胞)质膜上的非选择性阳离子通道蛋白Trpc6,并通过小鼠实验证实了Trpc6调控体内新生内膜的形成。Trpc6敲除小鼠(Trpc6-/-小鼠)在金属丝损伤操作28天后新生内膜面积显著减少。此外,TRPC6激活剂OAG导致体外人主动脉血管平滑肌细胞迁移和增殖的增加。相反,TRPC6抑制剂SAR7334减少了血管平滑肌细胞迁移。由此证明:TRPC6是血管重塑的新靶点,抑制TRPC6通过阻断平滑肌细胞的迁移和增殖,为抑制新生内膜的形成提供了一种补充策略。
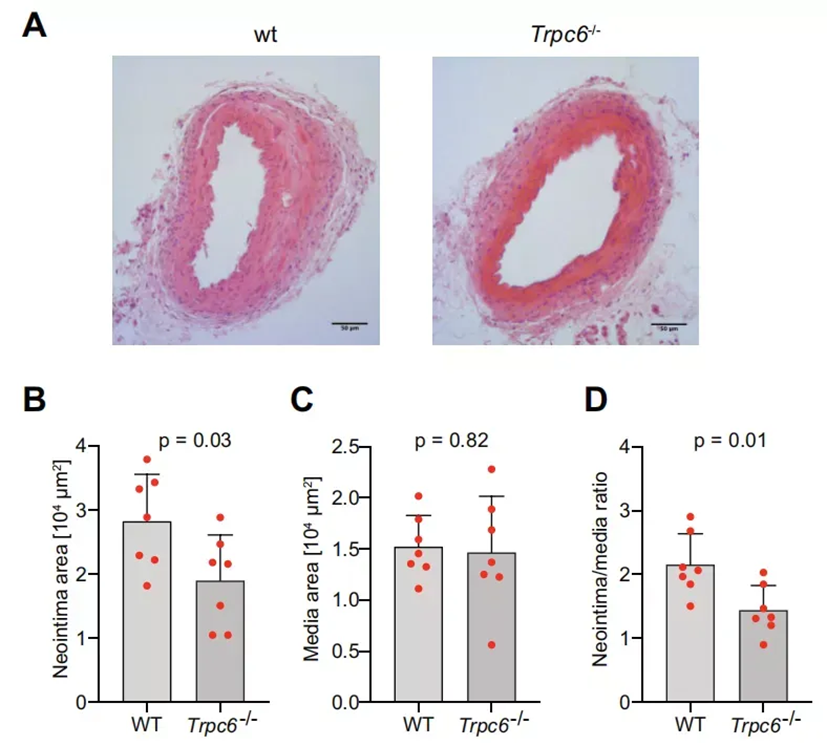
图3 Trpc6促进小鼠新内膜形成
为了将研究结果从小鼠扩展到人类,研究人员进一步结合人类的遗传变异进行分析。通过查询GTEx数据集,研究团队发现rs2513192是动脉中TRPC6的常见单核苷酸多态性(eSNP)。针对超过3000个接受冠状动脉支架手术患者的预后情况进行分析,发现rs2513192基因型与术后再狭窄的发生具有显著的基因剂量效应。因此,TRPC6高表达相关基因型的分析有助于临床上识别风险增加的患者。同时,TRPC6是血管损伤和重塑的新靶标。特别是与当前常用的药物洗脱支架涂层所靶向的mTOR相比,TRPC6对身体的生理功能不是必需的,仅在病理生理条件下激活。因此,TRPC6抑制剂在预防新内膜形成方面应比目前的mTOR抑制剂更安全。冠状动脉介入治疗后抑制TRPC6可能是已建立的mTOR抑制和预防再狭窄的替代或补充策略。
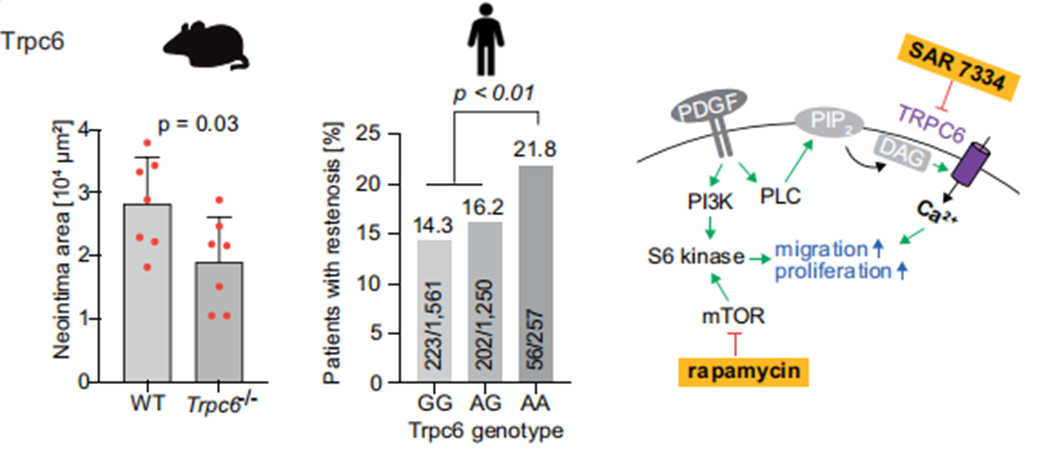
图4 TRPC6抑制剂阻断平滑肌细胞的迁移和增殖
综上所述,该研究运用基于质谱的深度蛋白组学技术,分析了血管损伤后小鼠股动脉新生内膜形成过程的蛋白质表达变化,绘制了时间分辨率的新内膜生成蛋白质组学图谱。组学数据显示出了细胞外基质的重构以及细胞迁移因子的改变,并发现了TRPC6是血管损伤和重塑的新靶点。抑制TRPC6通过阻断平滑肌细胞(SMC)的迁移和增殖,为抑制新生内膜的形成提供了一种补充策略。
值得一提的是,2023年2月,该研究作者Thorsten Kessler等在 European Heart Journal 再次发表题为“Role of the extracellular matrix in cell–cell communication: a new therapeutic target?”的文章。介绍了基于该研究及相关成果与合作者发起的名为“MATRICARD”的研究项目。将结合包括蛋白质组学、单细胞及空间蛋白质组学等技术,重点研究ECM作为血管壁和心肌中多种细胞类型之间通讯的中介作用,更深入了解ECM分子机制,确定心血管疾病治疗新靶点并开发新药。“MATRICARD”项目于2022年11月获欧洲研究委员会(ERC)科研资助,资助金额150万欧元(约人民币1120万元)。

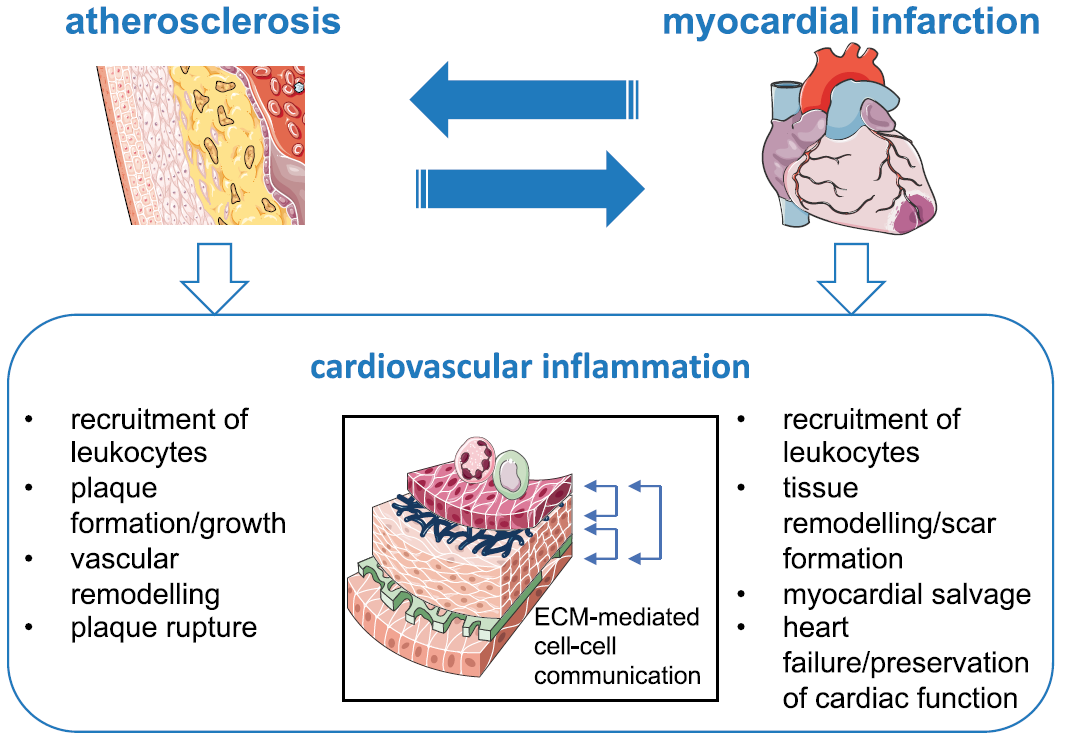
图5 细胞外基质在细胞通讯中的作用-治疗心血管疾病的新靶点
精彩往期推荐
PNAS | 浙江大学余路阳/裘聪团队揭示SUMO化修饰调控血管生成新机制
2022-06-30
Mol Cell重磅 | 张令强/贺福初/魏文毅/刘翠华揭示线性泛素化调控血管生成新机制
2021-06-22
Adv Sci封面文章!陆军军医大学第二附属医院赵景宏团队报道固有免疫反应促进心血管疾病新机制
2021-04-28
必追的国自然热点⑥ | 神热点!血管功能遇见“新”修饰
2022-11-29
Pharmacol Res | 南京医科大学第一附属医院张凤祥团队外泌体蛋白组揭示DJ-1蛋白抑制心肌肥厚机制
2022-12-19
参考文献
1. Michael Wierer. 2021. A proteomic atlas of the neointima identifies novel druggable targets for preventive therapy. Eur Heart J.
2. Kessler T, Sager HB, Mann M. 2023. Role of the extracellular matrix in cell-cell communication: a new therapeutic target? Eur Heart J.
3. Mund A, Coscia F, Kriston A, et al. 2022. Deep Visual Proteomics defines single-cell identity and heterogeneity. Nat Biotechnol.
本文由景杰学术团队报道,欢迎转发到朋友圈。如有转载、投稿等其他合作需求,请在文章下方留言,或添加微信ptm-market咨询。
#关注领取新人福利,下载最近三年影响因子(后台发送关键词“新人”)
06-18 TESCAN中国
解决临床创新“卡脖子”难题,丹纳赫重磅推出医院创新转化解决方案!06-18
徕卡精准空间生物学解决方案 第三弹06-18 郑晓业、童昕
618 嗨购一起“徕” | 网上商城活动来袭!06-18 徕卡显微系统
【培训活动】显微镜成像高阶培训系列(一) 共聚焦多维度成像技术解决方案06-18 徕卡显微系统
【展会】第十五届中国医师协会骨科医师年会06-18 徕卡显微系统
【直播预告】第十届电子显微学网络会议06-18 徕卡显微系统
【案例研究】双视野光片显微镜,适用于类器官及胚胎06-18 徕卡显微系统
议程确定|第四届锂离子电池热测试主题研讨会06-18
文献解读|安徽理工大学马衍坤教授团队《煤炭学报》:震动载荷多次作用下烟煤孔裂隙结构演化特征试验研究06-18 纽迈分析
中国的新质生产力正在服务全球市场!GE医疗北京基地CT交付量达3.5万台/套06-17
兰格ACHEMA 2024展会回顾:探寻精密流体传输市场新机遇06-17
宝英科技推出VOCs治理设施精细化管理实施方案,助力重点行业企业绿色升级06-17 宝英科技
赛默飞X先锋“肽”势:多肽药物研发与创新研讨会06-17
一省检验检测行业营收突破160亿元!06-17
仪器租赁 | 沃特世 液质联用,月租金52000元起06-17
不同行业实验室“以旧换新”,涉及哪些仪器设备?06-17
目标!检验机构总营收超100亿!06-16
一张“A4纸”售价高达万元,这家第三方检测公司是怎么做到的?06-15
GLMY创想仪器丨参加东北地区铸造年会06-15 国产精密仪器厂家