除菌过滤指南解读课堂|(五)什么是验证主计划?
2023-02-15 14:20:57, 刘秋琳 Merck工艺解决方案
跟着刘老师一起解读指南
(五)什么是验证主计划?
“
在具体讲述除菌过滤工艺验证之前,我们先介绍一个概念,验证主计划(Validation Master Plan),VMP 是验证程序的起点,应当包括验证程序的目的和范围,描述验证所使用的一般方法,以及确保方案可以通过制药行业监管结构审核所使用的方法。因此执行验证程序之前, 首先要制定通用的验证主计划(VMP),以确立验证策略并确定方案及后续测试。对于每一项重要的验证研究都应当形成完整的资料包,包括预先经批准的方案和最终的测试报告。
”过滤器验证的目的
监管机构要求在实验室实验中模拟正常的生产条件,采用实际药品执行特定的验证方案。过滤验证的目的在于为多个领域提供高水平的保证,确保过滤工艺在预定的工艺条件下可靠地运行。首先,它必须确保微生物截留不受药物溶液和工艺条件的影响。这就意味着需要验证它们对于生物体大小、孔径分布以及截留机理的影响。第二,验证应当保证过滤工艺不影响初始的药品特性。因此有必要进行吸附性研究和可提取物浸出物研究。第三,验证旨在保证不论是药物溶液还是工艺均不影响过滤器的特性。需要的信息包括化学、物理与热兼容性以及完整性测试数据。
除菌过滤的管理是先选择合适的滤膜并验证过滤器性能,然后进行良好工程和验证实践,最后建立适当的标准操作规程(SOP) 并培训操作员。
通常对于除菌过滤的验证主计划中所阐述的验证项目包含:微生物截留试验,可提取物和浸出物研究,基于产品的完整性测试数据,过滤器兼容性,吸附性研究,验证完整性测试程序,验证灭菌程序,验证文件。前五项验证项目我们将会在后续工艺验证解析中详细介绍,这里主要讲述验证完整性测试程序,灭菌程序及验证文件三个方面。
验证完整性测试程序
过滤器完整性测试是关键操作,用于该测试的自动装置需要进行验证。《指南》中也提到“考虑到完整性测试结果的客观性以及数据可靠性,应尽可能在关键使用点使用自动化完整性测试仪。自动化完整性测试仪应在使用前,进行安装确认、运行确认和性能确认。应建立该设备使用、清洁和维护的操作规程,以及定期的预防性维护计划(其中应当包含设备的定期校验要求)。”此验证的目的在于形成书面证据,证明完整性测试装置在实际使用条件下一致可靠地执行完整性测试。在安装确认 (IQ)、运行确认 (OQ) 和性能确认 (PQ) 均已根据预先确立的方案实现并记录之后再进行该验证。
验证灭菌程序
高压蒸汽灭菌和在线蒸汽灭菌是制药业中对过滤器及其相关设备进行灭菌的两种主要方法。在线蒸汽灭菌保证了对整个无菌灌装系统的高效灭菌,后续无需再使用无菌接头,该接头可能会损害下游设备的完整性。蒸汽灭菌对于确保最终产品的无菌性至关重要,监管机构要求进行全面验证。
验证过滤器灭菌工艺之前,建议首先对传热设备,即在线蒸汽灭菌或高压蒸汽灭菌的系统进行设计确认 (DQ),然后进行IQ 和 OQ。
验证研究之后,必须对 SOP 进行确认并正确记录,负责过滤器蒸汽灭菌的人员必须接受过适当的培训。最后,验证小组检查操作员是否已经掌握常规 SOP 并能够正确执行。培养基灌装或培养基保存是在灭菌后评估系统无菌性时供选择的方法。有必要进行三次连续成功的培养基灌装操作以确定重现性以及系统能够可靠地灭菌并保持无菌状态。
验证文件
验证除菌过滤器所需的所有测试都必须进行记录,包括所有原始数据和测试结果。过滤器用户必须能够提供与验证程序相关的资料包。验证文件必须易于审查者理解,还必须随时更新以便检查。
验证方案说明预先确立的接受标准,必须得到验证小组的认可。方案应当包括对产品和工艺条件的描述,指出执行验证工作所要承担的责任,说明最恶劣测试条件选择的基本原理,提供方案细节,包括材料、方法和测试参数,并阐述接受标准。
根据方案中所述的规范和 SOP 进行测试。所记录的结果必须遵守预先确定的接受标准。验证报告应当包含产品和过滤器批次鉴定、校准证书以及带有讨论和结论的结果。验证文件确保如图1所示的所有必需的测试都在指定控制条件下进行。验证工作中收集的信息可以帮助过滤器用户确定标准操作规程和工作极限。
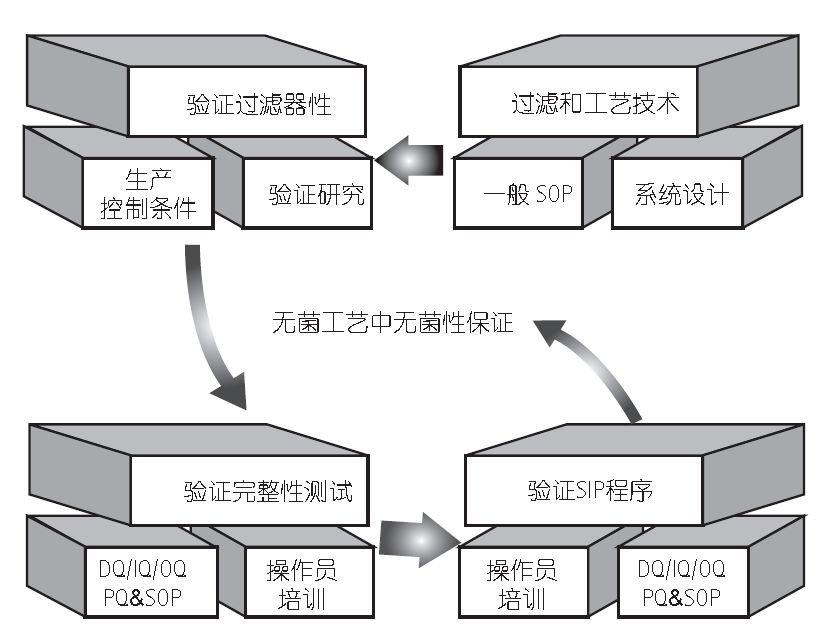
图1 无菌工艺中所使用的除菌级过滤验证的一般 VMP
对于无菌工艺中所用的除菌过滤的验证必须在工艺开发早期予以考虑。必须根据用户需求标准 (URS) 预定好整体操作流程,以便确认工艺中哪些重要步骤需要进行彻底验证。这一风险分析通常需要仔细考虑过滤系统及其相关的 SOP。过滤器性能验证由过滤器生产商在实验室条件下模拟最恶劣的工艺条件来进行。验证完成后得到完整的文件,证明所需的验证测试确已执行且成功达到预先制定的验收标准。验证了无菌过滤工艺后,需要对重要工艺设备和监控仪器进行 IQ 和 OQ 验证。该部分验证工作由默克验证工程师和制药商紧密配合完成。最后进行完整性测试和蒸汽灭菌程序的性能确认以及适当的操作员培训和认证,完成工艺验证全过程。默克的验证项目可提供数据、建议和程序帮助制药商进行性能确认。优选由通常负责工艺的经培训和认证的操作员执行实际的 PQ,由过滤器供应商作为监督验证小组的成员进行协助。采取此方法可确保安全、可重现和一致的产品质量,提高除菌过滤的无菌保证水平,该方法是成功通过法规审核的最佳保证。
往期回顾:
除菌过滤指南解读课堂|《除菌过滤技术及应用指南》发布
除菌过滤指南解读课堂|(一)如何在过滤工艺开发时进行过滤系统的选择和设计?
除菌过滤指南解读课堂|(二)对过滤器供应商进行管理时要注意哪些要素?
除菌过滤指南解读课堂|(三)两个除菌过滤器串联就是冗余过滤吗?
除菌过滤指南解读课堂|(四)过滤器的性能确认可以替代过滤工艺验证吗?
下期预告:
什么时候应当进行除菌过滤工艺验证?
*更多产品信息,请咨询默克当地销售
*技术咨询:400 889 1988转4号线
关于默克工艺解决方案
默克工艺解决方案是默克生命科学三大事业部之一,致力于为生物制药、化学制药企业提供产品开发、商业化生产所需全系列工具,已成为预过滤、无菌过滤、除病毒过滤、超滤、层析纯化、一次性生产、培养基、生物反应器、缓冲液、药用原辅料、工程技术及验证领域的全球领导者。默克工艺解决方案的成功源于对高质量产品、先进监管技术的不懈追求以及致力于帮助客户实现其需求的精神。
默克工艺解决方案领英官方账号已上线,
05-14 玉研仪器
走近用户,聆听心声 | 福立仪器走访国家级重点技工院校,强化合作与交流05-14
风雨携手共进,十载春华秋实——检测家十周年庆典!05-14 检测家
最高1000万!这35个地区均可领取补贴!现行有效的实验室政策汇总05-14
仪器租赁 | 沃特世 液质联用,月租金52000元起05-14
精准引领精彩 雷磁“智”向未来——新品发布会05-14
智能科技,引领未来——天瑞仪器盛装亮相2024国际电子电路上海展05-14
同济大学与天瑞仪器产教融合创新实践基地挂牌仪式顺利举行05-14
热点应用丨prepASH在食品领域的应用——水分检测05-13 天美
热点应用丨prepASH在食品领域的应用——灰分检测05-13 天美
热点应用丨药品快检好帮手之中药分析——prepASH全自动水分灰分分析仪05-13
热点应用丨如何实现饲料快检——prepASH全自动水分灰分分析仪05-13 天美
高端仪器装备行业质量基础设施服务工作站项目启动会顺利召开05-13
3人死亡!一化工厂发生爆炸!05-13
全国各省份认证证书数分布(2024-4)05-13
最美检测家!寻找实验室那抹靓丽05-13 最美
展会回顾|指尖上的仪器“南京”人生初见暨南京仪器行业2024年联谊会05-13 Criron——谱临晟
优质TOC标准物质 — 自行配制 VS. 购买成品05-13 Sievers分析仪
宠粉时刻 | 2024年4月微信活动获奖名单05-13 Sievers分析仪
CIPM药机盛宴,不容错过05-13 Sievers分析仪