mRNA药物的研发和关键质控要点概览
2022-10-12 12:27:19, 徐玲丽 丹纳赫生命科学
自mRNA新冠疫苗问世以来,已经有超过100个国家和地区超过五亿剂的接种,创造了制药及疫苗史上的双记录。mRNA疫苗被全球知名科技媒体《麻省理工科技评论》评为“2021年全球十大突破性技术”,并荣登榜首。其重大意义在于:mRNA技术可能带来医药领域的巨大变革。
mRNA疫苗(药物)是将含有编码抗原蛋白的mRNA导入人体,跳过复制、转录过程,直接进行翻译来形成相应的抗原蛋白,从而诱导机体产生特异性免疫应答,达到预防或治疗的目的。在mRNA疫苗(药物)发挥作用的过程中,构建特异性抗原的mRNA序列、mRNA胞内递送策略、激活强大的免疫系统是三大重要环节。
mRNA的序列模拟内源性mRNA的结构,有五个部分,分别是:5ʹcap,5ʹ非翻译区( UTR ),编码抗原的开放阅读框,3ʹUTR和Poly A尾。5′端结构会在空间上保护mRNA不被核酸外切酶降解,Poly A尾的长度间接调节mRNA翻译和半衰期。5′和3′UTR调节mRNA翻译、半衰期和亚细胞定位,其中开放阅读框可以通过优化密码子,在不改变蛋白质序列的情况下增加翻译。所以在前期研发阶段,需要构建大量酶反应体系以进行密码子的优化工作。
贝克曼库尔特的自动化工作站搭配RNAclean XP产物纯化试剂实现高通量、自动化的反转录体系构建、反应产物纯化,以快速获取优质序列的mRNA产物。
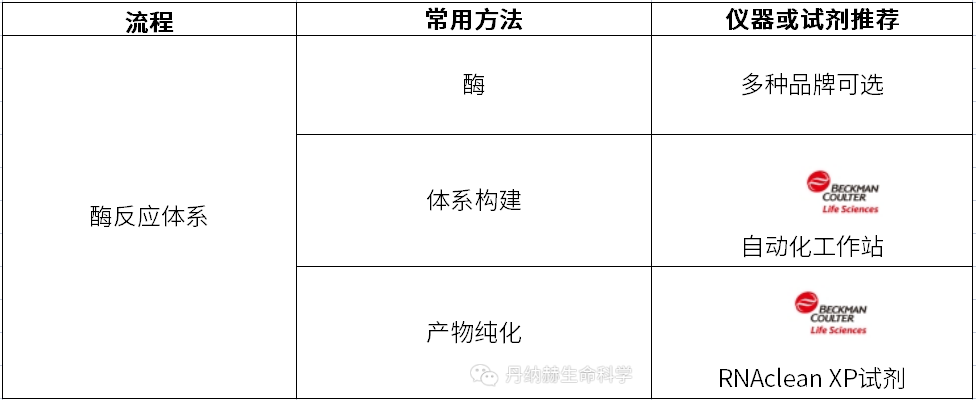
RNAclean XP产物纯化试剂通过专利的SPRI 可逆固相(专利号:US5705628,US5898071,US6534262)结合磁珠技术试剂盒,从常见的酶反应中纯化 RNA,可以完全去除盐、未合并的寡核苷酸等,获得高质量的纯化产物。
SPRI三层磁珠结构
RNAclean XP纯化峰图
而重复的系列IVT反应,加帽加尾反应体系构建可以由自动化工作站来实现,不但可以获得稳定的重复结果,工作站上配置的HEPA也可避免气溶胶污染。
Biomek i5自动化工作站
凝胶电泳验证结果无交叉污染
在mRNA的工艺中一般先将编码目的抗原的基因序列构建入质粒中,通过质粒线性化,反转录获得mRNA,在转录中或转录后进行mRNA的加帽、加尾以及碱基修饰。修饰完成后获得的mRNA产物会产生截短型RNA、双链(ds)RNA、序列错误的反应物等杂质,需要用合适的方法进行检测,主要的检测项目有:
SCIEX 的毛细管电泳PA 800 Plus制药分析系统采用激光诱导荧光检测器配合不同的核酸检测试剂盒,可完成mRNA的完整性、加帽率及Poly A 尾分布分析。
PA 800 Plus 制药分析系统
mRNA Ladder完整性检测
mRNA 加帽率检测
mRNA poly A尾检测
而采用SCIEX的X500B或者Zeno TOFTM 7600高分辨质谱系统进行检测,根据精确分子量,不但能区分加帽和不加帽的部分,还能鉴别不同的Cap种类。同时质谱还能进行Poly A的长度分布表征及相对定量。由于核酸表征分析需要加入离子对试剂,这对质谱的抗污染能力提出了很高的要求。
ZenoTOF TM 7600
高分辨质谱系统
X500B
mRNA加帽鉴定
mRNA Poly A 尾分布分析
将mRNA胞内递送到正确的细胞并诱导免疫激活是具有挑战性的,裸露的mRNA很容易被细胞外RNA酶降解,哪怕进入细胞也容易在溶酶体聚集,抵达不了发挥作用的地方。目前,已经开发了多种递送载体如鱼精蛋白、脂质体、树突细胞、无机纳米粒子等用于促进mRNA疫苗(药物)的细胞摄取并保护其免于降解。由于目前获批的mRNA疫苗都是采用脂质纳米颗粒(Lipid nanoparticles,LNPs),因此LNP是目前mRNA疫苗最常用的载体之一。LNP主要由可电离阳离子脂质、胆固醇、中性辅助磷脂和聚乙二醇修饰的磷脂(PEG-脂质)组成,通过微流控与mRNA混合,形成mRNA-LNP复合物。
LNP的几种成分比例将决定mRNA-LNP复合物的颗粒大小、mRNA与LNP结合的稳定性、内吞及逃逸等情况,因此在研发过程中,需要花费大量的时间精力来进行LNP比例的优化,采用贝克曼库尔特的自动化工作站亦可高效完成这种繁复的实验。
另外,也需要采用多种手段对mRNA-LNP进行多方位的表征。
形态学观察是进行物质结构研究最直接和客观的证据,采用冷冻透射电镜进行载药脂质体的观察,能够清晰、准确地查看分布形态、颗粒大小和颗粒完整度等情况,徕卡的电镜载网喷镀连续碳膜和辉光放电处理的EM ACE600和投入冷冻仪EM GP2,可以便捷地完成高质量的载药脂质体的冷冻前处理。
载药脂质体的冷冻电镜图
( 电子显微学报2012 )

EM GP2
全自动快速投入冷冻仪
另外,通过荧光标记药物,共聚焦显微镜能够观察包裹在脂质体内的药物进入细胞的过程, STELLARIS STED 纳米光学成像系统能对纳米级别的物质结构进行精细观察,用以判断进入细胞内的活性分子的比例。
STELLARIS STED 纳米光学成像系统
LNP包裹的siRNA进入细胞
siRNA/LNP复合体从溶酶体逃逸
(J. Mater. Chem. B, 2021,9, 5136-5149)
在载药脂质体的包封率检测方面,除了采用常规的免疫荧光法外,还可以采用密度梯度离心法。由于LNP颗粒和mRNA的浮力密度不同,LNP 浮力密度通常小于1(若N/P为6,其浮力密度约为0.96),而mRNA浮力密度约为1.8 ,可以基于LNP颗粒和mRNA密度的不同将其分开,然后再分别进行检测。贝克曼库尔特拥有一系列低速、高速和超速离心机,可对不同状态的mRNA-LNP复合物进行离心分离检测。
台式多功能离心机
高速冷冻离心机
落地超速离心机
此外,贝克曼库尔特的分析型超速离心机Optima AUC遵循第一性原理 (基于数学、物理),不需要标准品,非破坏性,可根据载药颗粒及游离药物的沉降系数不同对包封率进行准确分析(小分子药物、siRNA、miRNA等),也可用于检测游离聚合物的含量。AUC可区分空的(empty)及包裹的(full)纳米颗粒,表征纳米颗粒的纯度等。也可对纳米颗粒粒径及分子量进行准确分析,以及对纳米载药颗粒的储存条件(时间、温度)、降解原理等进行分析。除此之外,AUC 还能用于mRNA原液的检测,基于mRNA沉降系数,检测不同长度及状态的RNA,有效区分截短 mRNA、目标mRNA及mRNA聚集体等不同组分。
Optima AUC分析型
超速离心机
mRNA检测的原始结果
不同峰的分析结果
在评估LNP不同的生产工艺或批与批之间载体的一致性,还可根据其等电点范围进行质量控制。SCIEX 的PA 800 Plus制药分析系统通过等电聚焦电泳的模式对LNP进行等电点检测,分辨率可达到0.03 pI。
PA 800 Plus制药分析系统对LNP等电点进行检测
mRNA技术如今已经广泛用于肿瘤、传染性疾病、罕见遗传病等的药物开发,丹纳赫生命科学从研发到质控的一些列方案,可以帮助用户加快药物开发进展。
更多产品信息咨询,
07-01 英斯特朗
连载 | 药物一致性评价与粒度分析(三)07-01 欧美克仪器
【仪器百科】LS-909丨干湿二合一激光粒度分析仪07-01 欧美克仪器
标准物质解决方案 | PFASs(全氟及多氟化合物)06-29
第九期阿尔塔有约 | 环境专题【新污染物:PFAS】技术研讨会精彩回顾及提问解答06-29
“绿色技术范式”,分析化学未来发展方向——访中国分析测试协会副理事长、辽宁省分析科学研究院原院长刘成雁教授06-29 转载仪器信息网
华西医院-标准型数显脑立体定位仪、双通道体温维持仪、体式显微镜安装完成06-29 迈越生物
科鉴检测助力2家仪器企业获得首批产品可靠性认证证书06-28 科鉴检测
德国耶拿:锂电池生命周期分析解决方案06-28 德国耶拿
AI已来!生命科学本科教学如何紧跟技术浪潮06-28 Opentrons
盛瀚售后,五星级服务的秘诀是什么?06-28 SHINE
专为汽车制造商打造的柔性解决方案——实现制程控制06-28
西北工业大学-脑立体定位仪安装完成06-28 迈越生物
会议邀请 | 第九届海上检验医师论坛06-28
卓立要闻 | 创新发展ing…6月卓立“大事小情”速览06-28 光电行业都会关注
打造信任合作伙伴!2024年度卓立汉光客户满意度调查开启06-28 光电行业都会关注
如何挑选适用于三阶光学非线性的测量系统?Z扫描测量系统来助力!06-28 光电行业都会关注
招聘启事—中国科学院沈阳自动化研究所微纳光学测量表征技术课题组06-28 光电行业都会关注
谱育科技作为主要完成方 荣获2023年度国家科学技术进步一等奖和二等奖06-28 点击关注→
仪器原理丨顶空仪与吹扫捕集仪科普小知识06-28 天美色谱