结合/洗脱和流穿模式阳离子交换层析在纯化肠病毒中的应用
2022-07-13 18:51:51, 开朗的豌豆射手 帝肯(上海)实验器材有限公司

来自美国Merck & Co.的研究人员于2022年4月发表了题为“Application of Cation Exchange Chromatography in Bind and Elute and Flowthrough Mode for the Purification of Enteroviruses”的文章。文中,研究人员指出,肠病毒属的成员是有前途的溶瘤病毒。它们的形态发生涉及基因组包装的传染性衣壳和空衣壳的产生。后者通常被认为是需要从最终产品中去除的杂质。空衣壳和完整衣壳的分离可以通过离心方法进行,这些方法通量低且可放大性差,而可放大的层析工艺通常需要峰切割且需要在纯度和产量之间进行权衡。这里,我们证实了填充床阳离子交换 (CEX) 柱层析针对柯萨奇病毒 A21 原型株,从感染性病毒子中分离空衣壳的应用。这种分离是使用高通量层析技术开发的,并作为结合/洗脱精纯步骤规模放大。分离在宽泛的操作条件下是稳健的,并获得了高度分离的空衣壳和完整衣壳。CEX 步骤可以在具有相似选择性的结合/洗脱或流穿模式下操作,并获得70%以上的完全成熟病毒颗粒。使用其它基于基球的 CEX 层析介质也实现了类似的性能,证明了这种层析方式在柯萨奇病毒 A21 纯化中的普遍适用性。此外,CEX 用于纯化替代性肠病毒的应用被证明会导致其富集。这些结果突出了 CEX 层析在肠病毒纯化中的广泛适用性和优异性能。本文为原文内容简介,详细内容,请参考原文。
病毒成熟可能受到多种因素的影响,肠病毒(如 CVA21)的体外细胞培养生产可能不会只导致完全成熟的病毒颗粒的组装,即具有所需溶瘤活性的感染性颗粒;相反,可以组装非传染性颗粒,例如空的前衣壳。后者可能会引发不希望的免疫反应,并且通常是监管机构审查的对象。从空的原衣壳中分离完全成熟的病毒子,或从空的颗粒/衣壳中分离出完整的颗粒/衣壳,是一项具有挑战性的任务,通常通过基于颗粒之间的浮力密度差异的差速离心来进行。然而,这种分离对于大规模生物工艺来说是不可取的。因此,除了工艺(例如宿主细胞蛋白)和产物相关杂质外,还需寻求从空的原衣壳中纯化完全成熟病毒子的替代途径。在腺相关病毒载体的工艺过程中经常会遇到空的前衣壳,在这里,它们与完整颗粒的分离是通过采用离子交换层析法实现的。然而,这种分离方法会导致洗脱的完整和空颗粒的峰紧密连接,需要进行峰切割,这在生产规模上实施时具有挑战性,并且可能为了提高纯度而导致收率损失。同样,基于层析法纯化肠病毒的产品收率较低,并且主要关注与工艺相关的杂质的减少。
最近,一种新的谷胱甘肽亲和层析 (GSH AC) 捕获步骤已被证明可以从澄清的细胞培养收获液中纯化 CVA21。然而,由于 CVA21 完全成熟病毒子和空的原衣壳会发生不希望出现的共洗脱,感染时的上游工艺条件可能会挑战这一步骤。在这里,我们报告了阳离子交换 (CEX) 层析的实施,以作为纯化 CVA21 的精纯步骤。病毒在贴壁细胞培养中生产,并在三柱工艺中纯化,工艺采用 GSH AC 步骤、中间离子交换 (IEX) 层析步骤和 CEX 精纯步骤。采用高通量层析技术开发基于 CEX 的精纯步骤,并生成有关其广泛适用性的信息。已经证明,CEX 层析可以在结合/洗脱或流穿模式下稳健地运行,在这两种情况下都可高收率地获得成熟病毒颗粒,同时从所得产物池中消除空的前衣壳。当以结合/洗脱模式部署时,精纯步骤以浓缩形式洗脱完全成熟的病毒颗粒,并且分离效果显示出与空前衣壳的基线分辨率。研究还证明了 CEX 精纯步骤的可放大性,并且进一步表明,使用多种阳离子交换填料可以从空的前衣壳中高效且有效地纯化 CVA21 完整颗粒。该步骤的通用性通过证明其在纯化不同于 CVA21 的肠病毒中的应用而得到进一步证实。这些结果证明了阳离子交换层析在肠病毒纯化中的价值。
详细的实验操作步骤,请参考原文。
高通量层析:RoboColumn层析
使用 GSH AC 产物作为进样料液,总共进行了 16 次基于 RoboColumn 的分离(表 1)。分离#1 – 14 和#16 使用 200 μL RoboColumns,旨在评估在选择的离子交换填料上从空的前衣壳中分离完全成熟的病毒颗粒。分离 #15 使用 600 μL RoboColumns,以评估完全成熟的病毒颗粒与工艺相关杂质的分离。此外,分离#1 – 6 和#10 – 16 以结合/洗脱模式运行,而分离#7 – 9 以流穿模式运行。

表 1:高通量 RoboColumn 层析分离的详细信息,通过结合/洗脱和流穿模式阳离子交换层析和阴离子交换层析筛选柯萨奇病毒 A21 的精纯纯化,包括填料、流动相条件、相持续时间、柱体积(CV) 和梯度斜率。在所有分离中,除了柱的淋洗外,所有阶段的 pH 值都保持恒定。 [NaCl] 描述了每次分离中平衡 (Equil.)、上样和漂洗缓冲液中的 NaCl 浓度。在适用的情况下,该浓度也是洗脱梯度中的起始浓度。分离#1 – 6、#10 – 14 和#16,使用200 μLRoboColumns和来自上游工艺 B 的澄清细胞培养收获液 (CCCH)。分离 #15 使用600 μL RoboColumns和来自上游工艺 A 的CCCH。在所有分离中,收集的馏分的标称体积为 200 μL。
对于所有分离,每 200 μL馏分收集在透明 96 孔微孔板中,并在 M1000pro 读板器上以 260 nm、900 nm 和 990nm 读取。后两个波长用于光程校正目的。进行的测量用于构建色谱图,其用于设计收集馏分的合并以及识别需要进一步分析的馏分。在这里,馏分以一种特定方式合并,最多可产生5个包含流穿馏分 (FT1 – FT5) 的池,1个包含漂洗馏分 (W) 的池和一个包含洗脱馏分 (S) 的池。除非另有说明,否则在 RoboColumns 洗脱过程中收集的馏分通常以三种不同的方式(即 E1 - E3)合并。池 E1 和E2 分别包含在主洗脱峰的大约前半部分和后半部分收集的馏分。池 E3 包含池 E1 和 E2 中包含的所有馏分,以及池 E2 中最后一个馏分后收集的一些馏分。合并在一个单独的 Tecan EVO 200 机器人站上进行,该站由 EVOware v2.8 操作,配备 8 通道一次性针液体处理臂。在这里,通过在 Thermo Scientific™ Armadillo PCR 96 孔板的单独孔中混合等体积的目的馏分(每个 RoboColumn)以所需体积生成池。每个池中包含的部分在表 S1(支持信息)中有详细说明。生成的池和馏分要么立即分析,要么储存在 4 ℃ 或 –70 ℃ 直至分析。含有馏分和池的板用 Thermo Scientific™ Nunc™ 密封胶带密封。
详细的实验结果和分析,请参考原文。
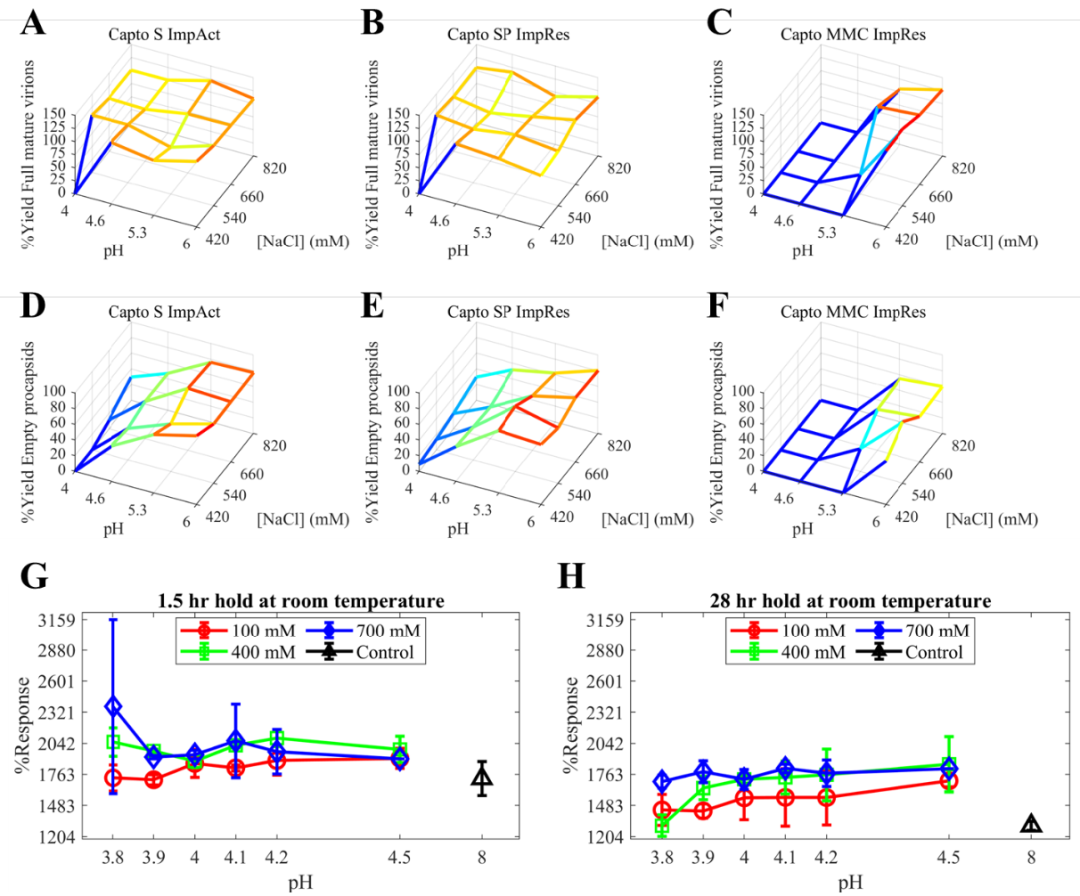
图 1:柯萨奇病毒 A21 的初步高通量阳离子交换批量层析筛选结果及其感染性对液体条件和时间的依赖性:(A) – (C) 完全成熟病毒颗粒的流穿收率与结合 pH 值及 NaCl 浓度的相关性([ NaCl]),填料分别为 Capto S ImpAct、Capto SP ImpRes、Capto MMC ImpRes;(D) – (F) 空前体衣壳的流穿收率与结合 pH 值及 NaCl 浓度([NaCl]) 的相关性,填料分别是 Capto S ImpAct、Capto SP ImpRes、Capto MMC ImpRes ;(G) 和 (H) %响应,基于实施的病毒成像感染性分析,描绘 CVA21 的感染性,作为 pH 值的函数,分别在室温下保持 1.5 小时和 28 小时。在 (A)– (F) 中,收率(z 轴)是技术重复的平均值。在 (G) 和 (H) 中,符号 (o)、(□)和 (◊)分别对应420 mM、540 mM、660 mM 和 820 mM 的 NaCl 浓度,符号(Δ)对应于非酸性对照样品。误差线对应于 ±1 标准偏差 (sd)。
图 2:结合/洗脱 Poros 50 HS高通量 RoboColumn 层析结果,用于从空的前衣壳中分离出完全成熟的柯萨奇病毒 A21 病毒颗粒:(A) 色谱图的3D 图作为柱体积的函数(x 轴上的 CV)来自六个分离(#1 - 6),每个使用不同的 pH 值(y 轴)条件。线 (-) 和 (--) 分别表示归一化吸光度 (Abs.) 和盐水平的最大值,符号 (○)和 (□)表示重复实验 (R1 和 R2)。z 轴是从 0 到 1 的标准化比例,其中 1 表示最大值;(B) 完全成熟的病毒颗粒洗脱收率 (○)、条带收率 (□)、质量平衡 (◊)和空的前衣壳洗脱收率 (Δ)。误差线对应于 ±1 标准偏差 (sd);(C) 作为 pH 函数的主洗脱峰的洗脱盐水平。通过识别与洗脱峰开始相关的部分来确定盐水平。
总结
空病毒颗粒代表了病毒疫苗和基因治疗药物生产中具有挑战性的产品相关杂质。它们与完全成熟颗粒的分离通常需要不适合大规模处理的技术。虽然可以使用基于阴离子交换层析的纯化,但这些纯化通常受到两种颗粒类型之间的低选择性以及峰切割导致的显著纯度与收率权衡的限制。阴离子交换层析的应用被证明在从空的前衣壳中分离完全成熟的 CVA21 病毒颗粒方面是无效的。相反,以结合/洗脱或流穿模式操作的阳离子交换层析可导致完全成熟的 CVA21 颗粒的高收率,且不含空的前衣壳。在结合/洗脱模式下,CEX 步骤能够很容易地大规模实施,因为它具有良好的稳健性、易于操作以及能够实现的高效后续处理。虽然该步骤的主要结果是将空的 CVA21 前衣壳与完全成熟的颗粒分离,但也表明 CEX 步骤有助于下游纯化工艺的稳健性;它去除了之前的纯化步骤没有完全清除的蛋白质杂质,并且可以在存在进样液流可变性的情况下将完全成熟的颗粒与主要的工艺相关杂质分离。这些观察结果支持将阳离子交换层析法应用作为纯化 CVA21 的精纯步骤。此外,初步证据表明,这种有效的纯化方式可扩展到多种阳离子交换填料和其它肠病毒,支持其作为基于肠病毒的治疗产品的通用技术。
原文:S.Konstantinidis, M.R.Poplyk, A.R.Swartz, et al., Application ofCation Exchange Chromatography in Bind and Elute and Flowthrough Mode for the Purification of Enteroviruses. 2022. http://dx.doi.org/10.2139/ssrn.4079232.
相关阅读
_
● 自动化高通量平行层析法,加速早期纯化工艺开发
►
关于帝肯
帝肯(www.tecan.com)是在全球范围内提供生物制药、法医学和临床诊断实验室仪器和解决方案的供应商。公司专门从事生命科学领域实验室自动化工作流程解决方案的开发、生产和分销。其客户包括制药和生物技术公司、大学研究部门、法医和诊断实验室。作为一家原始设备制造商(OEM),帝肯也是开发和制造OEM仪器和部件的一员,然后由合作公司分销。公司于1980年在瑞士成立,在欧洲和北美均设有生产、研发基地,并在52个国家设有销售和服务网络。2020年,帝肯销售额为7.309亿瑞士法郎(约7.81亿美元)。帝肯集团的注册股份在瑞士六大交易所(TECN;ISIN CH0012100191)交易。
帝肯热线:4008 213 888
帝肯官网:www.tecan.com
07-01 英斯特朗
连载 | 药物一致性评价与粒度分析(三)07-01 欧美克仪器
【仪器百科】LS-909丨干湿二合一激光粒度分析仪07-01 欧美克仪器
标准物质解决方案 | PFASs(全氟及多氟化合物)06-29
第九期阿尔塔有约 | 环境专题【新污染物:PFAS】技术研讨会精彩回顾及提问解答06-29
“绿色技术范式”,分析化学未来发展方向——访中国分析测试协会副理事长、辽宁省分析科学研究院原院长刘成雁教授06-29 转载仪器信息网
华西医院-标准型数显脑立体定位仪、双通道体温维持仪、体式显微镜安装完成06-29 迈越生物
科鉴检测助力2家仪器企业获得首批产品可靠性认证证书06-28 科鉴检测
德国耶拿:锂电池生命周期分析解决方案06-28 德国耶拿
AI已来!生命科学本科教学如何紧跟技术浪潮06-28 Opentrons
盛瀚售后,五星级服务的秘诀是什么?06-28 SHINE
专为汽车制造商打造的柔性解决方案——实现制程控制06-28
西北工业大学-脑立体定位仪安装完成06-28 迈越生物
会议邀请 | 第九届海上检验医师论坛06-28
卓立要闻 | 创新发展ing…6月卓立“大事小情”速览06-28 光电行业都会关注
打造信任合作伙伴!2024年度卓立汉光客户满意度调查开启06-28 光电行业都会关注
如何挑选适用于三阶光学非线性的测量系统?Z扫描测量系统来助力!06-28 光电行业都会关注
招聘启事—中国科学院沈阳自动化研究所微纳光学测量表征技术课题组06-28 光电行业都会关注
谱育科技作为主要完成方 荣获2023年度国家科学技术进步一等奖和二等奖06-28 点击关注→
仪器原理丨顶空仪与吹扫捕集仪科普小知识06-28 天美色谱