Cell & Nat Comm | 2022连发 蛋白组技术首次报道tau蛋白互作组图谱与琥珀酰化修饰图谱
2022-01-25 11:12:23, 景杰生物 杭州景杰生物科技股份有限公司
景杰生物 | 报道
蛋白组绘制tau蛋白互作图谱

研究团队还发现AD患者的tau互作蛋白含量更低,其降低的水平与疾病严重程度相关。进一步说明了与 Tau相互作用的蛋白质可能在 AD 发病机制中发挥重要作用。该研究为对抗神经退行性疾病提供了潜在的tau靶向策略。

相互作用组映射与神经变性相关的突触和线粒体过程图解
tau蛋白琥珀酰化修饰新发现

研究人员分别通过非标记 (label-free) 定量、TMT (Tandem Mass Tag) 同位素标记定量蛋白质组学技术在AD和健康组脑组织标本中定性鉴定到4,678种蛋白质以及314种发生了琥珀酰化修饰的蛋白质 (包括tau和APP;图1b, d),其中,定量检测到的259种琥珀酰化蛋白质中,有245种可以通过label-free定量蛋白质组学技术鉴定到 (图1e),覆盖率约95%。

图1 蛋白质定量及琥珀酰化修饰组学研究AD及健康脑组织
通过对314种琥珀酰化蛋白质进行亚细胞定位分析,研究人员发现大部分蛋白质为线粒体蛋白。其中,丙酮酸脱氢酶复合体 (PDHC) 以及TCA循环关键酶的琥珀酰化修饰水平最高;此外琥珀酰化修饰位点也在不同蛋白质间彼此区别。

图2 琥珀酰化修饰蛋白质的亚细胞定位及修饰位点分析
重要的是,研究人员发现琥珀酰化修饰同样发生于两个在AD疾病中发挥关键作用的蛋白质——tau和APP (图3a, b)。其中, tau K311和APP K687的琥珀酰化修饰只存在于AD患者的脑组织中,在健康组中并没有出现 (图3a, b)。在能模拟AD的模型小鼠 (TgP301S) 中,研究人员利用免疫荧光技术进一步调查了tau和APP的琥珀酰化修饰水平与AD疾病进展的关系。在AD小鼠海马CA1区,随着小鼠年龄的增长,病理性tau (绿色T22;图4c)、APP (绿色NU-1;图3e) 、淀粉样斑块 (绿色Aβ;图3f) 的含量都发生了明显增加;随后,用泛琥珀酰化修饰抗体 (洋红色SL;图c, d, e和f) 做双荧光共定位分析时,研究人员发现,区别于持续增长的磷酸化修饰水平 (绿色AT8;图3d),tau的琥珀酰化修饰水平 (白色;图3c, d)却随着小鼠年龄的增长而下降,提示在AD发展过程中,两种修饰在调节tau功能上存在潜在的相互联系。此外,研究人员同时观察到了,APP的琥珀酰化修饰水平 (白色;图3e) 在AD发展中持续增加的现象,暗示琥珀酰化修饰可能在APP裂解形成Aβ沉积过程中发挥重要作用。
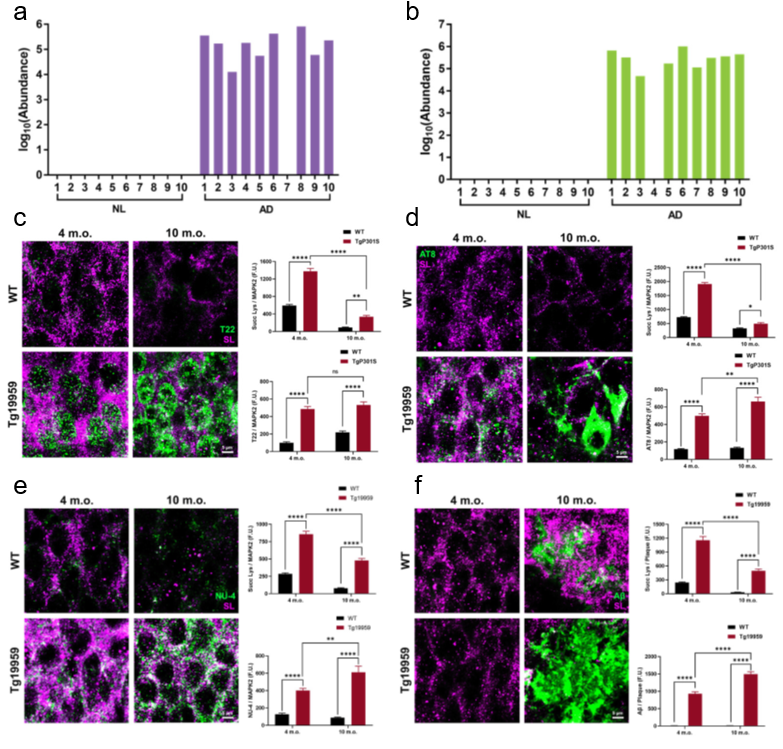
图3 tau和APP的琥珀酰化修饰水平在AD发展过程中的动态变化
在本项研究中,作者首次利用琥珀酰化修饰组学,系统地研究了AD患者脑组织中蛋白质琥珀酰化修饰水平的变化,发现了AD关键蛋白tau和APP可以发生琥珀酰化修饰,并在AD小鼠模型中,动态观察了两种蛋白的琥珀酰化修饰水平与AD疾病进展的内在联系。琥珀酰化将线粒体功能障碍与淀粉样变性和 tau 病变联系起来的发现可能提供新的分子诊断方法以及潜在的治疗靶点。
后记
由于阿尔兹海默症主要是由神经元的大量不可逆性死亡引起的,并且神经元无法再生,因此控制它的关键在于早期发现及干预,而这迫切需要发现新的分子机制和诊断标志物。
蛋白质翻译后修饰几乎影响了正常细胞生物学和发病机制的所有方面,越来越多的研究者通过蛋白质修饰手段,为描绘AD轮廓提供了非常有价值的线索和依据,同时引入了新的见解和思路。
早在2010年,芝加哥大学赵英明教授团队就首次利用质谱技术证实了赖氨酸琥珀酰化修饰在真核及原核生物蛋白质中的存在[2],相关结果发表在Nature Chemical Biology,并被评为该杂志创刊10年39篇精品论文之一。随后的十年中,有关琥珀酰化修饰的研究工作则如“雨后春笋”般涌现,在细胞多层面功能的调控机制中都发现了琥珀酰化修饰发挥着举足轻重的作用。
近些年,利用基于高灵敏度质谱技术的蛋白质组学及蛋白质修饰组学手段,精准了解AD患者大脑蛋白质网络的复杂变化以找到有效的预防、治疗药物便成为了许多科学家努力的方向。

往期推荐
2021-12-06

2021-08-25

2021-05-19

2020-11-02

2020-10-16


02-21
安捷伦入选Just Capital 2024最公正公司榜单50强02-21
「龙」重登场!新一代 I 级超纯水净化系统02-21
仪器租赁 | 沃特世 液质联用,月租金52000元起02-21
验收监测时二氧化硫全部未检出,如何计算总量?02-21 检测家
2024食药主题会议计划02-21
2023年度第三方环境监测从业者绩效奖金02-21 生态环境监测互动
喜报!开元仪器荣膺长沙县共同富裕先进表彰双项殊荣02-21
开工大吉 | 培训班助力您快速入门、熟练上手02-20 沃特世技术服务
工程师说仪器 | 您的沃特世新机维保指南02-20 沃特世技术服务
用户福利 | 2024年第二期扫描电镜高阶应用线上培训02-20 TESCAN中国
@检测人,复工必读这些好书!02-20 中国认证认可
重磅文件发布!涉及检验检测领域02-20 实验室技术咨询
天净 苏玛罐,专利惰硅镀层,适用于VOCs采样02-20 cici
omg OMx 播客 | Enveda Biosciences 高级科学家 Pelle Simpson02-20 制药高能火箭队
讲座通知 | 捕集离子淌度飞行时间质谱发展史02-20 4D-组学老虎队
迈入新年,单细胞蛋白质组学服务强势上线!02-19 莲莲看
快讯 | 一地将认定首批市级重点实验室;珂睿科技完成数千万A2轮融资…02-19
全国重点实验室,布局统计!02-19
仪器租赁 | 赛默飞 气质联用,月租金13220元起02-19
