Nature背靠背|乳酸,肿瘤“贿赂”Treg的“代谢货币”
2021-04-07 22:32:17, 景杰学术 杭州景杰生物科技股份有限公司

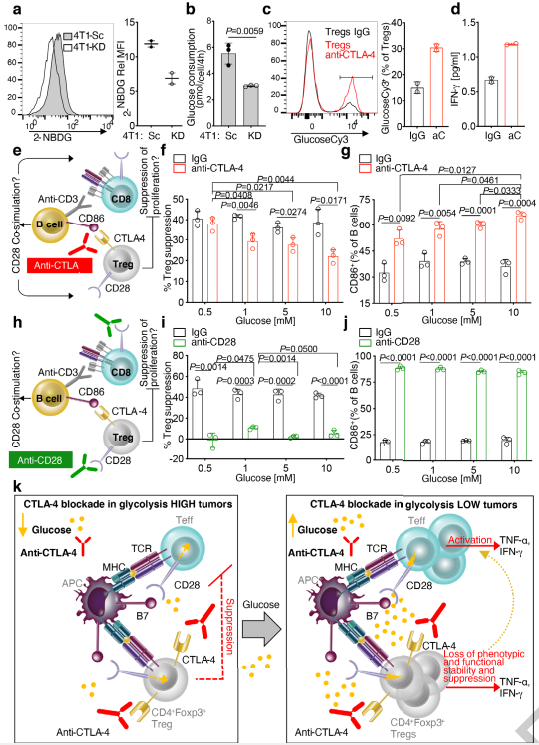
乳酸对Treg细胞的代谢支持作用




低糖酵解性肿瘤中,阻断CTLA-4有效地使Treg失活


往期推荐
2021-03-15

2020-11-27

2020-08-25

2019-10-24

2020-07-23

景杰学术 的近期文章
其他厂商的近期文章
追忆星空回响,坚守使命信念——中科科仪与“东方红一号”的峥嵘岁月
04-24
激光在激光粒度分析仪中的作用04-24 真理光学粒度仪
LT3600 Plus激光粒度分析仪04-24 真理光学
真理光学诚邀你参加粉体圈第八届全国氧化铝会议04-24 真理光学粒度仪
珂睿科技诚邀您参加广西分析仪器设备应用技术交流会!04-23 珂睿marketing
终于来啦,MitoTracker小包装04-23 赛默飞生命科学
践行新质生产力:Chromeleon CDS简化您的工作流04-23 飞飞
【报名火爆】2024单细胞蛋白质组学技术与产业应用研讨会线上直播通道发布!04-23
特洁安Aquafine助力河南电子半导体客户高品质生产,为“中国芯”提供有力保障04-23
隆重上市!第六代频率步进三维探地雷达突破地下调查的界限04-23 专业的
降本增效 | 奥豪斯称重产品助力制药行业04-23 奥豪斯
Aliben动态 | 俄罗斯科学院院士Valery Tuchin教授到访艾立本科技参观交流04-23 艾立本科技
春启青莲礼,血浆免费试 | 高深度血浆蛋白质组限时免费测!04-23
抢占报名 | 4月25日“御光同行”光电技术与应用研讨会昆明专场04-23 聚焦光电前沿领域
【Vocus B文献分享】一种可检测有机和无机物种的中压化学电离反应腔表征04-23
德国元素TOC总有机碳分析仪线下用户培训邀请函(第一轮通知)04-23
最高91分,机会巨大!答题赛最后12小时,通道即将关闭!04-23 市场宣传部
【 Stage-RTL反射率测试】典型配置、硬件说明、软件操作04-23
相约青岛-第六届大气臭氧污染防治研讨会04-22 TOFWERK中国
从专家共识看吉比爱如何布局质谱自动化及应对临床质谱挑战04-22 华大吉比爱
