肠道微生物代谢物-小分子大作用
2018-12-27 12:00:30, Metabo-Profile 麦特绘谱生物科技(上海)有限公司

人体生态环境中共生着结构复杂、数量庞大的微生物群,通过长期与人类(宿主)协同进化,已成为维持人类健康不可忽视的重要“功能器官”。肠道微生物能够参与调节宿主的多个代谢途径,与宿主代谢互作、信号转导,形成在生理上连接肠道、肝脏和大脑的免疫-炎症轴。肠道微生物与宿主免疫系统的互作从出生开始,参与机体免疫系统发育形成过程,同样,机体免疫系统也会对微生物的组成产生影响。
要研究肠道菌群和宿主之间的这一复杂的代谢体系,代谢组学是目前较为有效的研究手段之一。代谢组学作为一种相对全面、连续动态、无刺激的分析手段,能够客观地检测肠道微生物的代谢组分及浓度,展示肠道菌的代谢状态,从而让我们更好地了解肠道微生物群如何通过肠道菌群代谢及与宿主共代谢来影响宿主的代谢状态。实践证明:将代谢组学与微生物组学及分子生物学手段相结合,在系统生物学水平上建立宿主代谢与肠道菌群的关联模型,帮助我们了解肠道菌群在宿主中的代谢过程是合理且可行的。
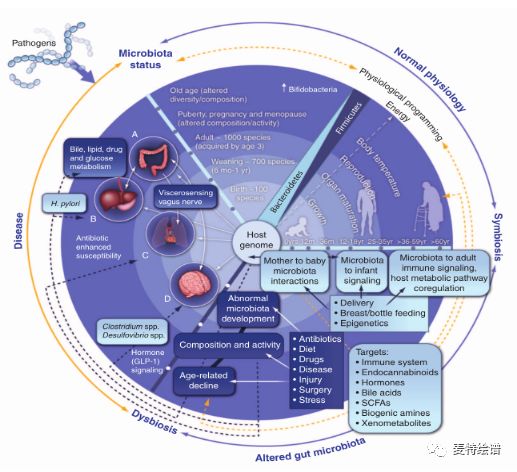
宿主与肠道菌在参与食物或外源性物质共代谢时产生了大量小分子代谢物,这其中存在一些对宿主细胞、肠道菌信息传递中起关键作用的分子。肠道的不同段有着不同的优势菌群,肠道每一部位都有特定的菌群间交流(包括食物链、信息传递、气体递质等)及宿主—菌群间交流的化学信号,这些“信号分子”包括低分子量代谢物,多肽,蛋白质等,它们甚至能够代替某些间接性免疫调节通路。十几年来,通过非靶向及靶向代谢组学分析,我们已经确定了300多种常见的菌群-宿主代谢物,包括胆汁酸、短链脂肪酸、氨基酸、苯甲酰和苯基衍生物、吲哚衍生物、脂类、胆碱、酚类、脂类、维生素、激素类以及多胺类等,其在宿主中扮演着重要的角色。现将主要的肠道菌相关代谢物、相关菌群及潜在的生物学功能做一总结。
代谢物
相关菌群
潜在生物学功能
短链脂肪酸(SCFAs):乙酸,丙酸,丁酸,异丁酸,2-甲基戊酸,戊酸,异戊酸,己酸
Clostridial clustersIV and XIVa of Firmicutes,包括真细菌,罗氏菌,柔嫩梭菌,粪球菌等
降低结肠PH;抑制致病菌生长;刺激水、钠的吸收;参与胆固醇合成;为结肠上皮细胞提供能量;参与肥胖、胰岛素干扰、Ⅱ型糖尿病、结肠癌等的形成
胆酸:胆盐,氧化胆酸盐,脱氧胆酸盐,鹅去氧胆酸盐,α-鼠胆酸盐,β-鼠胆酸盐,ꞷ-鼠胆酸盐,牛磺胆酸盐,甘氨胆酸盐,牛磺鹅去氧胆酸盐,甘氨鹅去氧胆酸盐,牛磺-α-鼠胆酸盐,牛磺-β-鼠胆酸盐,解离石胆酸,乌索脱氧胆酸盐,氧化脱氧胆酸盐,甘氨脱氧胆酸盐,牛磺氧化胆酸盐,牛磺脱氧胆酸盐
乳酸杆菌,双歧杆菌,肠杆菌,拟杆菌,梭菌
吸收膳食脂肪类和脂溶性维生素;促进脂质吸收;维持肠道屏障功能运转;传导内分泌功能的信号从而调节甘油三酯、胆固醇、葡萄糖、能量物质等平衡
胆碱代谢:甲胺,二甲胺,三甲胺,氧化三甲胺,二甲基甘氨酸,甜菜碱
柔嫩梭菌,双歧杆菌
调节脂质代谢及葡萄糖平衡;参与非酒精性脂肪肝、饮食性肥胖、糖尿病、心脏病的发生
多酚,苯甲酰,苯类衍生物:苯甲酸,马尿酸,2-羟马尿酸,2-羟苯甲酸,3-羟马尿酸,3-羟苯甲酸,4-羟苯甲酸,3-羟苯丙酸,4-羟苯丙酸,3-羟基肉桂酸乙酯,4-甲酚,酪氨酸,苯丙氨酸,4-甲酚,4-甲苯基硫酸盐,4-甲苯基葡糖苷酸,4-羟苯基乙酸,3,4-对羟苯基乙酸,苯乙尿酸,苯乙酰谷氨酰胺,乙酸苯酯,苯丙酸,苯丙甘氨酸,肉桂酰甘氨酸
艰难梭菌,普拉氏梭杆菌,双歧杆菌,Subdoligranulu-m,乳酸杆菌
外源性物质的解毒;预示肠道菌结构及活动;分解利用多酚类化合物;尿液中的马尿酸可能是高血压和肥胖的标志性化合物;尿液中4-羟苯基乙酸,4-甲酚及乙酸苯酯在大肠癌中含量增加;尿液中4-甲苯基硫酸盐在重度自闭症儿童中含量增加
吲哚衍生物:N-乙酰色氨酸,吲哚乙酸,吲哚乙酰色氨酸,吲哚,吲哚硫酸盐,吲哚-3-丙酸,褪黑激素,褪黑激素-6-硫酸盐,血清素,5-羟基吲哚
产芽胞梭状芽胞杆菌,大肠杆菌
保护胃肠道系统免受压力引起的疾病;调节促炎基因的表达;增加抗炎基因的表达;加强肠上皮细胞屏障作用;涉及肠道病变、脑肠轴和一些神经性疾病的发生过程
维生素:维生素B12,生物素(维生素H),叶酸(维生素B9),硫胺素(维生素B1),核黄素(维生素B2),吡哆醇(维生素B6)
双歧杆菌
补充体内维生素;增强免疫力;发挥表观遗传作用来调节
多胺:腐胺,尸胺,亚精胺,精胺
空肠弯曲杆菌,解糖梭菌
对宿主有基因毒性;有抗肿瘤,抗炎作用;潜在的肿瘤标志物
脂质:共轭脂肪酸,脂多糖(LPS),肽聚糖,酰基甘油,鞘磷脂,胆固醇,卵磷脂,磷酸乙醇胺,甘油三脂
双歧杆菌,罗氏菌,乳酸杆菌,克雷伯氏菌,肠杆菌,枸橼酸杆菌,梭菌
影响肠道渗透性,激活肠-脑-肝神经轴从而调节糖平衡;脂多糖会导致慢性系统性炎症;共轭脂肪酸能改善高胰岛素血症,提高免疫系统,调节脂蛋白含量;胆固醇是甾醇,胆酸的基本组成成分
其他:D-乳酸,甲酸盐,甲醇,乙醇,琥珀酸盐,赖氨酸,葡萄糖,尿素,a-酮异戊酸,肌酸,肌酸酐,内源性大麻素,花生酰基甘油(2-AG),N-花生酰基乙醇胺,脂多糖(LPS)等
拟杆菌,假丁酸弧菌,瘤胃球菌,柔嫩梭菌,Subdoligr-anulum,双歧杆菌,奇异菌属,厚壁菌门,乳酸杆菌
直接或间接地参与合成、利用化合物,调节包括内源性大麻素系统等代谢通路
近年来,肠道菌群结构及其代谢物谱与宿主代谢之间的相互作用已经在各种动物模型和人群中展开研究,实验数据表明:肠道菌群生态失衡与许多疾病的发生具有密切的相关性,如肠易激综合征、肿瘤(肠癌、肝癌、口腔癌)、肾衰竭、肥胖与糖尿病等,肠道微生物代谢物作为互补的宿主受体成为关键信号分子会产生重要影响,利用微生物代谢组学可以监测这些“信号分子”的变化及影响。代谢组学研究还可帮助我们探究益生菌、饮食或运动等干预方式如何影响肠道菌群从而影响宿主的健康状况,例如非靶向代谢组学分析显示四甲基哌啶能通过调节短链脂肪酸(SCFAs)代谢通路进而影响宿主肝糖分解,糖酵解,脂质分解,使机体达到减肥的效果。此外,从代谢组学视角出发还将有助于我们阐释肠道菌群在药物代谢中的作用。例如,CD 6168是抗丙型肝炎(HCV)药物Deleobuvir代谢的一个关键性代谢物,其在正常大鼠血清中的含量9倍于抗生素处理鼠,研究发现在抗生素处理鼠体内,Deleobuvir几乎全部被由粪便排出,这说明肠道菌群在一些药物的吸收中扮演着举足轻重的作用。

毫无疑问,微生物代谢组学的发展能够显著加快肠道菌代谢模式分析、肠道菌群-宿主的相互作用研究。但在肠道菌群代谢组学的研究中仍面临诸多挑战。首先,肠道菌群代谢物混杂着未消化的食物及宿主分泌物等异质性物质易被干扰;其次,基于质谱和核磁共振技术的高通量代谢组学数据库需不断完善。而该研究最大的瓶颈是缺乏在高效灭活的同时分离细胞内外代谢产物的可靠方法,特别是胞内的指纹分析、胞外的足迹分析以及整个代谢物的靶标和轮廓分析,需要对细胞内外代谢产物进行有效的分离才能够准确进行。想实现肠道菌群研究到临床转化仍面临巨大挑战。
但近20年,对各类微生物基因组测序获得了绝大多数微生物基因数据。在这个现成的框架内研究人体中微生物及其代谢产物和人体的关系成为微生物代谢组学的一大优势。使用相关信息研究基因调控、代谢网络和微生物细胞生理学方面也更为简便。因此,基于代谢组学的人体微生物研究及微生态与代谢精确关联的研究必将应用于人类健康相关的探索。
参考文献
1
Nicholson JK, Holmes E, et al. Host-gut microbiota metabolic interactions. Science, 336(6086): 1262-7, 2012.
2
Zheng, XJ., Xie, G.X.,, Zhao, A.H., Zhao, L.J., Yao, C., Chiu, N.H., Zhou, Z.X., Bao, Y.Q., Jia, W.P., Nicholson, J.K., Jia, W*. The footprints of gut microbial-mammalian co-metabolism. Journal of Proteome Research, 10(12):5512-22, 2011.
3
McCabe M, Sane RS, Keith-Luzzi M et al. Defining the role of gut bacteria in the metabolism of deleobuvir: in vitro and in vivo studies. Drug Metab Dispos 43:1612–1618, 2015.
4
Cai J, Zhang L, Jones RA et al. Antioxidant drug tempol promotes functional metabolic changes in the gut microbiota. J Proteome Res 15:563–571, 2016.
5
Zhang C, Yin A, Li H et al. Dietary modulation of gut microbiota contributes to alleviation of both genetic and simple obesity in children. EBioMedicine 2:966–982, 2015.
6
Kieffer DA, Piccolo BD, Vaziri ND et al. Resistant starch alters gut microbiome and metabolomics profiles concurrent with amelioration of chronic kidney disease in rats. Am J Physiol Renal 310: F857–F871, 2016.
7
Lin H, An Y, Hao F et al. Correlations of fecal metabonomicand microbiomic changes induced by high-fat diet in the pre-obesity state. Sci Rep 6:21618, 2016
8
Sridharan GV, Choi K, Klemashevich C et al. Prediction and quantification of bioactive microbiota metabolites in the mouse gut. Nat Commun 5:5492,2014.
9
Zhao LJ, Ni Y, et al. High throughput and quantitative measurement of microbial metabolome by gas chromatography/mass spectrometry using automated alkyl chloroformate derivatization. Analytical Chemistry. 89 (10) :5565-5577, 2017.
微信公众号:麦特绘谱
Tel:400-867-2686
Email : admin@metaboprofile.com
Web: www.metaboprofile.com
06-11
会议邀请 | 2024广东省材料分析测试技术大会06-11 材料表征的领跑者
【重磅新品】全球最新绿色节能冷冻干燥机闪亮登场——步琦冷冻干燥机Lyovapor L-250重新定义生态效益性!06-07 YYC
【应用】步琦近红外快速测定注射液浓度——协助确保药物安全性06-07 CZK
新芝生物丨基因导入仪全新版本震撼来袭!06-06 SCIENTZ
新芝生物丨超声技术在脂质体制备中的应用研究06-06 SCIENTZ
固相萃取-毛细管电泳检测环境中头孢类抗生素06-06 Unimicro
Nature 发文! 如果有一天,线粒体也能被移植……06-06 小 M
实验操作 | 小白第一课!基础细胞培养方法及步骤06-06 小 M
科研助攻 | Nature Review:癌症治疗抗体药物最新综述06-06 小 M
端午礼遇 | 玩游戏,选周边,宠粉福利,只 "粽" 意 你~06-06 小 M
发货通知 | MCE 中国祝大家端午安康06-06 小 M
“岛津森林”项目06-05 医疗中心
浙江以检测赋能新质生产力06-05
2025版《中国药典》收官在即,变化要点有哪些?要注意哪些方面?06-05
吸附管采集固定污染源废气中的VOCs时的采样流量要求?06-05 检测家
内卷加剧,检测机构如何破局应对?06-05
【人民日报国际】在收获与播种交织的芒种中国时刻,张轶昊谈创新。06-05
德国元素耗材之星 | 固体压样器/液体封样器06-05
夏日焕新 谱写新章 | 德米特第四届“互动日”惊喜而至06-05