干货分享 | 新原料账号权限申请指引【含资料包】
2024-06-14 13:41:13, 妆博士 1有限公司

对于化妆品新原料申报来说,新原料的账号权限开通是重要的前提条件。为使更多未开通过新原料账号权限的企业能更顺利地开通相关权限,小妆为大家编写了一份申请指引文件,通过模拟操作给大家示范新原料账号权限的相关流程和资料要求。
ZHUANGBOSHI
1.申请国家药品监督管理局政务服务门户账号
https://zwfw.nmpa.gov.cn/web/user/login
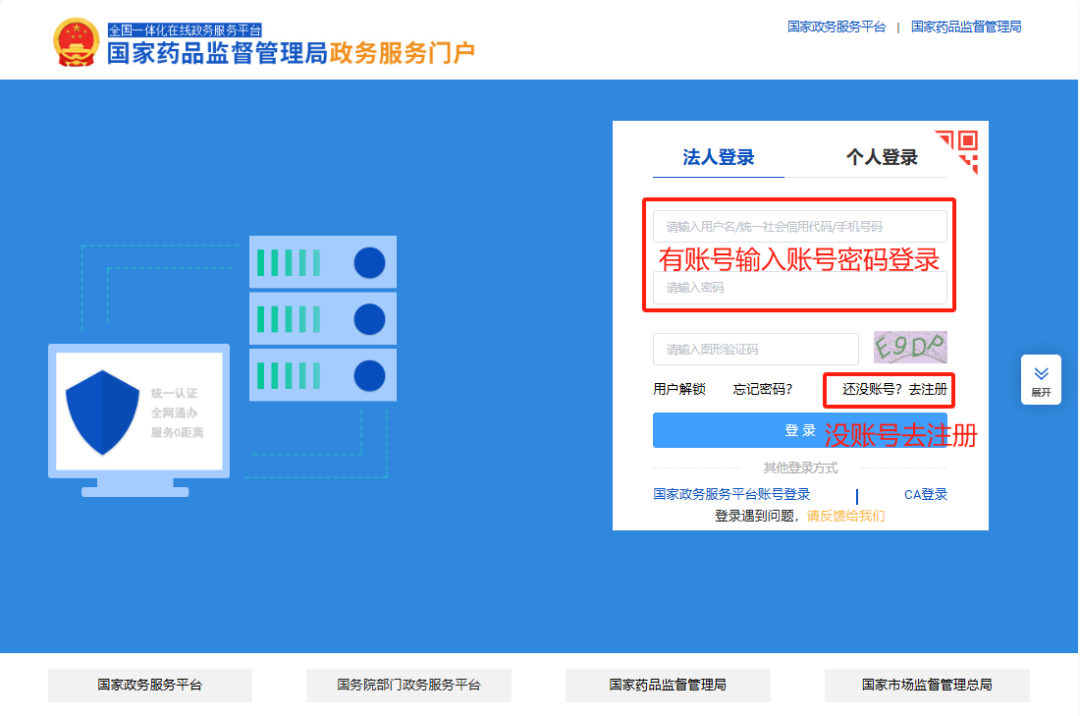
注册分三步,账号注册成功后,会获得平台相应的功能。
1
注册-填写认证信息

2
注册-创建用户
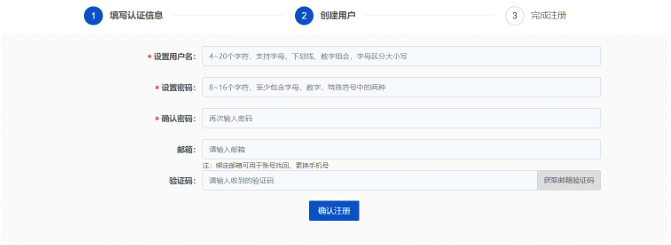
3
注册-完成注册

ZHUANGBOSHI
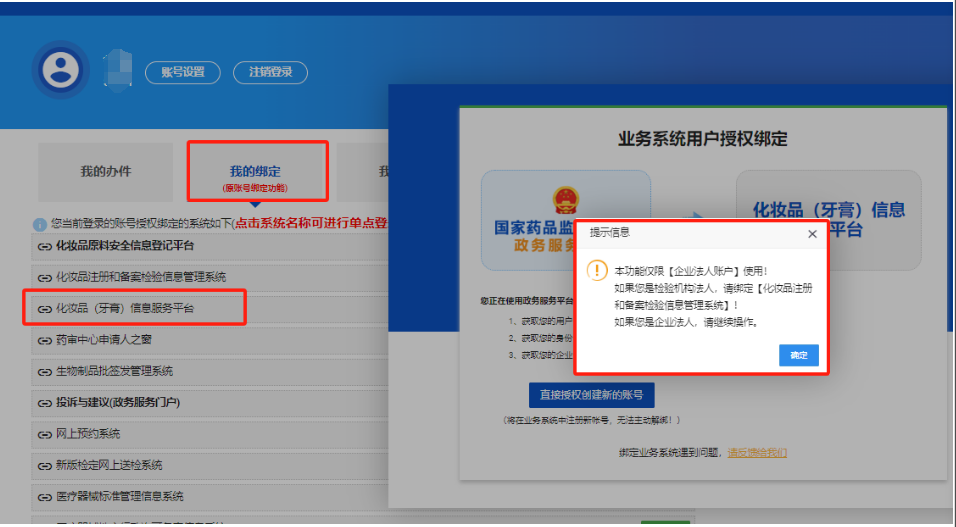
2.登录国家药品监督管理局政务服务门户,绑定“化妆品(牙膏)信息服务平台”
1
进入账号,

2

3
授权绑定“化妆品(牙膏)信息服务平台”
ZHUANGBOSHI
3.企业信息填写
1

2
选择“新原料用户”
3
新原料用户类型及角色类型示意
新原料用户分为注册人/备案人、境内责任人两种角色类型。
注册人/备案人:申报新原料注册的企业。
境内责任人:境外新原料生产企业授权的注册在我国境内的企业法人。

ZHUANGBOSHI
4. 新原料注册人/备案人权限申请
1
进入“企业信息资料提交”界面
2
3
选择角色类型为注册人/备案人,进入注册人/备案人新增页面。
录入字段内容并上传相关附件后,
4
录入不良反应监测评价体系概述表并上传相关附件。
此处审查要点:
(1) 是否有专职岗位/人员设置,人员基本要求描述;
(2) 安全风险监测体系的整体构成和运行模式;
(3)所有主动或被动的有关化妆品新原料的使用和安全情况信息收集渠道,以及信息收集的频率;
(4)安全风险评价的完成方式及评价标准;
(5)安全风险评价后相应处置措施。
5
录入所有必填内容,生成文件,导出,逐页加盖公章、手签日期后上传,
审核周期为自提交资料起7工作日内审核。
ZHUANGBOSHI
5. 新原料境内责任人权限申请
1
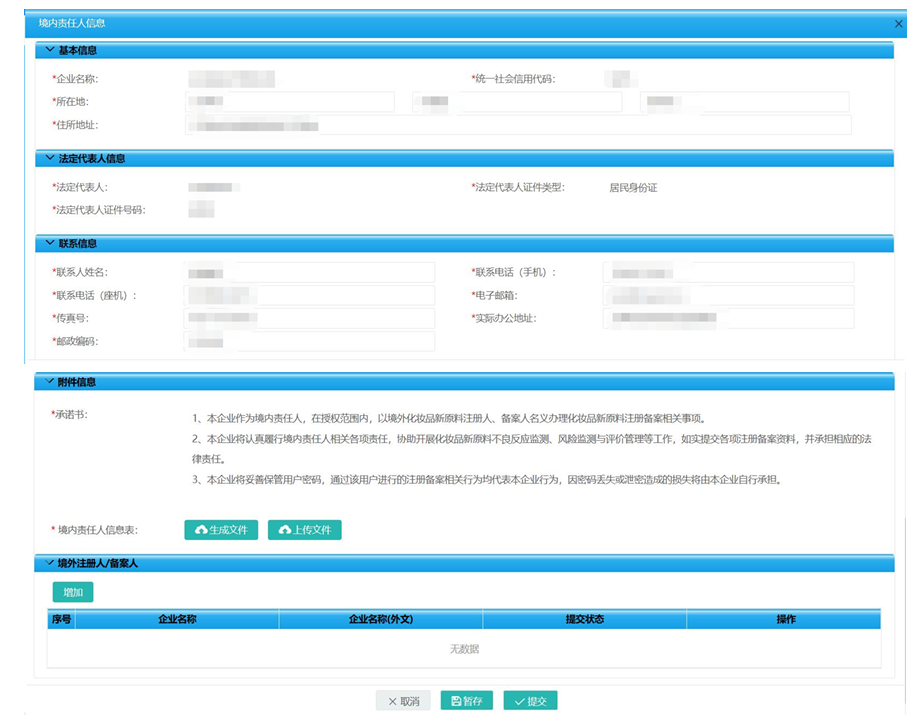
2
上传信息表前,需
3
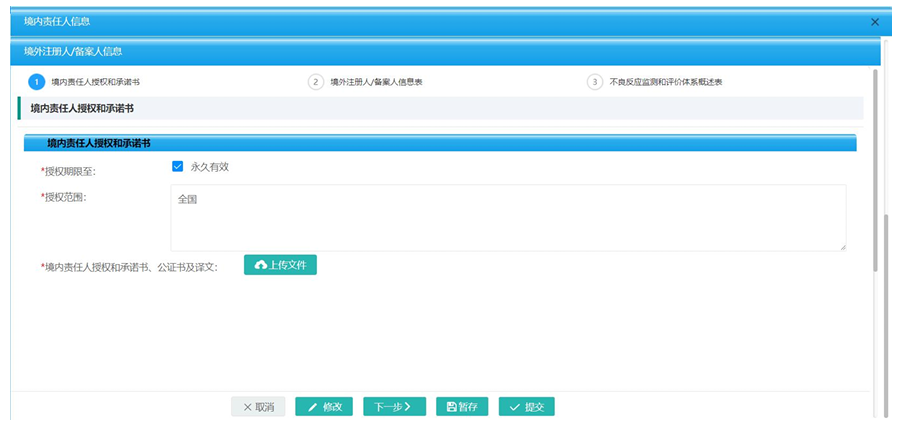
录入境内责任人授权和承诺书并上传相关附件。
此处审查要点:
(1)境内责任人授权书内容应当至少体现以下内容和信息:注册人、备案人和境内责任人名称,授权和被授权关系,授权范围,授权期限。授权期限不明确的,视为永久授权;无论授权书是否体现协助开展化妆品原料安全风险评价和不良反应监测、实施原料召回和配合监督检查等内容,境内责任人均应当按照法规要求履行协助开展原料安全风险评价和不良反应监测、实施产品召回和配合监督检查等义务。
(2)授权书需要经过公证认证(部分国家和地区已免认证)。
(3)提交的文件如为外文则需要提供翻译件;境内责任人在翻译件上逐页盖章。
4
录入境外注册人/备案人信息并上传相关附件。

5
上传信息表前,需

6
录入不良反应监测和评价体系概述表并上传相关附件。
此处审查要点:
(1)填写《不良反应监测和评价体系概述表》,此处同【4.新原料注册人/备案人权限申请】第3点,境外化妆品新原料注册人/备案人和境内责任人均需要填写岗位设置情况、安全风险监测和评价制度,此外多了一项【沟通交流机制】,需要体现境内责任人和境外注册人/备案人在安全风险监测和评价方面的信息交流、数据共享、风险联动等方面的机制和措施。
(2)填写完《不良反应监测和评价体系概述表》需要

7
审核周期为自提交资料起10工作日内审核。
希望本篇文章可以解决您对于化妆品新原料账号开通的疑惑,后附账号开通资料包,感谢阅读~
参考文献
《化妆品智慧申报审评系统 操作使用手册》国家药品监督管理局化妆品注册备案管理问题解答(一)https://www.nmpa.gov.cn/xxgk/zhcjd/zhcjdhzhp/20210402111240145.html往期推荐:
屡获认可 | 见证成就的高光时刻
技术分享|抗生素检测:新污染时代的挑战与前沿探索
沙龙动态|凝心聚力 砥砺同行!微谱生物科技二期实验室隆重开幕,生物药技术交流沙龙精彩纷呈
我知道你在看哟
06-18 TESCAN中国
解决临床创新“卡脖子”难题,丹纳赫重磅推出医院创新转化解决方案!06-18
徕卡精准空间生物学解决方案 第三弹06-18 郑晓业、童昕
618 嗨购一起“徕” | 网上商城活动来袭!06-18 徕卡显微系统
【培训活动】显微镜成像高阶培训系列(一) 共聚焦多维度成像技术解决方案06-18 徕卡显微系统
【展会】第十五届中国医师协会骨科医师年会06-18 徕卡显微系统
【直播预告】第十届电子显微学网络会议06-18 徕卡显微系统
【案例研究】双视野光片显微镜,适用于类器官及胚胎06-18 徕卡显微系统
议程确定|第四届锂离子电池热测试主题研讨会06-18
文献解读|安徽理工大学马衍坤教授团队《煤炭学报》:震动载荷多次作用下烟煤孔裂隙结构演化特征试验研究06-18 纽迈分析
中国的新质生产力正在服务全球市场!GE医疗北京基地CT交付量达3.5万台/套06-17
兰格ACHEMA 2024展会回顾:探寻精密流体传输市场新机遇06-17
宝英科技推出VOCs治理设施精细化管理实施方案,助力重点行业企业绿色升级06-17 宝英科技
赛默飞X先锋“肽”势:多肽药物研发与创新研讨会06-17
一省检验检测行业营收突破160亿元!06-17
仪器租赁 | 沃特世 液质联用,月租金52000元起06-17
不同行业实验室“以旧换新”,涉及哪些仪器设备?06-17
目标!检验机构总营收超100亿!06-16
一张“A4纸”售价高达万元,这家第三方检测公司是怎么做到的?06-15
GLMY创想仪器丨参加东北地区铸造年会06-15 国产精密仪器厂家