技术共探 | 生物制品相容性和密封性解决方案
2023-12-11 14:58:30, 生物医药市场部 1有限公司
10月中旬,聚焦研发 闪“薬”未来 │2023年生物药技术交流沙龙在成都举行,微谱药包材研究技术负责人杨潇军老师带来了《生物制品相容性和密封性解决方案》专题分享。
生物制品相容性和
密封性解决方案
—
杨潇军
微谱药包材研究技术负责人
▊个人简介:杨潇军老师,拥有10余年医药检测领域丰富的项目开发经验,曾参与国家药审中心《弹性体相容性指导原则》的起草,担任萃取及溶出物年会中国区专家组成员,先后为国内1000余家制药企业3000多个药品研发项目提供相容性研究服务。同时在容器密闭系统(CCIT)研究领域开发了百余项领先业内的分析方法学开发及验证,成功通过CMA评审、多项一致性评价和中外双报获批,助力微谱成为业内较早开展密封性色水法研究的企业之一。
一
密封性研究
密封性即包装完整性(integrity),容器-封闭完整性是包装防止产品损失、阻止微生物进入、限制有害气体或其他物质进入的能力,从而确保产品符合必要的安全和质量标准。
包装材料如果要适用于药品,需要满足安全性、功能性、相容性和保护性四大要求,其中保护性是指包装材料能够有效地保护药品不被外界因素(如水、微生物等)干扰,导致药品有效成分被破坏,而包装材料的保护性通常由密闭容器的完整性决定。
尤其要注意的是,相比于化药更关注成品的密封性,生物药因结构复杂,工艺开发流程复杂,其密封性研究贯穿从前端工艺流程到制剂成品整个过程。
▲微谱密封性研究实验室
1.1 研究思路
对于原液和中间体,其涉及的自主设计容器的密封性研究通常采用反向思维,通过密封性研究证明容器的密封工艺;测试样品也与化药不同更多的要考虑容器的使用条件为深冷冻条件,所以模拟使用条件考察密封性也是关键点。
生物药尤其是涉及大分子蛋白类的产品,对于方法的选择上更为严格。
1.2 研究流程
根据生物药的特性以及包装材料的种类(COP、AT、细胞冻存袋、玻璃等)和规格,参考《化学药品注射剂仿制药质量和疗效一致性评价技术要求》、USP<1207>、CMP指南、《化学药品注射剂包装系统密封性研究技术指南(试行)》等相关指导原则选择符合具体产品生命周期的所涉及的容器(原液、细胞培养瓶、成品等)密封性检测方法并制定密封性研究方案,为客户从提供阳性样品制备、密封性研究试验、产线验证以及出具符合FDA、CDE等全球药政法规要求的密封性研究报告的一体化的服务。
1.3 常见的生物制剂成品包材
目前常见的生物制剂成品包材有很多,比如AT瓶(无菌冻存瓶)、COP瓶(环烯烃药用聚合体瓶)、细胞冻存袋等。
生物药过程中涉及的容器有原液储存瓶、密闭补液用瓶、密闭培养用瓶、原液储存袋、高硼硅原液储存瓶等。
1.4 常用研究方法
密封性研究可以分为两大类方法:一类是确定性方法,包括高压放电法、压力衰减法和真空衰减法;一类是概率性方法,包括微生物侵入、气泡法、液体迁移(色水法)。
杨老师强调,与化药相比,生物药的很多中间容器和中间过程都是需要考虑密封性研究的。
二
相容性研究
相容性研究即可提取物和浸出物研究,即包材和产品之间的相互作用,其相容性和安全性是指包装材料和药品之间能够有较好的物理化学兼容性,通过相容性研究来证明包装材料的适用性。
生物药结构复杂,工艺开发流程复杂,其相容性研究贯穿整个工艺过程。另外,生物药相对化药来讲是比较脆弱的,其提取条件的选择也会相对更温和一些。

▲微谱生物医药实验室
2.1 生物药研究思路
生物药的原液和成品通常储存条件比较温和,给药频率长,所以整体研究策略偏实际使用条件,不宜采用过分严苛的提取条件。生物药尤其是涉及低温冻存的产品,对于方法的选择上更为严格。对于一些特殊产品,如CAR-T等,其浸出物设计需要定制化。
2.2 研究流程
相容性的整个研究流程大概分为五个步骤:可提取物试验、初步毒理评估、方法学验证、浸出物测试、最终安全性评价。
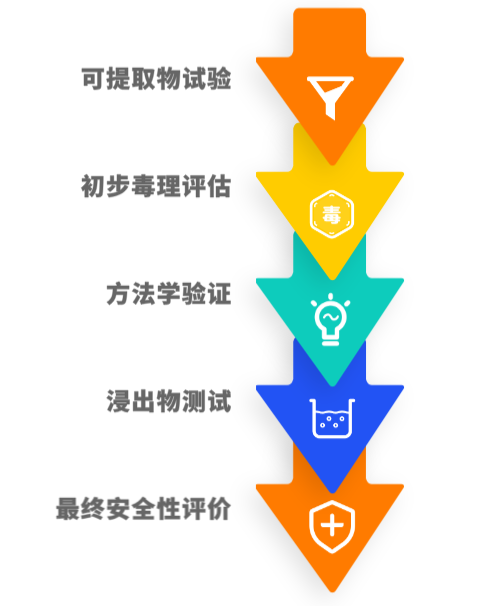
2.3 特殊研究项目
需要注意的是,弹性体中特殊关注的物质有亚硝胺、多环芳香烃、巯基苯并噻唑(2-MBT),应采用极限浸提的手段,并用验证后的方法进行检测。
玻璃内表面脱片研究应参考ASTM F1980加速破坏玻璃瓶,进行内表面观察。一般来说,生物药相比于化药,它跟玻璃之间的反应会更温和,所以研究中只需正常做即可。同时,因为玻璃在制造中本身也可能会存在一些固有缺陷,所以需要识别了解玻璃空白样品的状态。
2.4 工艺组件相容性研究
工艺组件相容性研究要参考USP 1665或《化学药品注射剂生产所用的塑料组件系统相容性研究技术指南》。无机物材质组件/短暂接触(移液用)组件可不考虑,其他有机物先进行风险评估,再根据风险等级确认实验项目,分别实验。
USP 1665主要从接触时间、接触温度、接触液体化学性质以及材料反应性四个维度进行研究
BPOG的评估维度和USP有一定的差异,但理念基本一致。它增加了上下游组件和接触面积比的权重考量。
06-06 Unimicro
Nature 发文! 如果有一天,线粒体也能被移植……06-06 小 M
实验操作 | 小白第一课!基础细胞培养方法及步骤06-06 小 M
科研助攻 | Nature Review:癌症治疗抗体药物最新综述06-06 小 M
端午礼遇 | 玩游戏,选周边,宠粉福利,只 "粽" 意 你~06-06 小 M
发货通知 | MCE 中国祝大家端午安康06-06 小 M
“岛津森林”项目06-05 医疗中心
浙江以检测赋能新质生产力06-05
2025版《中国药典》收官在即,变化要点有哪些?要注意哪些方面?06-05
吸附管采集固定污染源废气中的VOCs时的采样流量要求?06-05 检测家
内卷加剧,检测机构如何破局应对?06-05
【人民日报国际】在收获与播种交织的芒种中国时刻,张轶昊谈创新。06-05
德国元素耗材之星 | 固体压样器/液体封样器06-05
夏日焕新 谱写新章 | 德米特第四届“互动日”惊喜而至06-05
祝贺嫦娥六号月背采样成功 | 盘点标乐助力月球样品分析06-05
2024年德国元素巡检活动 | 第一站:成都站!免费申请06-04
会议通知|第一届小动物活体成像技术前沿与应用网络研讨会06-04
蛋白质组学从发现组学跃入临床怀抱的跨越之旅06-04
内毒素检测的思考 - 采用药典方法同时减少鲎试剂的使用06-04 Sievers分析仪
检测家十周年特惠 | 赛默飞、岛津、沃特世 系列产品租六送一!06-04