限制性酶解-质谱分析VS热蛋白质组学:应用与对比一网打尽!
2023-10-18 10:42:30 北京青莲百奥生物科技有限公司

药物靶点发现
靶蛋白鉴定是鉴定小分子药物作用机制、副作用和评价药物相似性的关键。常用的“标记”靶标表征方法,包括基于活性的蛋白质组分析(Activity-based Protein Profiling, ABPP),需要合成衍生靶向ID探针,不仅周期长,可能还会影响活性药物的构象。无标记靶点识别方法不涉及小分子药物的任何化学修饰,近年来受到越来越多的关注。基于高分辨率质谱(MS)的方法可以提供更多关于综合靶蛋白和结合位点的信息,这可能有助于多靶点或复杂药物系统中的靶点鉴定。
LiP-MS和TPP通过在全局范围内识别蛋白结合药物前后的折叠能力和热稳定性的物化性质改变识别药物的结合靶点,介于其不需要化学修饰和高通量目前已经得到了很多应用。
小编整理了LiP-MS和TPP在药物靶点发现中的应用,为大家提供研究思路~
表1 LiP-MS和TPP在药物靶点发现中的应用代表文章

蛋白质/小分子-蛋白质相互作用研究
许多蛋白质在蛋白质复合物的背景下在细胞内发挥其功能。因此,识别蛋白质/小分子-蛋白质相互作用(PPI)对于深入了解蛋白质的生物学功能至关重要。基于MS的PPI鉴定已成为针对单个或几种目标蛋白的生物学研究以及大规模研究的重要工具。在过去的几十年中,基于MS的蛋白质组学已成为全面识别PPI的首选方法。
LiP-MS和TPP通过在全局范围内识别蛋白质/小分子-蛋白质相互作用前后的折叠能力和热稳定性的物化性质改变识别相互作用的靶蛋白,介于其不需要化学修饰和高通量目前已经得到了很多应用。
小编整理了LiP-MS和TPP在蛋白质/小分子-蛋白质相互作用中的应用文章,供大家后续研究参考!
表2 LiP-MS和TPP在蛋白质/小分子-蛋白质相互作用中的应用代表文章

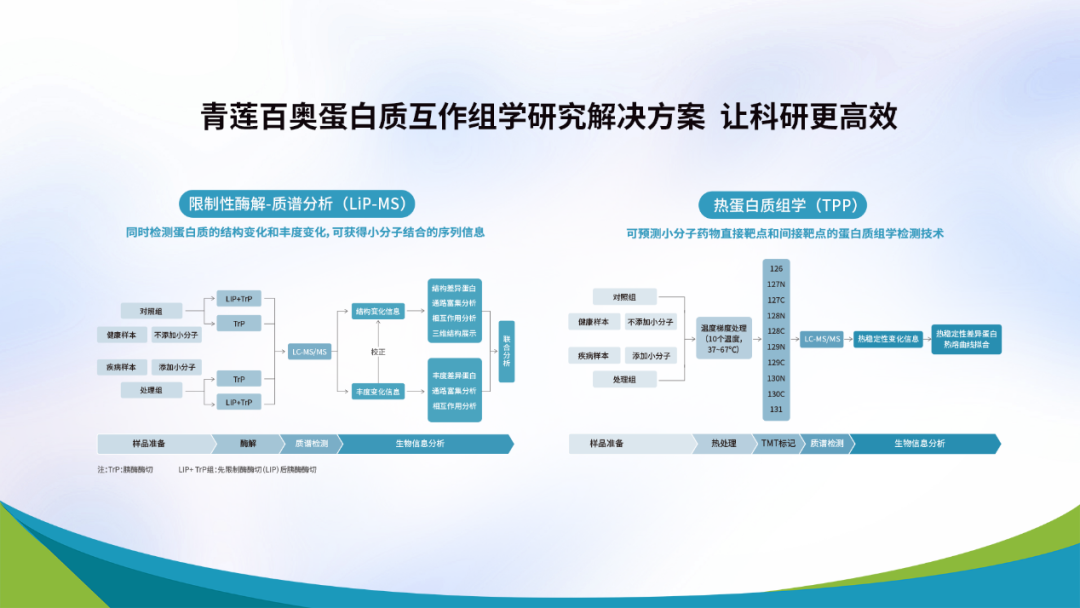
两种方法都可以进行药物靶点筛选和蛋白质/小分子-蛋白质相互作用的研究,在具体的应用中我们应该如何选择呢?小编对两种技术进行了比较,具体内容看下图:

通过比较,我们得知两者检测的变化不同,TPP检测蛋白质的热稳定性变化,LiP-MS检测蛋白质的结构变化,但是二者都不需要对待研究的小分子进行额外的化学修饰,都可以检测到药物-靶点的结合、蛋白质/小分子-蛋白质的相互作用及蛋白质的翻译后修饰。不同点在于TPP可以预测结合蛋白的直接靶点和间接靶点信息,TMT的多温度设置使得分析更加精确,而LiP-MS则可以获得小分子结合的序列信息,并且两个技术都有自身的局限性。因此,在具体的应用中,我们要根据研究需求进行合理化的设置,两种技术可以并行使用,以使数据分析最大化。
关于青莲百奥







12-23 马大哈
「大牌云集」CBIFS第十六届食品安全技术论坛首批展商抢先看!12-23
冬至,无界创新成果至 | GE医疗首台国产超高端量子平台Revolution Apex Expert CT在北京基地下线12-22
喜报100% | 阿尔塔科技5项能力验证全获“满意”结果12-22
祝大家圣诞节快乐!!12-22
布鲁克自己都服了,6种微塑料光谱检测方法全都有!12-22
【新品发布会】美谷分子重磅发布 CellXpress.ai 全自动一体化类器官工作站12-22 美谷分子仪器
FDA重要通知解读:CAR-T治疗后的T细胞恶性肿瘤风险评估与优化前景12-22 景辉
【Webinar 预告】人类发育和疾病中的 DNA 甲基化12-22 美谷分子仪器
【Webinar 预告】类器官超全研发进展和应用趋势12-22 美谷分子仪器
喜迎双“旦”| 赛默飞色谱与质谱中国祝您双旦快乐!12-22
圣诞有你,才叫惊喜!腾龙发起宠粉活动~~12-22
叮!圣诞氛围组小可爱已上线12-22 市场部
组织图片库12-22 徕卡显微系统
圣诞将至 | 徕卡显微系统陪你温暖过冬12-22 徕卡显微系统
【工作流程】简化生物应用的电镜样品制备工作流程12-22 徕卡显微系统
【点播课程】对囊泡运输的见解12-22 徕卡显微系统
电子产品制造截面分析12-22 徕卡显微系统
【网络研讨会】3D、AR和VR技术在神经外科教学领域的应用12-22 徕卡显微系统
2024年第一期XRD培训班开始报名12-22