项目文章 | 单细胞转录组揭示含铂新辅助治疗抗药性的基因特征
2023-07-04 10:44:00, 欧易生物 上海欧易生物医学科技有限公司
2023年6月,复旦大学附属中山医院詹成团队在Cell & Bioscience(IF=9.584)发表题为“The genomic signature of resistance to platinum-containing neoadjuvant therapy based on single-cell data”,该研究对含顺铂(CDDP)新辅助化疗(NACT)治疗肺腺癌(LUAD)和食管鳞癌(ESCC)前后的单细胞数据和肿瘤细胞系顺铂 IC50数据进行分析,建立CDDP新辅助化疗评分(NCS)。文中单细胞转录组测序和数据分析由欧易生物完成。

题目:The genomic signature of resistance to platinum-containing neoadjuvant therapy based on single-cell data
期刊:Cell & Bioscience
影响因子:9.584
发表年月:2023年6月
材料:16例肺腺癌和15例食管癌
方法:10×Genomics scRNA-seq

目前,新辅助靶向治疗和免疫治疗已成为恶性肿瘤术前辅助治疗的新趋势,具有广阔的应用前景。然而,由于价格高、不确定性(仍处于临床阶段)和局限性(靶向和生物治疗仅占所有一线治疗的30%),铂类化疗方案仍然是大多数癌症的一线治疗选择或新辅助或辅助治疗的组成部分之一。因此,进一步探索其进展的分子机制对于建立一个特定的新辅助顺铂评估是至关重要的,它能够确定与更高获益相关的治疗方案,或确定特别受益于含铂新辅助化疗的恶性肿瘤患者群体。

Result 1 单细胞分析新辅助治疗前后肿瘤细胞差异表达基因
首先分别选取顺铂新辅助化疗的LUAD和ESCC患者新辅助化疗前后的肿瘤细胞,并进行差异分析。获得LUAD和ESCC新辅助治疗前后肿瘤细胞中共同表达差异基因485个。GO富集分析显示,主要富集在细胞粘附分子结合、酶抑制剂活性、钙粘蛋白结合等方面。KEGG富集结果表明主要富集在代谢物、退行性变化、癌变等方面。
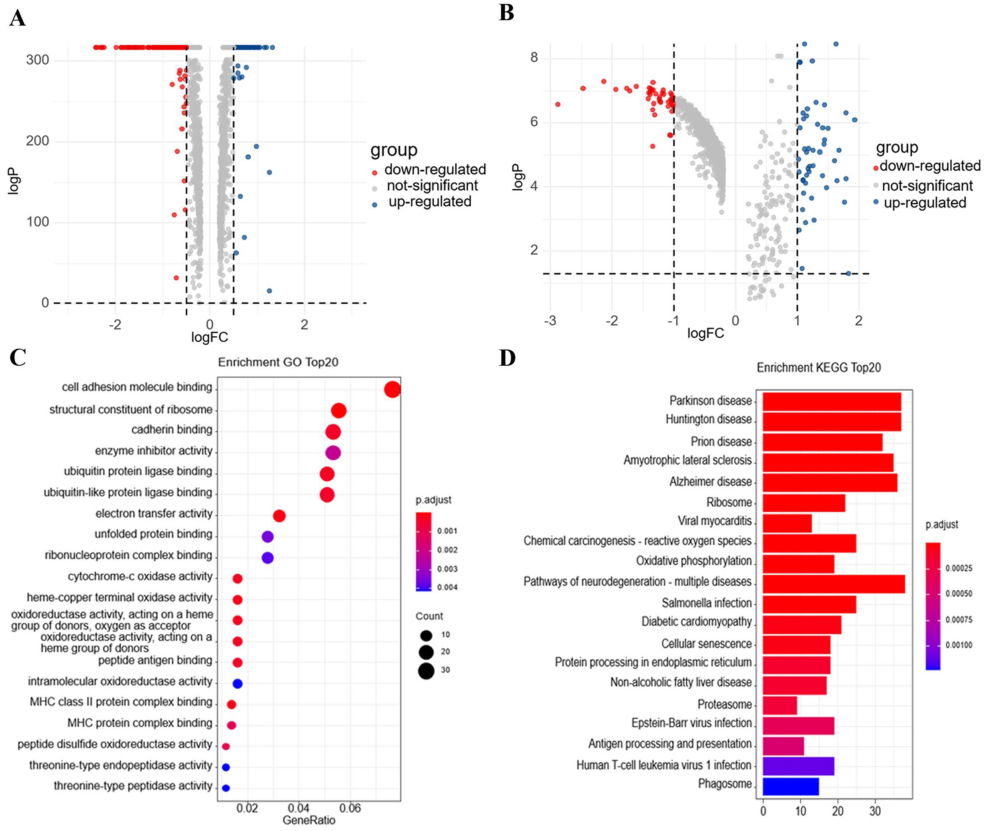
图1 顺铂新辅助化疗前后肿瘤细胞的差异分析
Result 2 新辅助化疗差异基因和顺铂耐药相关基因的联合分析
在作者之前的研究中,对顺铂耐药和敏感细胞系进行了多组学分析,获得了相关的差异基因集。作者将这些差异基因集与获得的485个差异基因相交,得到64个与新辅助化疗疗效相关的关键基因,其中12个基因在LUAD、ESCC新辅助化疗前后和顺铂耐药细胞系中表达趋势一致。
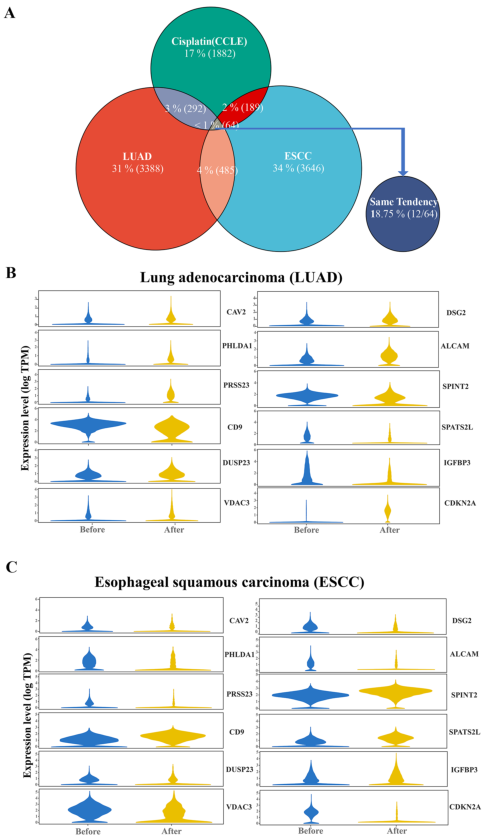
图2 新辅助化疗差异基因和顺铂耐药相关基因的联合分析
Result 3 新辅助化疗评分(NCS)在单细胞数据中验证及CCLE数据库验证
作者将作为新辅助化疗评分构建的12个基因重新引入到LUAD和ESCC患者新辅助治疗前后的单细胞测序数据以及CCLE数据库中,结果发现LUAD和ESCC患者新辅助治疗前肿瘤细胞的NCS明显高于新辅助治疗后肿瘤细胞。在CCLE数据库中,低IC50组(顺铂敏感组)的NCS高于高IC50组。
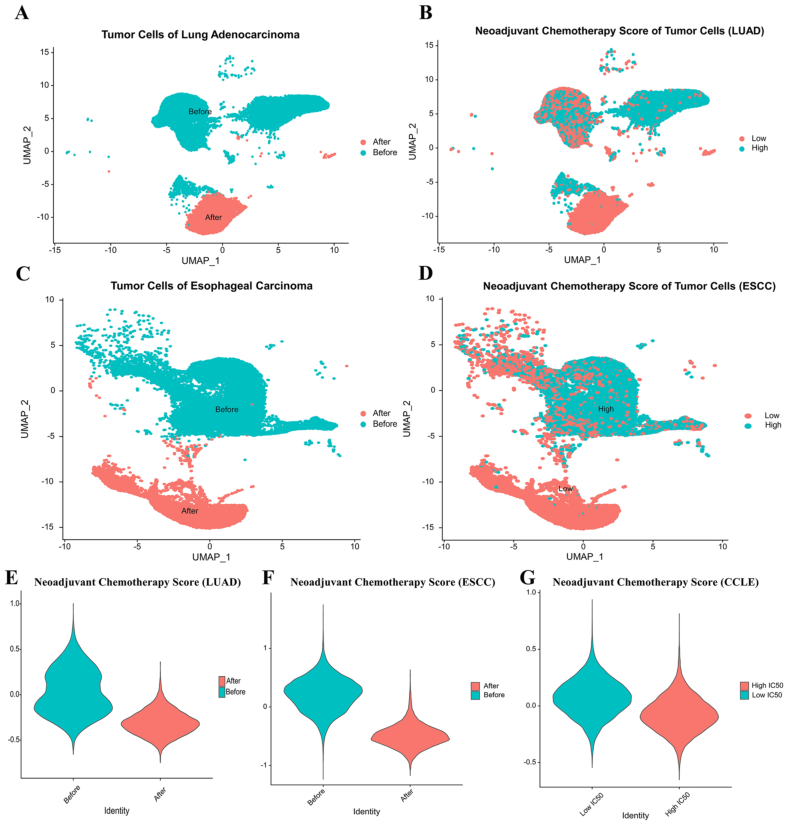
图3 新辅助化疗评分(NCS)在单细胞数据中验证及CCLE数据库验证
Result 4 12个基因和NCS 在LUAD和ESCC单细胞数据中的应用
对LUAD患者的肿瘤细胞检测上述12个基因的表达情况,不难发现CAV2、PHLDA1、VDAC3在肿瘤细胞中普遍呈高表达。AddModuleScore函数构建NCS,12个基因在整个LUAD、ESCC及相应的癌旁组织样本中不同细胞的表达情况,结果显示NCS在肿瘤组织中的表达明显高于正常组织。作者将肿瘤细胞按NCS平均值分为2组,进一步观察其差异。


图4 12个基因和NCS 在LUAD和ESCC单细胞数据中的应用
Result 5 NCS分组肿瘤细胞差异表达基因分析
对LUAD两组进行差异分析,共获得796个差异表达基因(p < 0.001),其中119个存在显著的fold change (|logFC|> 0.5)。这119个基因中有77个在低NCS组中显著上调,包括VDAC3、CAV3、PHLDA1、CD9等;42个基因均显著下调,包括LRRK2、SPINK13、TANC2等。GO富集分析显示,主要富集在钙粘蛋白结合、肌动蛋白结合、肽酶调节活性、内肽酶抑制活性等方面。KEGG信号通路主要富集在流体剪切应力和动脉粥样硬化、癌症中的蛋白聚糖和转录失调等方面。GSVA分析发现,硒氨基酸代谢、无义介导的mRNA降解、核糖体等在高NCS组中显著上调;ATF2靶点、对氧化磷脂的反应和对甲氨蝶呤的反应均显著下调。
ESCC中得到1676个差异基因,其中65个显著上调,14个显著下调。GO富集分析显示受体配体活性、细胞外基质等富集。细胞因子受体互作、病毒蛋白与细胞因子及细胞因子受体相互作用、IL-17信号通路等富集。GSVA分析发现,高NCS组中肿瘤微环境、上皮细胞、Barrett’s esophagus、食管癌相关通路显著上调,而TP73和TP63靶点、对金属离子的反应、对THC的反应显著下调。
对两组差异基因交集的表达数据进行LASSO回归分析。选取使整个模型均方差最小的22个特征变量:CD24、D9、DUSP23、KRT19、LRRK2、MAL2、PERP、SPINT2、TACSTD2、PHLDA1、C8orf4、CAV2、CAPN8、MDK、SLC20A1、SPINK13、TANC2、CLDN3、RGMB、S100P、VDAC3、C19orf33构建预测模型。最终得到17个indicators构建模型预测NCS。

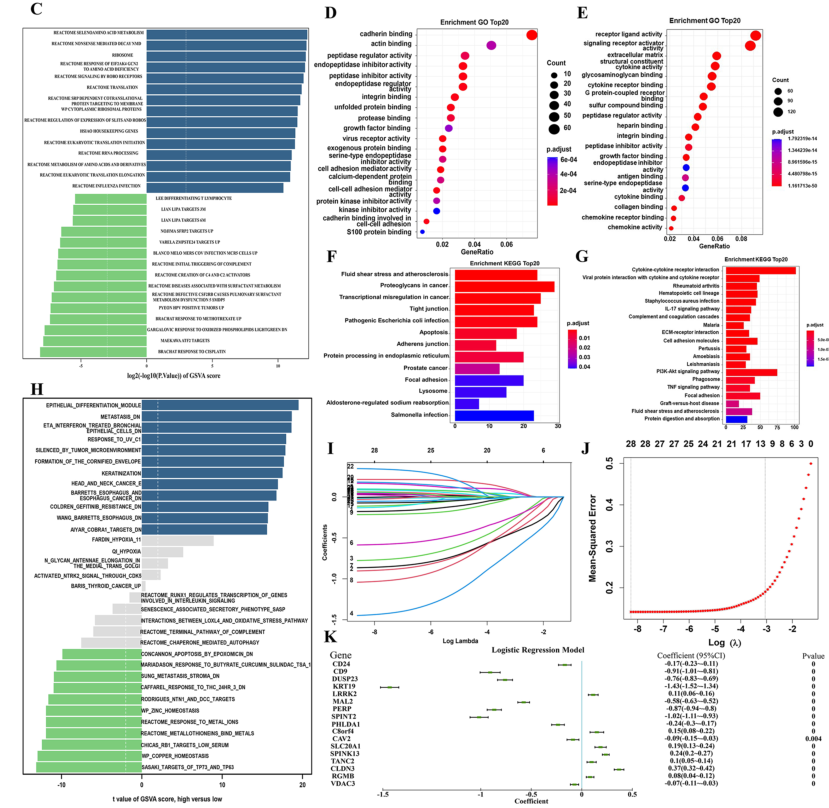
图5 NCS分组肿瘤细胞差异表达基因分析
Result 6 有化疗记录的LUAD患者12个基因生存分析
基于TCGA和GEO数据集,首先对有化疗记录的LUAD患者的每个基因进行了K-M生存分析。CAV2、PHLDA1、ALCAM、CD9、IGBP3和VDAC3基因与预后显著相关(p < 0.05)。除ALCAM外,其他5个基因高表达的患者预后较差。CAV2、PHLDA1和VDAC3与预后的相关性最为显著。
在TCGA数据库中使用这12个基因对LUAD患者进行聚类分析,这些基因可以清楚地将患者分为两个亚型。这两种亚型之间存在显著的生存差异,因此初步推断,在LUAD中通过这12个基因的表达,可以得到含铂辅助化疗不敏感亚型,提示该亚型患者可能无法从新辅助或辅助化疗中获益。
单因素分析显示ALCAM、CAV2、VDAC3、PHLDA1、DUSP23和SPATS2L是LUAD患者预后的显著预测因子,多因素Cox比例风险分析显示ALCAM、CAV2、CD9、VDAC3、PHLDA1是LUAD患者生存的独立预后因素。得出5个独立危险因素(ALCAM、CAV2、CD9、VDAC3、PHLDA1)。CAV2、VDAC3和PHLDA1表达较低的LUAD患者预测生存时间较长。
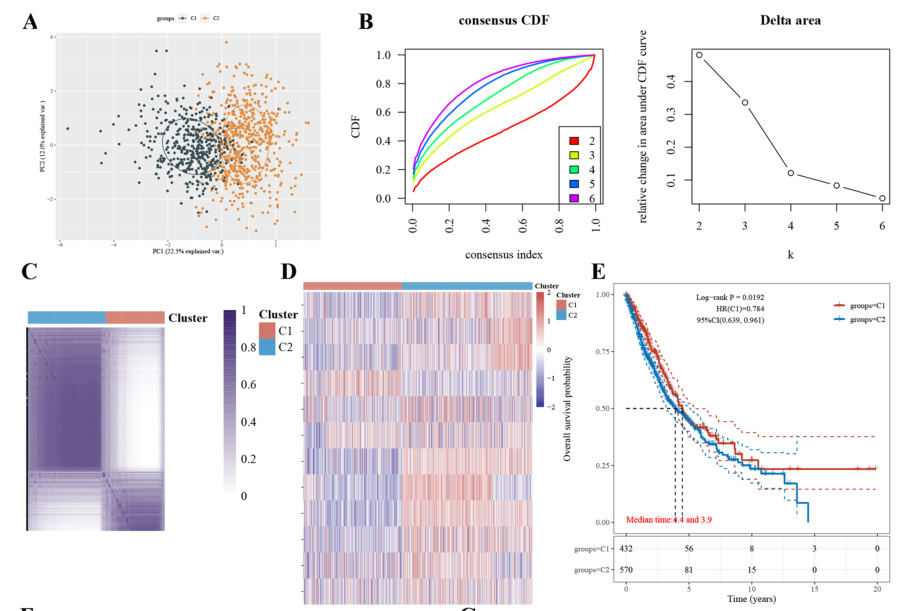
图6 有化疗记录的LUAD患者12个基因生存分析
Result 7 TCGA数据库中进一步验证
除肺腺癌,作者还在TCGA数据库中选择了标准新辅助治疗中含有顺铂且有化疗记录的2种癌症:胃腺癌和头颈部鳞状癌。对先前获得的基因进行LASSO回归分析,初步筛选可能与新辅助患者生存相关的基因,然后建立相应的logistic回归模型。然后分别对模型进行验证,首先对KM生存曲线的分布进行验证,发现模型划分数据集的两组之间存在显著的生存差异;其次,绘制了不同时间风险模型的ROC曲线和AUC,三种模型在1年、3年和5年的AUC均大于0.6,显然,AUC值越高,表明模型的预测能力越强。
Result 8 在A549、PC9和TE1细胞中PHLDA1、CAV2、VDAC3的表达与顺铂敏感性相关
作者在体外实验水平上验证与预后最相关的三个基因是否与顺铂耐药相关。选择2个LUAD细胞系A549和PC9以及1个ESCC细胞系TE1进行实验。细胞在敲除PHLDA1、CAV2和VDAC3基因后对顺铂的敏感性增加。

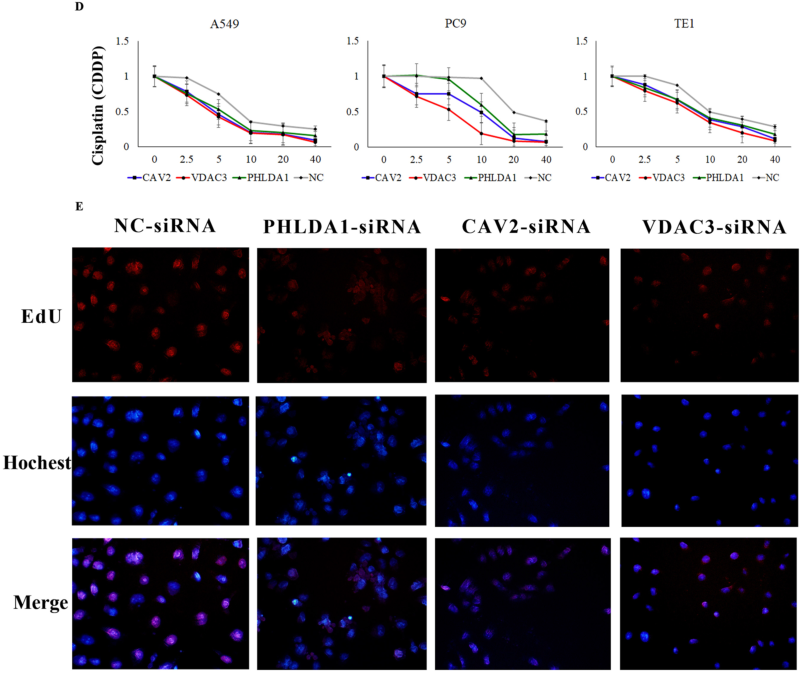
图7 分别沉默CAV2、PHLDA1和VDAC3可显著增加对顺铂的敏感性

本文通过分析LUAD和ESCC中有无NACT的单细胞数据,以及CCLE数据库中获得的顺铂耐药相关基因,结合各种肿瘤学公共数据库的数据,建立了含铂新辅助治疗的NCS评分和相关预测模型,并通过生物信息学分析和细胞生物学实验进行了验证,以帮助临床选择可能从含铂新辅助治疗中获益最大的患者。
✦

欧易点评
本文分析治疗前后LUAD和ESCC单细胞数据,以未经治疗的LUAD和ESCC样本单细胞数据作为验证,进一步结合公共数据库,进行差异分析、GO、KEGG、GSVA、logistic回归模型,生存分析等分析,开发并验证了CDDP-NACT的NCS评分和相关预测模型,以帮助选择可能从中受益的患者。对于类似研究的老师,可以参考本文作者的思路,结合单细胞数据和公共数据库数据,结合多种分析,构建特定的临床评分或预测模型。
参考文献
Sui Q, Hu Z, Jin X, et al. The genomic signature of resistance to platinum-containing neoadjuvant therapy based on single-cell data[J]. Cell & Bioscience, 2023.
往期推荐
项目文章 | 睡眠剥夺后通过减少外泌体miR-182-5p促进内皮炎症和动脉粥样硬化形成
项目文章 | 国自然热点!单细胞测序在肿瘤干细胞中的应用
项目文章 | 靶向Nrp-1可消除抗PD-1上调的调节性T细胞,并与4-1BB激动剂协同治疗肝癌
项目文章 | EP3在小鼠肝纤维化模型中增强NK细胞对肝星状细胞的粘附和细胞毒性
06-27 福立仪器
好礼来袭 | 分享您身边的特洁安身影06-27
大盘取厚势 落子开新局:战略聚焦开启品牌发展新篇章——访Veralto大中华区总裁秦晓培06-27 星羽
实验操作 | 质粒构建、转化、提取、鉴定、转染、测定(完整版)06-27 小 M
有投必奖 | 大家都用 MCE 产品做了啥? (感染领域)06-27 小 M
科研助攻 | 一文讲清:如何破解 PPI 靶点成药难题06-27 小 M
干货分享 | 谈谈天然产物的改构策略06-27 小 M
玉研口鼻暴露系统 | 精准、可控、高通量的动物肺部疾病造模工具,助力创新药物研发06-26 玉研仪器
高分离 高灵敏 高通量——福立液相LC5190重新定义分离需求06-26 福立仪器
医药行业指南:电位滴定仪选型攻略来啦~06-26
屹路同行 悦启新程06-26 屹尧科技
徕卡精准空间生物学解决方案 第四弹06-26 童昕、南希
【直播预告】第一届大湾区生物电镜制样讲习班06-26 徕卡显微系统
徕卡常规显微镜历经严苛的ISO9022标准测试06-26 徕卡显微系统
Viventis LS2 Live 光片显微镜发布会06-26 徕卡显微系统
前沿应用 | 经皮无创血糖检测中葡萄糖拉曼峰直接观测06-26 鉴知技术
SNEC光伏展圆满落幕 | OTT HydroMet闪耀时刻精彩回顾06-26 OTT HydroMet
激光指向稳定在光刻系统应用中的关键作用,及其优化方案!06-26 圈内人都会关注
推陈出新!通微公司携新品亮相本届CPHI06-26 Unimicro
远离氟污染!开启无氟接触前处理技术新篇章06-26