eBioMedicine 封面 | 中国医科院团队揭示新冠后遗症多器官蛋白/磷酸化图谱
2023-04-23 11:10:30, 景杰生物
杭州景杰生物科技股份有限公司
2019年12月,严重急性呼吸系统综合症冠状病毒 2(SARS-CoV-2)引起的新冠肺炎席卷全球,给人类健康和社会发展造成严重影响。有研究通过对 COVID-19 患者进行尸检,发现在其中枢神经系统(CNS)中直接鉴定出SARS-CoV-2病毒,表明 SARS-CoV-2 可能直接攻击中枢神经系统。世界医学权威杂志The Lancet曾发文称,新冠后遗症或是现代医学的头号挑战。因此,迫切需要阐明其背后的分子机制以预防 COVID-19 引起的神经损伤和潜在的后遗症。蛋白质组学分析有助于同时评估数千种蛋白质变化,而蛋白质磷酸化修饰也可以快速反映出生物体的生理或病理变化,可以根据磷酸位点的强度预测激酶活性的变化从而提供大量的信息。但是,关于SARS-CoV-2 感染后生物体内脑组织的蛋白质组和磷酸化修饰组变化情况的研究仍较为缺乏。2023年3月,杨俊涛研究员,刘江宁研究员,刘德培院士合作在柳叶刀子刊EBioMedicine 发表题为”Proteomic and phosphoproteomic characteristics of the cortex, hippocampus, thalamus, lung, and kidney in COVID-19-infected female K18-hACE2 mice [2]”的论文,该文章荣登2023-4月eBioMedicine杂志封面。该研究对感染SARS-CoV-2的K18-hACE2小鼠的大脑皮层、海马、丘脑、肺和肾脏组织进行蛋白质组学和磷酸化修饰组学分析,绘制了SARS-CoV-2感染的多器官蛋白及修饰图谱,为COVID-19机制研究和治疗策略提供了坚实的理论基础。景杰生物为该研究提供了蛋白质组学和磷酸化修饰组学分析。1 蛋白质组学和磷酸化修饰组学分析
基础医学研究首选临床样本,但由于临床样本通常包埋在石蜡中且较难获得,因此该研究采用了雌性无特定病原体 (SPF) 转基因 (K18- hACE2 ) 小鼠进行研究(野生小鼠ACE2位于 X 染色体上,因此研究者感染雌性hACE2小鼠进行研究)。研究者从SARS-CoV-2感染后的小鼠中获得了大脑组织包括大脑皮层、海马、丘脑并进行了病毒载量检测,形态学分析以及蛋白质组学和磷酸化修饰组学分析 (图1)。此外,由于肺是 SARS-CoV-2 的主要靶标且新冠患者的肾小球滤过率(eGFR)较低,因此研究者还对肺组织和肾组织进行组学检测。与对照小鼠相比,作者在感染小鼠的五种组织中鉴定到了大量差异表达蛋白与磷酸化修饰位点。维恩图显示7043种蛋白质和4076个磷酸化修饰位点是五种组织共有的。除此之外,每个组织都有其独特的蛋白质和磷酸化修饰位点,这意味着SARS-CoV-2在不同的器官中诱导的生物学反应可能不同。
2 SARS-CoV-2感染后器官共性和特异性功能分析
为进一步探索SARS-CoV2感染对各个器官功能的影响,研究者对各器官的差异表达蛋白以及磷酸化差异蛋白进行KEGG富集分析,并选取富集程度排名前十的通路整合为气泡图进行功能分析 (图2 A-B)。蛋白质组学表明五种组织的差异表达蛋白均在KEGG注释的COVID-19通路中富集,同时,每个器官又呈现出器官特异性的信号通路,如抗原加工呈递、补体和凝血级联、吞噬体相关蛋白仅显著富集在肺和肾脏中。磷酸化修饰组学分析表明五种组织的磷酸化差异表达蛋白均在MAPK信号通路富集,而催产素信号通路与神经退行性疾病相关蛋白仅高度富集于大脑皮层、海马和丘脑中。随后作者整合了不同器官的组学数据集以探索SARS-CoV-2感染引起的具体功能改变,Circos图用于揭示不同组学数据集之间特征或功能注释的相关性。在差异表达蛋白高度富集的COVID-19通路中 (图2 C),补体和凝血级联、Mapk、JakStat和核糖体通路中的蛋白质在不同器官中受到差异调控;RIG-I通路中的Ddx58在五种组织中均上调,而该通路中的其它蛋白如Eif2ak2、Ifih1、Isg15及Nfkb1等在各组织的表达模式不同。此外,就补体和凝血级联通路而言,与三个大脑区域相比,肺和肾脏有更多的补体和凝血通路相关蛋白 (图2D),这表明SARS-CoV-2感染后肺和肾脏的补体和凝血级联被强烈激活。以上结果表明,SARS-CoV-2诱导的分子和功能改变在不同器官中存在差异。图2 SARS-CoV-2感染后器官共性和特异性功能分析3 SARS-CoV-2感染后器官功能异质性分析
为了探索SARS-CoV-2感染后的器官功能异质性,作者采用Fuzzy C-means algorithm算法对差异表达蛋白进行表达模式聚类分析,得到5个分子集群 (图3A),然后对每个集群中的蛋白进行KEGG富集分析,并对富集程度排名前五的通路蛋白进行蛋白质-蛋白质相互作用 (PPI) 分析,发现每个集群的蛋白质具有特定的表达模式 (图3B-F)。Cluster1和Cluster2揭示了皮层的特异性分子特征,涉及小分子代谢、内质网蛋白质加工、剪接体和RNA降解等生物过程。在SARS-CoV-2感染后,皮层中的类固醇生物合成相关蛋白、细胞骨架相关蛋白等水平下调,RNA相关蛋白水平上调。Cluster3揭示了肾脏特异性分子特征,包含了非同源末端连接、内吞作用和脂肪细胞因子信号通路。肾脏感染后NF-κB信号通路中的Nfkb2、非同源末端连接过程中的Nhej1等蛋白水平下调。Cluster4揭示了肺特异性代谢特征,如糖胺聚糖降解、PPAR信号通路和柠檬酸循环。肺感染后多种代谢蛋白水平下调。Cluster5显示了三个大脑区域与两个外周器官之间信号通路的差异,如吞噬体、溶酶体、补体和凝血级联以及粘附连接,其中Ctsb和Ctss蛋白在感染的肺和肾脏中高表达。与蛋白组学数据不同,磷酸化差异表达蛋白被分为8个分子集群 (图3 H),揭示了海马特异性 (cluster1和cluster2)、肺特异性 (cluster3和cluster4) 和肾脏特异性 (cluster5和cluster6) 的分子和功能特征。海马感染后粘附连接、GABA能突触和RNA转运相关蛋白过度磷酸化,谷氨酸能突触、肌动蛋白细胞骨架调节等相关蛋白磷酸化水平降低。肺感染后RNA转运、紧密连接等信号通路相关蛋白过度磷酸化,分泌和cGMP-PKG信号通路蛋白磷酸化水平降低。肾脏感染后,局灶性粘连、糖酵解/糖异生、剪接体等相关蛋白过度磷酸化,FoxO信号通路和RNA转运相关蛋白磷酸化水平降低。Cluster7区分了三个大脑区域和两个外围器官,SARS-CoV-2感染后,MAPK信号通路、紧密连接和胆碱代谢相关蛋白在肺和肾脏中倾向于过度磷酸化,但在三个大脑区域中倾向于低磷酸化。Cluster8在每个器官中表现出不同的磷酸化倾向,包括谷氨酸能突触、催产素信号通路相关蛋白。磷酸化修饰组学中频繁高度富集的紧密连接和RNA转运通路表明,SARS-CoV-2感染过程中磷酸化修饰受到广泛调控。因此,作者进行了磷酸激酶分析以探索SARS-CoV-2感染后的磷酸化模式。4 磷酸激酶分析扩展了SARS-CoV-2感染后各器官的磷酸化模式
考虑到信号调控通路中磷酸化与激酶之间的相互作用,作者进行了磷酸激酶活性分析,结果显示大脑皮层、海马、丘脑、肺、肾脏中各有47、21、10、26、46种激酶被激活,以及分别有3、3、6、3、11种激酶被抑制 (图4A)。同时,没有任何一种激酶的活性在五种组织中均发生显著改变,这表明SARS-CoV-2感染后每个器官的激酶活性模式都是独一无二的 (图4B)。活化的激酶可上调或下调蛋白质/磷酸化修饰水平。最终作者在各器官中发现了许多活性上调和活性下调的激酶,这些激酶在中枢神经系统中与突触可塑性和记忆调节以及外周器官炎症相关的功能有待进一步探讨。5 SARS-CoV-2病毒-宿主蛋白相互作用分析
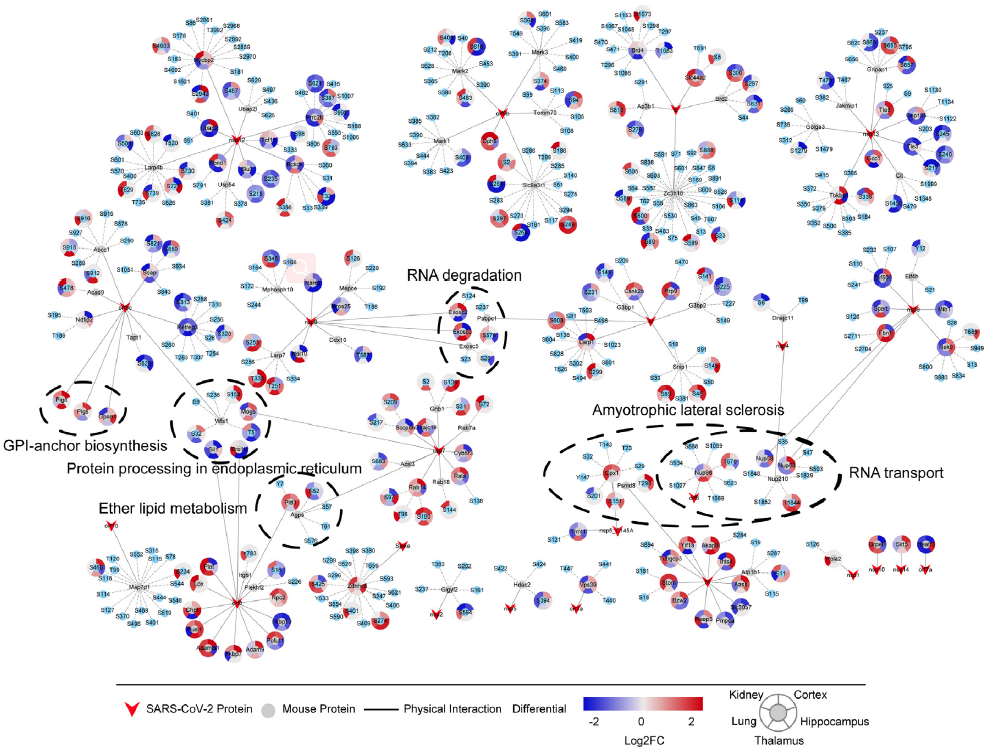
基于此前研究绘制的宿主-SARS-CoV-2蛋白相互作用图谱,作者分析了SARS-CoV-2与宿主小鼠五种组织中蛋白的相互作用,发现23种SARS-CoV-2蛋白可能与含有402个磷酸化修饰位点的117种宿主蛋白相互作用 (图5)。为了确定与SARS-CoV-2蛋白相互作用的宿主蛋白质的潜在功能和机制,作者对这117种蛋白质进行KEGG富集分析,在含有22种蛋白质注释的34个KEGG通路中,19种蛋白质高度富集于6条信号通路:GPI锚定蛋白生物合成、内质网蛋白质加工、醚酯代谢、RNA降解、RNA转运与肌萎缩性侧索硬化症信号通路,这些病毒-宿主蛋白质相互作用网络可作为治疗COVID-19的新靶点。图 5 SARS-CoV-2蛋白与宿主蛋白质的相互作用6 SARS-CoV-2感染后器官蛋白质图谱
为了进一步获得SARS-CoV-2感染后各器官全面直观的功能改变,作者在亚细胞水平上整合了差异表达蛋白 (图6 A-E)。发现与其它器官相比,肺似乎具有更强的抗原呈递,肺和肾脏似乎表现出比三个大脑区域更强的补体攻击和更高的凝血风险,海马的补体和凝血反应则尤为轻微。随后作者分析了每个器官的组学数据以探究病毒感染的器官特异性。在五种组织中,大脑皮层的病毒载量最高,剪接体、过氧化物酶体、蛋白酶体、核糖体、细胞骨架、核孔复合体、内质网蛋白加工和线粒体氧化呼吸链相关的多种蛋白受到影响 (图6 A),因此SARS-CoV2感染后大脑皮层功能严重受损。海马区差异表达蛋白水平低于大脑皮层区,内质网、过氧化物酶体、线粒体氧化呼吸链、膜转运体、细胞外基质等蛋白质水平失调 (图6 B),然而这些改变是轻微的。丘脑仅涉及了线粒体氧化呼吸链和细胞骨架相关蛋白的改变(图6 C)。此外,作者还关注了Mapt/Tau蛋白,其病理磷酸化和聚集可能诱导阿尔茨海默病。虽然SARS-CoV-2感染后其蛋白水平无明显变化 (图6 H),但是磷酸化水平呈现明显的上升趋势,Mapt-pS483 (图6I)、Mapt-pS500 (图6J) 在三个脑区中均上调,Mapt-pS470 (图6K)、Mapt-pT473 (图6l)、Mapt-pT523 (图6m) 在五种器官中均上调。抗原处理和呈递、抗病毒过程、补体和凝血级联通路相关蛋白在肺部明显富集,NADPH氧化酶复合物活性的增加意味着感染后肺处于高氧化状态 (图6D)。在五种器官中,肾脏的活化溶酶体数量最多,细胞外基质的积累最明显 (图6E)。多种膜蛋白和脂肪酸代谢相关蛋白在肾脏中失调,因此,SARS-CoV-2感染可能会引发肾损伤,具体机制仍有待研究。综上所述,该研究提供了SARS-CoV-2感染后小鼠多个器官包括大脑组织(皮层、海马、丘脑)、肺和肾脏等器官的蛋白质组学和磷酸化修饰组学改变情况,揭示了感染引起的多器官损伤和潜在后遗症的分子机制。同时,差异表达蛋白和预测的激酶也助于筛选COVID-19治疗药物,为揭示COVID-19后遗症相关分子机制及预防后遗症提供了新的思路与数据支持。参考文献
1. Liu JF, et al. 2023. characteristics of the cortex, hippocampus, thalamus, lung, and kidney in COVID-19-infected female K18-hACE2 mice. EBioMedicine.本文由景杰学术团队报道,欢迎转发到朋友圈。如有转载、投稿等其他合作需求,请在文章下方留言,或添加微信ptm-market咨询。#关注领取新人福利,下载最近三年影响因子(后台发送关键词“新人”)