高分辨冷冻光学显微镜图像
2022-07-15 10:30:06, 徕卡显微系统 徕卡显微系统(上海)贸易有限公司

如何利用THUNDER的成像解析技术改善冷冻电子显微镜对靶区的识别
本文阐述了冷冻光学显微镜图像的成像解析技术如何改善冷冻电子显微镜对细胞靶区的识别。
人类面临着各式各样的疾病。为了找到有效的治疗方法,我们必须深入研究健康人体与患病人体中最基本的细胞机制。
近期在冷冻电子显微镜工作流程领域取得的进步,让我们能够获取到细胞蛋白质社会学的3D数据,其分辨率更是达到了前所未有的1nm以下。
为了让该工作流程能更可靠地生成所需数据,冷冻光学显微镜成为了一个至关重要的工具。它可以用于检查样本质量,并且能在冷冻电子显微镜内对靶区部位进行常规识别,尤其是针对冷冻断层扫描技术而言,冷冻光学显微镜尤为重要。我们在此阐述了改善冷冻光学显微镜的图像质量,以便精准识别靶区部位的原理。
冷冻电子断层扫描工作流程及冷冻光学显微镜的重要性说明
只能通过研究最基本的细胞机制,才能搞清楚许多有关人体生理学和病理学的科学问题。这些细胞机制是所有功能性组织、器官及整个有机体运转的基本机制。
为了解健康和病理生理学状态下不同细胞类型的功能,我们需要找出参与功能实现的生物分子(如蛋白质),同时评估其在分子水平上的相互作用。
为此,研究中使用了冷冻透射电子显微镜技术(Cryo TEM),将在细胞环境内观察生物分子的分辨率提升到了1nm,达到了前所未有的精度。在这种方式下,单独的蛋白质无需标示,“只需”根据外形即可辨识。此外,即便细胞质内部的构造和分布不同,也能轻松区分。
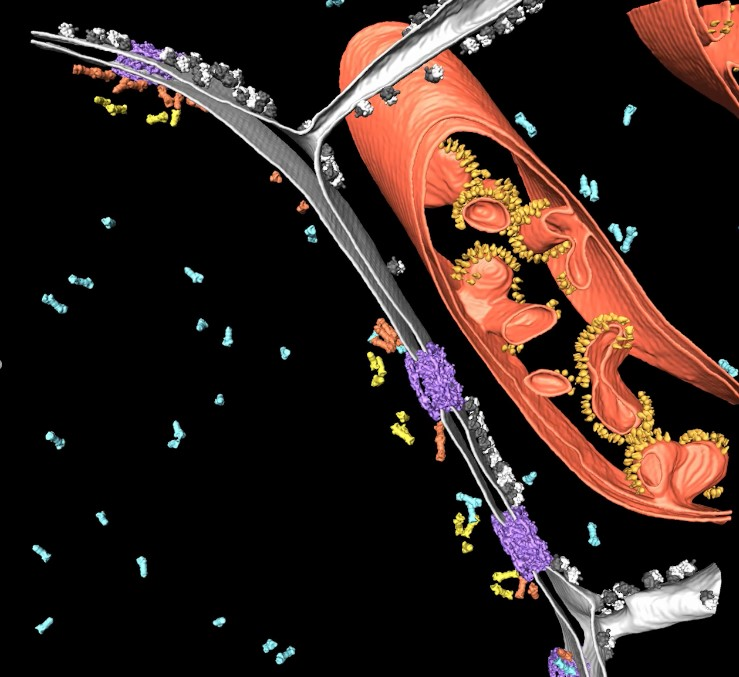
图1:冷冻电子断层扫描的部分区域,显示出细胞核周围的原生细胞环境。蛋白酶体在两个不同位置与核孔复合物(紫色)相连(橙色:膜锚定蛋白酶体,黄色:篮状锚定蛋白酶体,蓝色:游离蛋白酶体)。该区域还显示出细胞核膜(灰色)、核糖体(黑/白)和线粒体(红色,有一排黄色ATP合成酶)。数据由德国马丁雷德(Martinsried)马克思普朗克生化研究所分子结构生物学部门B. Engel博士提供。原发表出处:Albert S, Schaffer M, Beck F, Mosalaganti S, Asano S, Thomas HF, Plitzko JM, Beck M, Baumeister W, Engel BD, Proteasomes tether to two distinct sites at the nuclear pore complex, PNAS, December 2017.
作为先决条件,样本必须采用先进的技术(玻璃化处理)进行冷冻固定,避免形成破坏性冰晶。与其他固定技术不同,蛋白质要尽可能维持接近于原生态的状态。此后,薄样本(小于300nm)即可在Cryo TEM下进行直接评估。通过倾斜样本可创建观察样本容积的三维数据集,并对其进行重建,从而获得意向蛋白质的3D分布情况(图2,冷冻电子断层扫描)。

图2:冷冻电子断层扫描技术示意图。使用电子束(TEM)对样本进行观察,同时倾斜样本,从不同观察角度创建一系列图像。3D立体容积得到重建,同时可对蛋白质的分布进行可视化观察与分析。
为便于观察样本“偏厚”的部分,样本必须提前打薄。除了冷冻超薄切片技术外,使用专门的冷冻扫描电子显微镜来进行聚焦离子束(FIB)研磨也不失为一种选择。两个离子束窗口应准确定位,确保在意向区域内能形成厚约200nm的薄冰片(薄层)。通过这种方式,即便是无法研究的部分样本,也能通过Cryo ET观察到(图3,FIB研磨)。

图3:聚焦离子束研磨技术示意图。使用扫描电子束观察样本,同时对样本专门使用了聚焦离子束(FIB),以去除薄冰片(薄层)上方及下方的物质。
由于整个工作流程较为冗长,所需步骤繁多,而EM上的材料和成像时间又会带来高昂成本,因此必须尽早确定样本质量以及网格上存在的靶区。此外,另一大挑战在于找出精准的研磨位置,确保薄层中含有意向蛋白质。
在克服这些挑战的过程中,冷冻光学显微镜成为了整个工作流程中至关重要的工具。使用冷冻光学显微镜即可检查样本质量。最重要的是,意向结构的位置可以使用基因编码荧光标签加以确定(图4)。

图4:靶区划定与检索。冷冻光学显微镜和FIB SEM中的荧光酵母细胞。左图:酵母荧光图片,其中显示了红色的核仁和绿色的细胞壁。用十字光标将核仁标记出来。右图:在FIB SEM中检索同样的位置,创建含有意向核仁的薄层。此处还显示了初始研磨阶段。薄层(黑色区域)上下研磨窗口可见。比例尺:10µm。感谢Philipp Erdmann博士提供的图片;酵母茎由德国马丁雷德Max-Planck生化研究所F.Wilfling创建。
这些标记可以选择性查看,以2D和3D形式揭示出所有意向结构的位置。将荧光图像和SEM图像关联起来,就能够将潜在的研磨部位联系起来。
尽管存在诸多挑战(安全冷冻传送样本、冰冷部分可能出现水冷凝、低温下使用物镜……),但使用市售冷冻光学显微镜就能解决这些问题。
冷冻光学显微镜和去雾处理
徕卡显微系统提供了专用冷冻光学显微镜THUNDER Imager EM Cryo CLEM,其中配备了最新LED技术和尖端先进的高灵敏度科研级CMOS摄像头(图5)。

图5:徕卡显微系统的专用冷冻光学显微镜THUNDER Imager EM Cryo CLEM。
遵照下列软件工作流程,即可在1分钟内创建完整的样本托(EM网格)概况图,检查网格支撑膜的完整性。在第二步中可以确定靶区荧光信号的分布情况,以及后续FIB研磨的合适区域位置。

图6:室温下THUNDER技术在HeLa细胞球上的应用
尽管宽场显微成像是一种非常灵敏的技术,非常适合冷冻成像,但图像中依然可以观察到背景噪声。这主要是因为样本离焦区域背景显著降低了系统的对比度和潜在信噪比(SNR)。拍摄的图像通常会显示出雾面现象,可能无法达到靶区所需的精细水平。
为解决宽场成像问题,徕卡显微系统开发了全新系列的成像系统——THUNDER成像系统,将成像解析技术作为其核心技术。每次采集图像时,系统会探测并清除失焦背景,直接获取目标区域的信号。与此同时,对焦区域内会保留标本特征的边缘和亮度。
特别是生物样本,其背景在整个图像中无法保持恒定,视场上的变化较大。成像解析技术会自动考虑到这一点,使聚焦的图像信号立即可见。
THUNDER Imagers有三种模式可供选择:
即刻成像解析(ICC)
小体积成像解析(SVCC)
大体积成像解析(LVCC)
ICC对应上述技术。
SVCC和LVCC结合运用了成像解析技术和基于decision-mask-based的3D反卷积方法,分别用于薄样本(SVCC)或厚样本(LVCC)。使用反卷积方法获得的自适应图像信息源自于一个从LIGHTNING演变而来的概念,徕卡显微系统公司的自适应反卷积方法最初是为共聚焦显微镜而开发的。
LIGHTNING以decision-mask-based作为基准为图像系列的每个像素计算一组适当的参数。结合宽视野点扩散函数(PSF)后,LIGHTNING可以用于宽视野探测。
THUNDER分辨率改善
对单个无重叠衍射限定物体,运用小体积成像解析(SVCC)可以增强分辨率。在给出的例子中,对40 nm直径的单一珠进行了成像(100x放大透镜,NA= 1.44),并采用了SVCC。相关样本的结果为分辨率增强*,即横向增强2倍左右(X切面使用SVCC的比率FWHM/原始数据=0.51),轴向增强2.5倍(Z切面使用SVCC的比率FWHM/原始数据=0.39)。
*通过点发射光的尺寸来提高分辨率。低于衍射限值的两个相邻结构很难彼此分开。

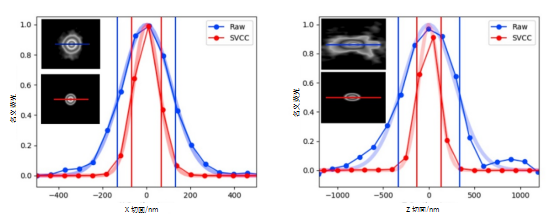
图7:尺寸小于光学分辨率限值的单一珠的强度测量。X轴(左)和Z轴(右):SVCC前(蓝点)后(红点)。高斯拟合曲线(阴影区域)。插图显示对应的XY和XZ平面。
利用THUNDER Imager EM Cryo CLEM进行玻璃化样本成像
THUNDER技术首次在环境温度下进行样本成像即获成功,因此徕卡专家随后提出了在冷冻条件下运用该技术的想法。宽视野冷冻图像的去雾处理尤为实用,因为这种处理不仅能改善图像质量,还能更加可靠地为后续EM工作流程步骤(即FIB研磨和TEM分析)识别出意向结构。

图8:THUNDER在冷冻条件下的应用。酿酒酵母细胞表达核仁标记物NOP56::mars(红色),并清晰显示出细胞壁的自发荧光(绿色)。左图:z堆栈的图像投影(THUNDER使用前);右图:经THUNDER-LVCC处理后的图像。插图显示放大区域。比例尺:5 µm。感谢Philipp Erdmann博士提供的图像;茎部由德国马丁雷德Max-Planck生化研究所F. Wilfling创建。
图8显示了使用THUNDER技术(THUNDER LVCC)观察到的酵母细胞。在左图中可以看到,细胞壁绿色自发荧光的离焦雾化会干扰核仁识别。有人可能会说,绿色荧光可以从重叠图像上去除,但同时需要对细胞壁的可视化来识别没有附着在上面的核仁。运用THUNDER技术后,背景雾化有所减少,同时又能保留信号;细胞壁与核仁清晰可见,更容易满足FIB研磨的识别目的。
我们曾在不同样本上使用THUNDER技术。图9显示了另一示例:绿色荧光染料与鬼笔环肽相结合来标记A9细胞。鬼笔环肽选择性地与纤维状肌动蛋白相结合,在真核细胞中发挥结构作用。左图中,细微结构被非焦光(见箭头处)隐藏,但在右图中,经过THUNDER SVCC处理后,他们在变得可见。

图9:使用Alexa Fluor 488鬼笔环肽标记纤维肌动蛋白(F肌动蛋白)所标示的A9细胞。THUNDER处理前(左图)后(右图)的3D stack的投影。THUNDER清除了雾层,甚至连细微的结构(箭头处)都变得更清晰可见,便于完成靶向标定(使用SVCC)。
F肌动蛋白很适合用来进行THUNDER成像,因为该蛋白属于薄纤维结构,改善效果能够立即显现。连同mCherry标示的F肌动蛋白,图10还显示了多孔结构:高尔基体外侧网状结构(TGN)中的蛋白质TGN46通过GFP荧光显示。TGN将新的蛋白质指示到不同的亚细胞目标位置。THUNDER技术清除了非焦光所产生的模糊图像,同时还显示了这些小型多孔结构。

图10:使用THUNDER SVCC前(左图)后(右图),HeLa细胞采用F肌动蛋白荧光标记(mcherry),高尔基体外侧网状结构蛋白TGN46(GFP)以及DNA(Hoechst 33342)。样品由英国伦敦弗朗西斯·克里克研究所的Marie-Charlotte Domart博士和Lucy Collinson博士提供。
❖结语
在本文中,我们利用成像解析技术探究了徕卡显微系统的THUNDER成像技术如何在冷冻状态下改善玻璃化样本的图像质量。即使是细微结构,也能通过清除主要由离焦光线产生的雾层或模糊图像来实现可视化观察。THUNDER成像技术不仅能够改善图像质量,还有助于轻松识别后续EM分析步骤所使用的结构。
相关产品

THUNDER Imager EM Cryo CLEM冷冻光电联用系统
共聚焦光学显微镜 STELLARIS 5 Cryo

关于徕卡显微系统
徕卡显微系统的历史最早可追溯到19世纪,作为德国著名的光学制造企业,徕卡显微成像系统拥有170余年显微镜生产历史,逐步发展成为显微成像系统行业的领先的厂商之一。徕卡显微成像系统一贯注重产品研发和最新技术应用,并保证产品质量一直走在显微镜制造行业的前列。
徕卡显微系统始终与科学界保持密切联系,不断推出为客户度身定制的显微解决方案。徕卡显微成像系统主要分为三个业务部门:生命科学与研究显微、工业显微与手术显微部门。徕卡在欧洲、亚洲与北美有 7 大产品研发中心与 6 大生产基地,在二十多个国家设有销售及服务分支机构,总部位于德国维兹拉(Wetzlar)。了解更多信息,请访问:www.leica-microsystems.com.cn
探索产品
应用领域
复合光学显微镜
体视与宏观显微镜
共聚焦显微镜
手术显微镜
数码显微镜
电镜样品制备
显微镜软件
显微镜摄像头
生命科学研究
工业与制造业
医疗
病理显微成像
教学显微镜
材料&地球科学
公检法取证
徕卡显微咨询电话:400-630-7761
05-15 WAYEAL皖仪
“世界计量日”——计量行业的可持续发展【专题直播,精彩持续】05-15 福禄克公司
干货分享 | 全面掌握新能源汽车维修检测工具的安全操作与精准测试05-15 福禄克公司
名单公布 | 2024现代电能质量书本申领活动寄送05-15 福禄克公司
【新升级】Fluke iSee安卓版APP,更专业,更易用!05-15 福禄克公司
操作指南 | LPGC 安装&优化,快速入门!05-15 Restek
新国标 | Restek 法医毒物领域产品解决方案05-15 Restek
细胞系鉴定试剂盒焕新上市:免费试用+礼品双重惊喜!05-15 赛默飞基因科学
德国元素助力AOAC食品检测技术与标准研讨会05-15 德国元素
血液专题 | 你敢信?锻炼身体也会害人?05-15
Ugo Basile口面部疼痛测试仪 | 新型大小鼠口面自我赏罚实验——为临床前口面部疼痛评估提供卓越解决方案!05-14 玉研仪器
走近用户,聆听心声 | 福立仪器走访国家级重点技工院校,强化合作与交流05-14
风雨携手共进,十载春华秋实——检测家十周年庆典!05-14 检测家
最高1000万!这35个地区均可领取补贴!现行有效的实验室政策汇总05-14
仪器租赁 | 沃特世 液质联用,月租金52000元起05-14
精准引领精彩 雷磁“智”向未来——新品发布会05-14
倒计时1天|《解析:qPCR 应用、技术要点与数据分析》线上直播05-14
智能科技,引领未来——天瑞仪器盛装亮相2024国际电子电路上海展05-14
同济大学与天瑞仪器产教融合创新实践基地挂牌仪式顺利举行05-14
VOC.5 | 石油化工行业供气 “宠儿”!05-14 普敦科技