恒光讲堂|近红外二区(NIR-II)监测药物性肝损伤——NO响应性比率荧光纳米探针的应用
2022-02-18 02:51:24, 恒光智影 上海恒光智影医疗科技有限公司
本文要点:目前,药物性肝损伤(DILI)的诊断主要依靠排除法。此法耗时且不可靠,可能给后续治疗带来困难。因此,迫切需要开发新的方法来精确诊断DILI。一氧化氮(NO)被认为是DILI早期统一、直接和重要的生物标记物,目前,NO检测的主要技术是化学发光成和第一近红外(NIR-I,650~900纳米)窗口的荧光成像。然而,化学发光的半衰期太短,无法保证持续观察。NIR-I荧光成像存在强光散射、组织吸收,限制了深层组织成像。关于分析物的定量检测,比率荧光探针由于于其内置的自校准功能,允许更高的SBR和更准确可靠的特定目标检测。目前用于NO活体成像的比率NIR-II荧光探针还尚未开发。

作者合理设计开发了一种NO响应性比率荧光纳米探针DCNP@MPS@IR NO,该探针用于第二个近红外(NIR-II)窗口荧光成像可以定量检测NO和监测DILI(图1)。在NO存在的情况下,IR NO转化为IR RA,DCNP@MPS@IR NO在808nm激发下(F1050Em,808Ex)在1050nm处呈现“开启”荧光信号,在980nm激发下(F1550Em,980Ex)在1550nm处呈现“始终开启”荧光信号,这导致了出现比率荧光信号F 1050Em,808Ex / F 1550Em,980Ex的“开启”。随后作者将DCNP@MPS@IR NO应用于肝损伤模型,体内结果显示DCNP@MPS@IR可用于量化扑热息痛(APAP)诱导的肝损伤中的NO,监测DILI,并通过NIR-II比率荧光成像筛选APAP的解毒剂。由此作者设想纳米探针DCNP@MPS@IR NO在不久的将来可能成为一种非常有用的生物技术工具,用于药物性肝损伤的可视化和早期诊断,并在临床上揭示药物肝毒性的机制。
首先基于分子内光诱导电子转移(PET)依赖的荧光开关机制,作者设计了一种小分子有机染料IR NO来响应NO。如图1a所示,作为电子受体的菁荧光团与给电子的邻苯二胺单元共轭以构建IR NO。由于IR NO中的分子内PET过程,菁荧光团的荧光被猝灭。在NO存在下,IR NO的邻苯二胺单元可转化为弱给电子能力的苯并三唑,从而阻断PET过程并恢复菁荧光团的荧光。最后,获得了发射波长为1050nm(808nm激发)的NIR-II荧光IR-RA。然后,通过将NO敏感部分IR NO和内标物下转换纳米粒子(DCNP,在980nm激发时发射1550nm)整合到载体介孔SiO2(MPS)中,合理设计了NO响应核~壳结构NIR-II比率荧光纳米探针DCNP@MPS@IR NO(图1b)。DCNP作为核心首先被封装到无定形二氧化硅中以形成核-壳结构DCNP@SiO2.DCNP@Si2, 然后蚀刻和装载IR NO以提供DCNP@MPS@IR NO。DCNP@MPS@IR NO体内检测NO使DILI可视化的机制如图1c所示。过量的药物摄入可导致肝组织损伤,加速L-精氨酸转化为NO,并显著增加肝细胞内源性NO水平。在静脉注射到患有DILI的小鼠体内后,纳米探针DCNP@MPS@IR NO由于肝脏的清除功能,将在肝脏中富集。在被内化到肝细胞并被NO触发时,DCNP@MPS@由于IR NO转化为IR RA,IR NO在808 nm激发下(记录为F 1050Em,808Ex)将在1050 nm处呈现“开启”NIR-II荧光。相反,DCNP@MPS@IR NO在980 nm激发下(记录为F 1550Em,980Ex )来自DCNP的1550 nm处的荧光信号的保持不变。因此,DCNP@MPS@IR-NO荧光强度比( F 1050Em,808Ex / F 1550Em,980Ex)为NO响应后升高。因此,使用该比率NIR-II荧光纳米探针,可以在体内精确定量和可视化NO浓度,从而进一步实现DILI的体内比率荧光成像。

NO响应NIR-II比率荧光纳米探针DCNP@MPS@IR NO的制备。通过使用亲核取代反应将菁染料IR 1061与DABT简单偶联获得IR NO(图2a). DABT、IR NO和IR 1061的紫外-可见-近红外吸收光谱表明,DABT在400-1000 nm范围内没有明显的吸收峰,IR 1061在900 nm处有一个宽的吸收峰,在实验中无法观察到IR NO的光谱, IR NO在812 nm处有一个微弱的近红外吸收峰(图2b)。当在808nm激发时,IR NO和IR 1061在1050nm左右有一个荧光(FL)发射峰,而DABT发射一个可忽略的NIR-II荧光信号(图2c)。特别是5μM IR-NO中的5μM IR 1061的荧光强度仅为84.9%,这是由于前者的细胞内PET效应。上述紫外-可见-NIR光谱和FL表征进一步证实了具有猝灭荧光的IR NO的成功合成。
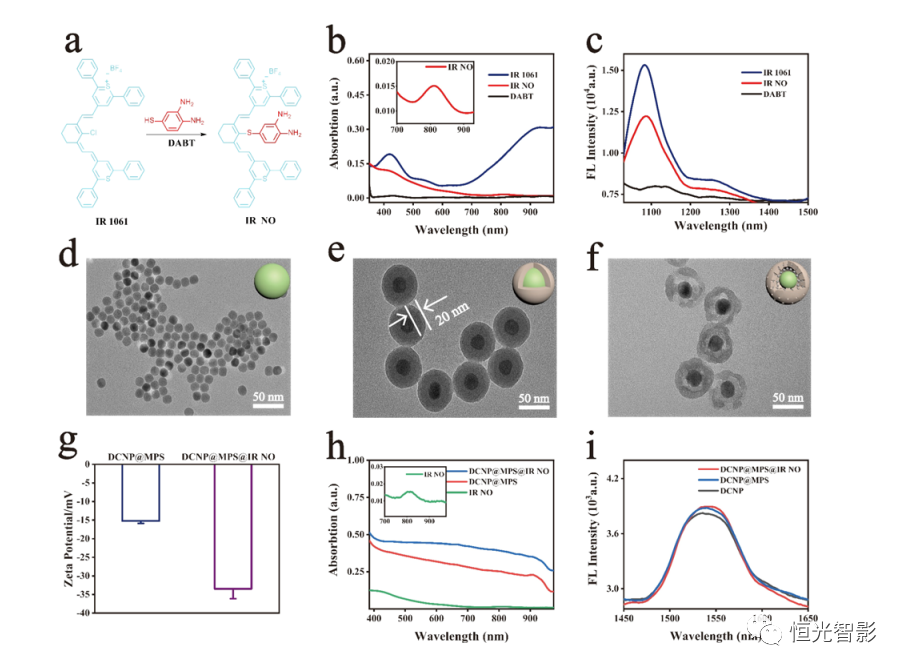
随后,作者研究了IR-NO对NO的光学性质。将PBS中的IR NO(10μM)与10μM NO在37°C下孵育15分钟。然后,测定治疗前后IR-NO的UV-可见光-近红外吸收光谱和荧光光谱。如图3a所示,在存在NO的情况下,457 nm处IR NO的最大吸收峰分裂为428和511 nm处的两个峰,同时在700 nm-1000纳米范围内899纳米处吸收增加。同时,IR-NO在1050nm处的荧光强度是未经治疗的9.2倍(图3b)。这些结果表明,当IR-NO的邻苯二胺结构与NO反应形成一个供电子能力减弱的三唑环时,IR-NA中的PET效应消失,NIR-II荧光信号立即恢复。同时,作者研究了DCNP@MPS@IRNO对NO的比率响应。0.2毫克/毫升PBS中的DCNP@MPS@IR NO与不同浓度的NO孵育(0-100uM)在37°C下放置15分钟,并在808/980 nm激光激发下记录这些样品的荧光光谱。观察到,随着NO浓度的增加,899 nm处的吸收逐渐增加(图3c)。这归因于纳米探针中的IR NO在NO存在下转化为IR RA,这与图3a中的结果一致。正如预期的那样,DCNP@MPS@IR NO的F1050 Em、808 EX信号随着NO浓度的增加明显增加(图3d)。相比之下,F1550 Em、980 Ex信号在不同浓度的NO下显示出较小的变化,这是由于该纳米探针的DCNP具有极好的稳定性(图3e)。关联DCNP@MPS@IRNO的FL强度比(F1050 Em,808 Ex/F1550 Em,980 Ex)随着NO浓度的增加,我们发现F1050 Em,808 Ex/F1550 Em,980 Ex强度与NO浓度(0-100μM)具有线性关系(Y=0.006220X +0.2044,R2=0.9933)(图3f)。DCNP@MPS@IR NO对NO计算的检测限(LOD)为0.61μM。上述结果充分验证了应用荧光比率纳米探针DCNP@MPS@IRNO定量检测NO的可行性。


为了进一步确认1050nm处的“开启”NIR-II荧光信号和“开启”比率信号确实是由APAP诱导的肝损伤期间产生的NO引起的,作者随后在没有DILI的小鼠上进行NIR-II荧光成像。给小鼠注射药物DCNP@MPS@IR NO(2毫克/毫升-尾静脉注射PBS(300μL)(记录为PBS组)6小时后,通过尾静脉注射200μL)。然后在808/980 nm激光激发下,在1050/1550 nm处收集每只小鼠的时间历程NIR-II荧光图像。结果发现,在整个150分钟的观察期内,距离肝脏区域1050 nm处的FL信号没有显示任何增加,并且远弱于APAP组(图4a、b和5a、b)。特别是,90分钟时的FL强度为在同一时间点APAP组的1/2.8。这些结果表明,DCNP@MPS@IR-NO由于肝脏中的低NO浓度,IR NO没有转化为IR RA。同时,1550 nm处的荧光在监测期间保持明亮,没有明显变化,这与APAP组一致(图5c)。此外,F1050 Em、808 Ex/F1550 Em、980 Ex的比率信号每个时间点保持在约0.2的低值(图5d)。值得注意的是,使用90分钟时的比值(0.21±0.0004)和图3f中的线性关系,PBS组肝脏的NO浓度计算为0.96 ± 0. 06μM,显著低于APAP组(47.5±3.8μM)(P<0.01)。这一结果进一步表明APAP组肝脏NO水平异常。上述结果表明,纳米探针的F1050 Em、808 Ex信号和F1050 Em、808 Ex/F1550 Em、980 Ex比例信号在体内的“开启”主要归因于肝脏中NO的过度表达。

图5。(a) PBS组小鼠的时间历程NIR-II FL图像和相应的比率图像。(b,c)1050nm处相应的量化平均荧光强度(b)1550nm(c)记录时间点的肝脏区域。(d)记录时间点肝脏区域的相应量化平均比率信号;1050和1550 nm分别代表F1050 Em、808 Ex和F1550 Em、980 Ex。比率代表F1050 Em、808 Ex/F1550 Em、980 Ex。
在临床上,NAC是APAP中毒的常用解毒剂,可用于减轻APAP引起的肝损伤,副作用小。作者研究了纳米探针DCNP@MPS@IR-NO是否可用于评价NAC对APAP所致肝损伤的修复作用。按照APAP组的方法建立APAP诱导的肝损伤模型。然后注射APAP5小时后将小鼠腹腔注射NAC(300 mg /ml)以减轻肝损伤,1小时后,DCNP@MPS@IR NO(2mg/ml, 尾静脉注射200μL(记录为APAP-NAC组)。然后在808/980 nm激光激发下,在1050/1550 nm处获得每只小鼠的时间历程NIR-II荧光图像。如图6a,b所示,肝脏区域1050 nm处的FL信号在90分钟时缓慢增加至顶峰,信号强度仅为5分钟时的1.04倍。F1050-Em,808-Ex信号的“开启”程度远低于APAP组,这是由于NAC治疗后NO含量减少所致。与APAP组和PBS组一样,APAP-NAC组小鼠的肝脏区域在整个观察期间在1550 nm处发出明亮稳定的荧光(图6a,c)。因此,APAP NAC组的比率FL信号的“开启”程度远低于APAP组,90分钟时F1050 Em、808 Ex/F1550 Em、980 Ex的最大信号强度仅为APAP组中在同一时间点的1/2.4。上述结果充分证明NAC能有效减轻APAP诱导的肝损伤,DCNP@MPS@IR NO在筛选DILI解毒剂方面大有可为。

图6:(a) APAP-NAC组小鼠的时间历程NIR-II FL图像和相应的比率图像。(b,c)相应的量化平均荧光强度1050nm(b)和1550nm(c)记录时间点的肝脏区域。(d)记录时间点肝脏区域的相应量化平均比率信号;1050和1550 nm分别代表F1050 Em、808 Ex和F1550 Em、980 Ex。比率代表F1050 Em、808 Ex/F1550 Em、980 Ex 。
参考文献
Bai Feicheng,et al."A NO-Responsive Ratiometric Fluorescent Nanoprobe for MonitoringDrug-Induced Liver Injury in the Second Near-InfraredWindow.." Analytical chemistry .(2021):doi:10.1021/ACS.ANALCHEM.1C02238.
⭐️ ⭐️ ⭐️
近红外二区小动物活体荧光成像系统 - MARS
NIR-II in vivo imaging system
有不同型号的样机可以测试,请联系:
艾中凯(博士)
132 6299 1861
⭐️ ⭐️ ⭐️
恒光智影
上海恒光智影医疗科技有限公司,专注于近红外二区成像技术。致力于为生物医学、临床前和临床应用等相关领域的研究提供先进的、一体化的成像解决方案。自主研发近红外二区小动物活体荧光成像系统-MARS。
与基于可见光波长的传统成像技术相比,我们的技术侧重于X射线、紫外、红外、短波红外、太赫兹范围,可为肿瘤学、神经学、心血管、药代动力学等一系列学科的科研人员提供清晰的成像效果,助力科技研发。
同时,恒光智影还具备探针研发能力,我们已经成功研发了超过15种探针,这些探针将广泛地应用于众多生物科技前沿领域的相关研究中。
⭐️ ⭐️ ⭐️
上海恒光智影医疗科技有限公司
地址:上海市浦东新区张江高科碧波路456号 B403-3室
网址:www.atmsii.com
邮箱:ai@atmsii.com
电话:132 6299 1861 (同微信)
⭐️ ⭐️ ⭐️
04-18 德国元素
Moku时间间隔与频率分析仪发布!表征和控制系统应用的全面解决方案。04-18 圈内人都会关注
拒绝网络谣言,守护清朗园区04-18 国产精密仪器厂家
橙达仪器受邀参加中国化学会第十八届全国有机合成化学学术研讨会04-17 Orienda
以旧换新 │福禄克助力测试测量仪器提质焕新04-17 福禄克公司
直播邀约 | 2024新版新功率理论及标准详情解读04-17 福禄克公司
直播邀约 | 保障网络稳定安全,高标准机房都在这样做04-17 福禄克公司
福禄克计量校准部新品发布会—北京场04-17 福禄克公司
如何以科技助力高校发展?郑州这场会有答案04-17 市场部
英诺德德国慕尼黑首秀告捷,以创新点亮Smart Lab主题04-17 市场部
探讨水资源保护:薄膜微萃取法检测地表水中的农药04-17 英诺德INNOTEG
肿瘤防治宣传周——科学防治,精准检测04-17 赛默飞基因科学
展会回顾 | 2024 CBIFS 食品安全技术论坛04-17 Restek
精彩回放:CBIFS 食品安全技术论坛圆满落幕!04-17
STTT | 北京协和医院发现胰腺囊性肿瘤新型囊液糖蛋白标志物04-17
聚焦丨TRT-V8000隧道超前地质预报新品发布暨隧道检测技术交流会精彩回顾04-17 物探部
【聚焦激光】Ophir5款激光功率表头,您所期待的,这里都有!04-17
皖仪科技Analytica2024,闪耀慕尼黑,走出国际范儿!04-17 WAYEAL皖仪
Argolight荧光显微镜校准片免费试用!04-17 圈内人都会关注
质在精准,谱于“英”用 —— “专家云讲堂”临床质谱精准营养专题今晚开播!04-17