AP SMALDI质谱成像技术可视化分析微小隐孢子虫体外感染细胞和宿主组织
2024-03-13 12:47:41, Create 科瑞恩特(北京)科技有限公司
关键词:MALDI-MSI 质谱成像,Cryptosporidium parvum 小隐孢子虫,AP-SMALDI 大气压MALDI质谱成像离子源
微小隐孢子虫属原生动物界顶复门(Apicomplexa),是导致人类隐孢子虫病的主要病因。该病主要通过感染传染性孢子囊或摄入受污染的水/食物传播,感染者表现为腹痛、恶心、厌食、发热和严重水样腹泻等症状。在发展中国家,微小隐孢子虫是导致儿童严重腹泻的主要原因之一,对儿童成长和生命健康构成巨大威胁。目前,临床上尚无有效的治疗方法。微小隐孢子虫的新陈代谢能力较弱,依赖宿主细胞的代谢来进行快速繁殖。为深入了解微小隐孢子虫引起的代谢变化,本研究运用 MALDI-MSI 和 HPLC-MS/MS 技术对微小隐孢子虫在人类肠道上皮细胞(HCT-8)和小牛肠中的代谢进行了解析。此外,该研究首次提供了感染细胞和牛组织的分子生物标志物。这些发现有望为寻找新型抗隐孢子虫药物靶点提供重要线索。

2023年6月,德国吉森大学无机与分析化学研究所 Bernhard Spengler 团队发表了题为“Mass Spectrometry Imaging of In Vitro Cryptosporidium parvum-Infected Cells and Host Tissue”的文章,该研究采用大气压扫描微探针基质辅助激光解吸/电离(AP-SMALDI)质谱成像(MSI)和液相色谱-串联质谱(HPLC-MS/MS)相结合的方法,成功鉴定和定位了体外培养的微小隐孢子虫感染的宿主细胞,以及在新生小牛肠中寄生的分子生物标志物。此研究提供了微小隐孢子虫感染的人类细胞及牛组织的一个生物标志物,为深化对隐孢子虫病病理生理机制以及潜在代谢改变的理解提供了重要的信息。通过整合质谱成像和质谱分析技术,研究团队不仅为隐孢子虫感染的细胞和组织提供了高分辨率的分子图谱,还为未来探索新型抗隐孢子虫药物靶点和治疗方法提供了有力的支持。
本研究的研究思路是通过使用 MALDI-MSI 和 HPLC-MS/MS 技术,研究微小隐孢子虫在人类肠道上皮细胞(HCT-8)和小牛肠中引起的代谢变化及生物标志物的分布情况。具体研究内容包括以下五个步骤:
从感染的新生犊牛中获取微小隐孢子虫卵囊,以及感染和未感染的肠道组织。人回盲腺癌细胞(HCT-8)使用 RPMI 1640 培养基进行培养,保持在 37℃ 和 5% CO2环境中。
微小隐孢子虫感染宿主细胞,并制备细胞单层膜以及寄生虫微丸。
对微小隐孢子虫感染的牛小肠进行冷冻切片,每个肠组织样品制备3个切片作为技术重复。
使用 UHPLC-MS/MS 技术对代谢产物进行详尽分析。
利用 MALDI-MSI 技术,在单分子层和宿主肠道组织中显示生物标志物的分布情况。

图1. 一般工作流程。
从新生犊牛中获得微小隐孢子虫卵囊、感染和未感染的肠(A)。这些厚壁卵囊用于产生细胞微球,单层细胞和人工感染肠道组织(B)。利用细胞微球切片获得具有统计学意义的标志物(C)。通过 MALDI-MSI 显示单层细胞和宿主肠道组织中的标志物(D)。
4.1
在微小隐孢子虫研究中,HCT-8 细胞系在体外实验中被广泛采用。通过将细胞团切割成薄片,实现了 MALDI-MS 实验的均匀样品布局以及统计分析的可行性。图2详细展示了实验方法,通过测量不同 HCT-8 细胞切片,我们发现MS离子 m/z 530.3212 在感染中显著增加,表现为一个显著的标志性特征。通过采用不同的检测模式,我们提高了信号强度并改善了检测限。为确保实验一致性,我们采用相同条件进行技术复制。Mirion 和 Perseus 软件被用于筛选潜在的生物标志物,揭示了微小隐孢子虫感染与对照样本之间的离子,在正负离子模式下均有显著的上调和下调信号。这一结果进一步强化了感染引起的代谢变化的可靠性和复现性。

图2.生物标记物测定工作流程:
(A)左侧部分展示了感染切片,右侧部分是相应的对照样本。上调的感染标志物LPE(22:4)为[M+H]+, m/z 530.3212±5 ppm,红色,每片50 × 50像素,步长10µm。(B)三份技术重复,LPE(22:4) 为 [M+H]+, m/z 530.3212±5 ppm,每片像素为50 × 50像素,步长为 10µm 。(C)由 Perseus 生成的热图片段。列的颜色代码表明它是否是相应的标记。红色表示与其他样本组相比,信号明显增强。红色箭头表示可视化的标记是热图中的许多标记之一。
4.2
通过 LIPID MAPS 数据库,对先前确定的标志物进行了详细注释。脂质是所有细胞的基本构成部分,对于细胞膜的结构和信号传递至关重要。在 HPLC-MS/MS 测量和统计评估中,我们重点关注脂质的测定,涵盖了所有的 m/z 信号。利用 LIPID MAPS 的搜索标准,获得了3221个正离子模式下的注释和3059个负离子模式下的注释。研究结果表明,在感染过程中,磷脂酰丝氨酸(PSs)和磷脂酰肌醇酰胺(PIs)的含量增加,而磷脂酰胆碱(PCs)、磷脂酰乙醇胺(PEs)和溶脂类的含量减少。通过 LIPID MAPS 数据库的注释,我们得到了 HPLC-MS/MS 测量的脂质组成列表,其中37个正离子模式下上调的脂质已通过 MS/MS 实验证实。此外,我们观察到寄生虫感染对溶脂类的组成产生了影响,这对于细胞代谢和信号传导具有重要意义。这一综合分析进一步阐释了微小隐孢子虫引起的生物学响应中脂质变化的特征。
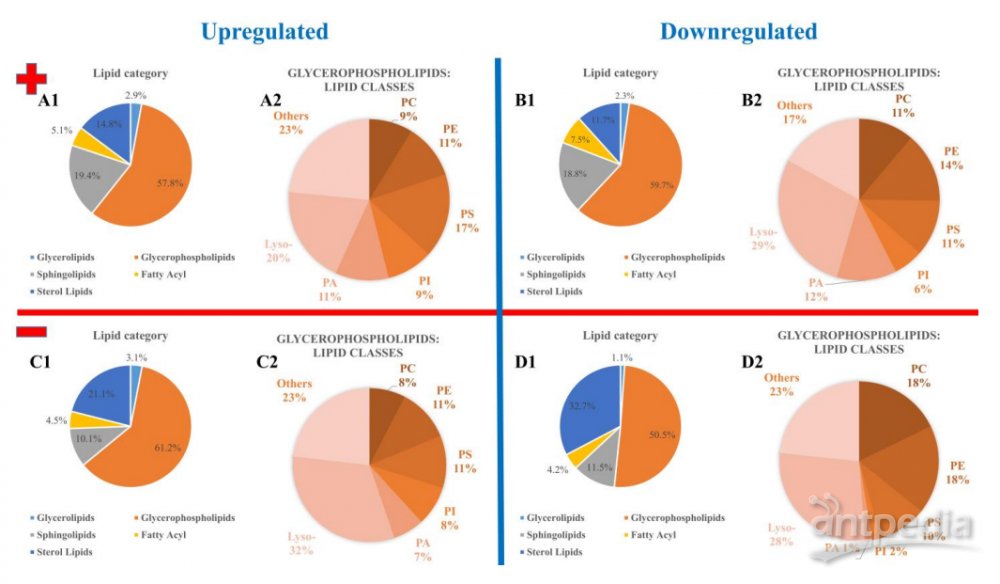
图3. 注释脂类的概述,显示检测到的 HCT-8 标记的类别丰度(信号数的百分比(%)):(A,B)正离子模式;(C、D)负离子模式;(A、C)脂质上调;(B,D)下调脂质-(1)脂质类别,(2)检测到甘油磷脂类中的脂质类别。
4.3
在正离子模式下,我们鉴定了38个与 C. parvum 感染相关的上调信号和16个下调信号,这些信号分别出现在 HCT-8 细胞团和宿主组织中。图4生动展示了感染的 HCT-8 细胞层底部和对照样本顶部的图像,清晰呈现了感染标志物的分布。在正离子模式下,感染特定信号的分布包括 [plasmanyl-PC(O-16:1/20:4)+H]+(m/z 766.5720)和 [LPE(20:3)+H]+(m/z 504.3036)。与微小隐孢子虫感染相关的脂质类 PC 增加,而 LPE 则是细胞膜的一部分,在其他酶的激活和细胞信号传导中发挥关键作用。进一步对微小隐孢子虫感染的新生牛肠组织的冷冻切片进行分析,显示了感染标记 [LPE(20:3)+H]+ (m/z 504.3036)和 [LPE(22:4)+H]+(m/z 530.3058)在小肠内的分布,与寄生虫繁殖的位置一致。这些标记主要出现在小肠的内部或腔道区域,正是微小隐孢子虫繁殖的地方。与 T. gondii、B. besnoiti 和 N. caninum 感染的宿主细胞的生物标志物进行比较表明,PI(36:1)作为 [M-H]− 是微小隐孢子虫和其他寄生虫感染的宿主细胞的标志。这一结果为理解微小隐孢子虫感染的分子机制提供了关键的见解。
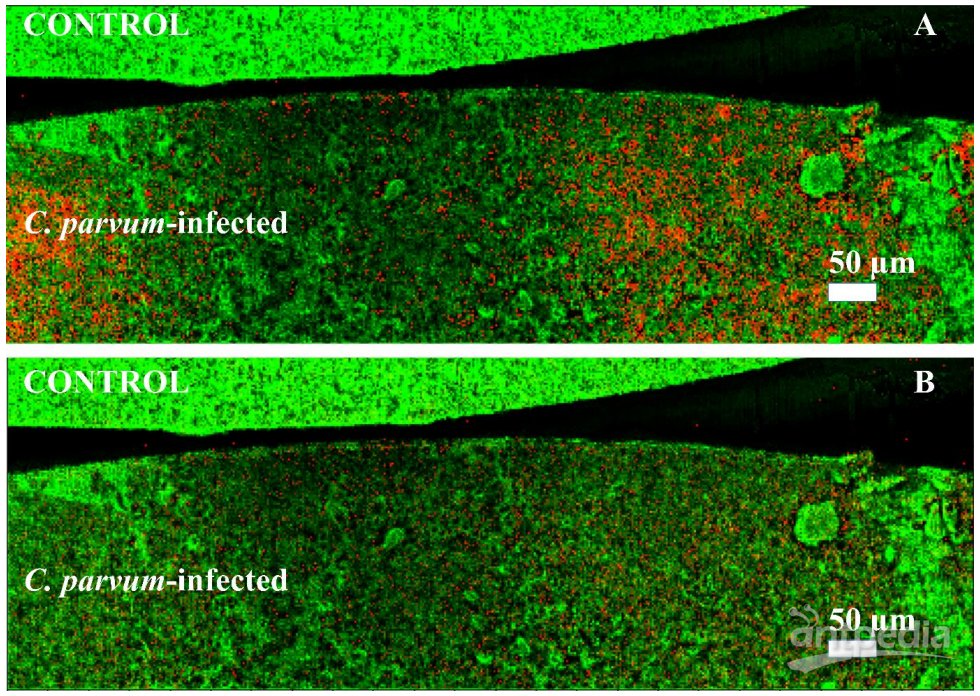
图4. 单层细胞生物标志物的可视化呈现:
在正离子模式下进行的 AP SMALDI MSI 测量,采用 5µm 激光聚焦直径和步距。两幅图像的绿色通道可视化总离子计数(TIC),红色通道显示两种不同感染标志物的分布(±5 ppm),这些标志物通过对细胞团或宿主组织进行的 LC-MS/MS 检测确认。(A)感染标志信号 m/z 766.5720,注释为 [plasmanyl-PC(O-16:1/20:4)+H]+,(B)感染标志物信号 m/z 504.3036,注释为 [LPE(20:3)+H]+。
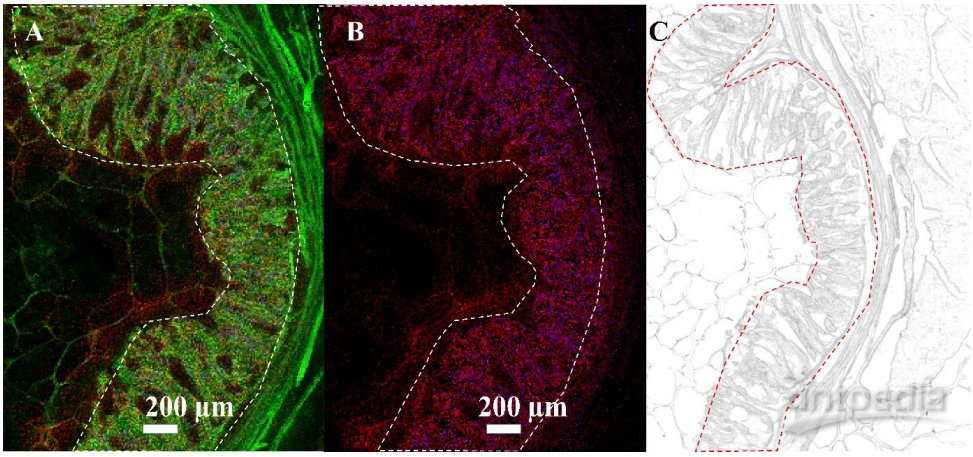
图5.宿主组织中感染生物标志物的可视化呈现:
在正离子模式下进行的 AP SMALDI MSI 测量,采用 10µm 激光聚焦直径和 Full Pixel 模式检测。红色和蓝色通道显示了两种感染标志物的分布(±5 ppm质量容限),这些标志物通过对细胞团或宿主组织进行的 LC-MS/MS 检测确认。(A)RGB MSI图像,绿色为 m/z 756.5513 离子信号。红色为 m/z 504.3036,注释为 LPE (20:3) [M+H]+,蓝色为感染标志物信号 m/z 530.3058,注释为 LPE (22:4) [M+H]+。(B)红色为感染标志物信号 m/z 504.3036,注释为 LPE (20:3) [M+H]+,蓝色为感染标志物信号 m/z 530.3058,注释为 LPE (22:4) [M+H]+。(C)整个肠段的光学图像。感染区域(褶皱和绒毛)以红色轮廓显示。
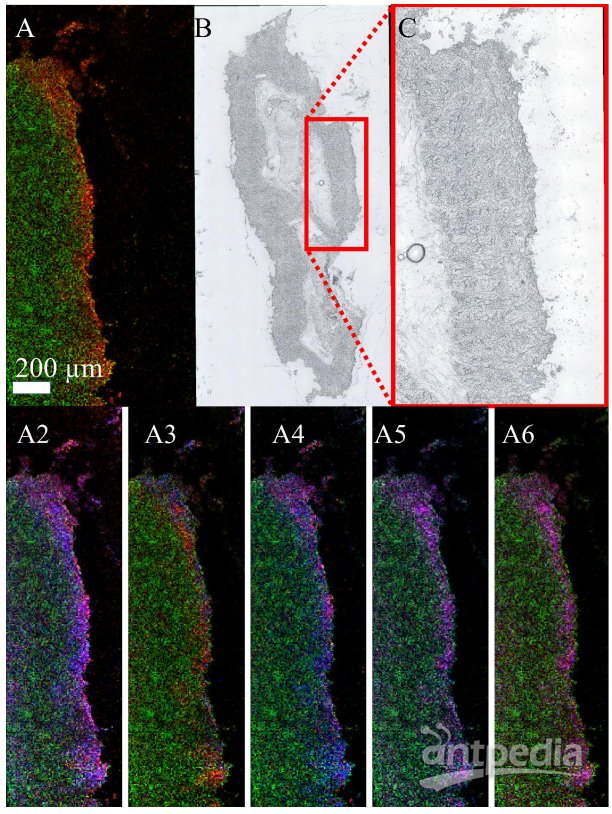
图6.微小隐孢子虫感染新生牛肠道组织生物标志物的 AP SMALDI MSI 可视化实验:
用 12µm 激光聚焦直径和步长对微小隐孢子虫的牛肠道进行正离子模式的 MALDI MSI 测量。绿色通道表示 m/z 726.5603 处的离子信号。红色和蓝色通道显示了通过 LC-MS/MS 测量细胞微球较早识别的两个感染标记物(±5ppm质量耐受性)的LC分布。(A)m/z 504.3057 处感染标记信号(红色),LPE(20:3) [M +H]+, (B)全肠段光学图像,(C)测量区域放大光学图像。(A2-A6)证实了另外10个生物标志物对A的解释。这10个生物标记物均在同一区域发现。
本研究首次应用 AP SMALDI MSI 技术在分子水平上探究了微小隐孢子虫感染的人类宿主细胞和牛肠组织。通过反复比较感染和非感染的细胞微球、宿主单细胞和肠道组织切片,成功地鉴定了微小隐孢子虫感染的脂质生物标志物。利用 AP-SMALDI MS 和 MSI 在正负离子模式下揭示了这种侵染性感染造成的影响,并通过软件对结果进行分析。通过这一方法,在微小隐孢子虫感染样本中检测到2232个离子信号,与对照组显著不同。通过数据库和基于 MS/MS 实验的结构信息,成功地确定了54个生物标志物。这些数据与关于其他寄生虫(如 T. gondii、B. besnoiti 和 N. caninum )的已发表数据进行比较,揭示了 PI(36:1)是这三种寄生虫感染的共同标志物。MSI 实验分析了细胞层以及正常和感染的宿主肠组织,进而成像了先前发现的标志物。这使得感染细胞或宿主肠组织能够与未感染的细胞和健康的宿主组织区分开来,并提供了5到10微米的横向分辨率可视化寄生虫感染的能力。这项研究为深入探讨微小隐孢子虫对宿主细胞代谢的机制提供了基础。这些新发现的脂质数据有助于揭示微小隐孢子虫的代谢途径,为对抗微小隐孢子虫和其他寄生虫提供额外的药物靶点。
文献地址:https://www.mdpi.com/2218-273X/13/8/1200
在大中华区独家代理的两款质谱成像离子源,都可搭载Thermo ScientificTM Q ExactiveTM或Obitrap ExplorisTM系列质谱仪。

AP-SMALDI 5AF高分辨自动聚焦3D快速质谱成像系统,常压操作环境,空间分辨率可达到3μm,独特3D检测模式可以检测凹凸不平的样品表面,快速检测模式可达18pixel/s,全像素检测大大提高检测灵敏度,高空间分辨率和高质量分辨率使样本中的分子化合物达到最佳成像效果。

MALDI ESI InjectorTM 透射式超高分辨质谱成像系统,可以同时搭载MALDI离子源与ESI离子源,既可用于传统LC-MS/MS实验,也可用于质谱成像检测,通过双离子漏斗接口实现离子源快速切换,无需拆卸,操作便捷,并且接口可以进一步升级为MALDI-2和t-MALDI检测,大大提高空间分辨率和检测灵敏度。





03-22 国产精密仪器厂家
福立仪器2024新品城市路演首战西安告捷|福立色质谱维护保养技术交流暨新品发布会03-21
尖端科学仪器,助力高质量发展 — 沃特世支持大规模设备更新(应用篇)03-21 沃特世
【如何有效检测新污染物】之APGC-MS/MS解决方案03-21 沃特世
相约春天 | 沃特世诚邀您参加BioAQ 2024中国生物药分析与质量峰会03-21 沃特世
沃特世推出创新型Oasis叠层萃取柱,显著简化并加快PFAS检测流程03-21 沃特世
有机溶剂辅助微波消解ICP-MS法测定原油中微量金属元素03-21 美诚
您的旧水机可以抵万金!03-21
为科研减负,计量大学实地考察落实DMB血液深度03-21
设备升级——教育科研仪器升级选型方案来啦!03-21
传承不息,焕新升级 | 德国元素IRMS同位素质谱选型方案03-21 德国元素
哈希官方商城世界水日特惠专场03-21
福利|关注实验室安全,为新学期教学科研做好保障03-21
关注睡眠,关爱心脏,与健康同行03-21 医疗中心
大咖解读文献 直播回放|安徽理工大学张通老师:考虑原位应力对饱油煤中动态孔隙-裂隙演变和多相渗流影响的实验研究03-21
GLMY创想仪器丨Elvatech伊瓦特手持式光谱仪亮相百铸订单采购会03-21 国产精密仪器厂家
谱育科技饮用水全要素解决方案,助力饮用水安全高质量发展03-21 点击关注→
创新赋能|谱育科技诚邀您莅临第二十二届中国国际环保展览会03-21 点击关注→
关于公司名称变更的通知03-21 四方仪器
展会第一天 | 现场火热,明日W5.5300展位精彩不容错过!03-20