β-地中海贫血基因疗法的技术路线盘点
2024-01-11 14:44:36

β-地中海贫血是最常见的地贫类型之一,鉴于β珠蛋白基因缺陷的差别,β-地中海贫血还可以分为两种:β-珠蛋白基因簇(HBB)基因缺失和点突变致β链的生成被完全抑制的β0地中海贫血,以及β链的生成部分被抑制的β+地中海贫血。近年来,随着研究的深入,针对β-地中海贫血的临床治疗在多个方面取得了进展,包括药物治疗、造血干细胞移植(hematopoietic stem cell transplantation,HSC)以及基因治疗等。然而,仍需不断探索和研究,以实现更为安全、有效的治疗方案。
重型 β-地贫患者在出生后不久就会表现出严重的贫血症状,除自身无法合成血红蛋白外,还会形成包涵体,进而引发其他并发症。因此,这类患者需要终身规律输血治疗,以确保身体正常发育所需的血红蛋白水平。中间型 β-地贫患者的症状相对较轻,表现为轻至中度的贫血。他们能够自身合成部分血红蛋白,因此只需要在特定时期内偶尔进行输血,以提高血红蛋白浓度。轻型 β-地贫患者通常没有明显的临床症状或几乎无症状,因此无需输血治疗。
随着对β-地中海贫血机制的深入了解,基因疗法的思路逐渐明晰。目前,已经验证并具有一定可行性的基因治疗方案主要有以下三种:通过慢病毒载体导入或基因编辑同源修复(HDR)β-珠蛋白基因,为患者的血红细胞提供完整健康的β-珠蛋白链基因。另外,通过重新激活γ-珠蛋白链的合成,提高HbF的表达水平,实现血红蛋白的功能性替代。这些方案为β-地中海贫血的治疗提供了新的思路和可能性,但仍需进一步的研究和临床试验来验证其安全性和有效性。

利用慢病毒载体(lentivirus vector,LVV) 将具有完整功能的 β-珠蛋白(β-hemoglobin,HBB)基因体外整合入自体造血干细胞再回输,以纠正β 珠蛋白βA-T87Q-珠蛋白基因合成障碍,以此来恢复正常的成人血红蛋白生成功能。目前全球至少有4家已披露的企业采用了这一方案。
蓝鸟:Zynteglo(beti-cel)
Zynteglo是Bluebird Bio(蓝鸟生物)一款基于LentiGlobin平台的慢病毒体外基因疗法,2022年8月获FDA批准在美国上市,2019年获欧盟批准上市,用于治疗输血依赖性β-地中海贫血。该疗法通过慢病毒载体,将正常的β-珠蛋白基因(βA-T87Q-珠蛋白基因)的功能性拷贝作为目的基因,使患者能够产生正常的HbAT87Q蛋白,有效降低或消除输血需求。这是全球首个基于细胞的基因疗法,售价达280万美元(约合1900万人民币)。
本导基因:BD211
本导基因拥有基因编辑-BDmRNA平台和基因添加-BDlenti平台。BD211是一款基于本导基因下一代慢病毒载体平台BDlenti打造的基因修饰自体造血干细胞地贫治疗药物,其特点为:在慢病毒载体中引入专利性绝缘子设计,降低慢病毒载体的整合突变风险;补偿经过优化的HBB基因表达序列,修复患者的血红蛋白至健康成人的生理状态。前期BD211在两位β0/β0重症地贫患者上进行了长达两年的随访证明安全有效。这是国内首次报道基于慢病毒载体基因转导技术治疗β-地中海贫血的成功案例,2024年1月3日,本导基因提交的BD211自体CD34+造血干细胞注射液成功获得了中国药品监督管理局的(NMPA)临床试验默示许可。
康霖生物:KL003
康霖生物创新性地打造了两大模块化基因治疗研发平台:腺相关病毒(AAV)载体平台和慢病毒(LV)载体平台。基于这两个技术平台,康霖生物自主研发、用于治疗地中海贫血的创新基因治疗药物KL003,目前已成功完成治疗17位患者。2024年1月3日,康霖生物的自主研发的 KL003 细胞注射液成功获得中国国家药品监督管理局(NMPA)的临床试验默示许可。康霖生物还突破了高难度的地中海贫血基因大容量慢病毒载体生产技术,可将地中海贫血基因治疗产品的成本从几十万美元降低到几十万人民币左右,让更多的患者用得起,提高了药物可及性。
禾沐基因:HGI-001
禾沐基因基于编码T87Qβ珠蛋白的慢病毒转导自体造血干细胞疗法HGI-001,可对患者造血干细胞在体外进行转导,改造后的造血干细胞在红系分化的过程中可以高效表达β珠蛋白,从而弥补基因突变造成的功能缺陷,实现β地中海贫血的功能性治愈。2023年12月19日,禾沐基因自主研发的HGI-001注射液成功获得中国国家药品监督管理局(NMPA)的临床试验默示许可。
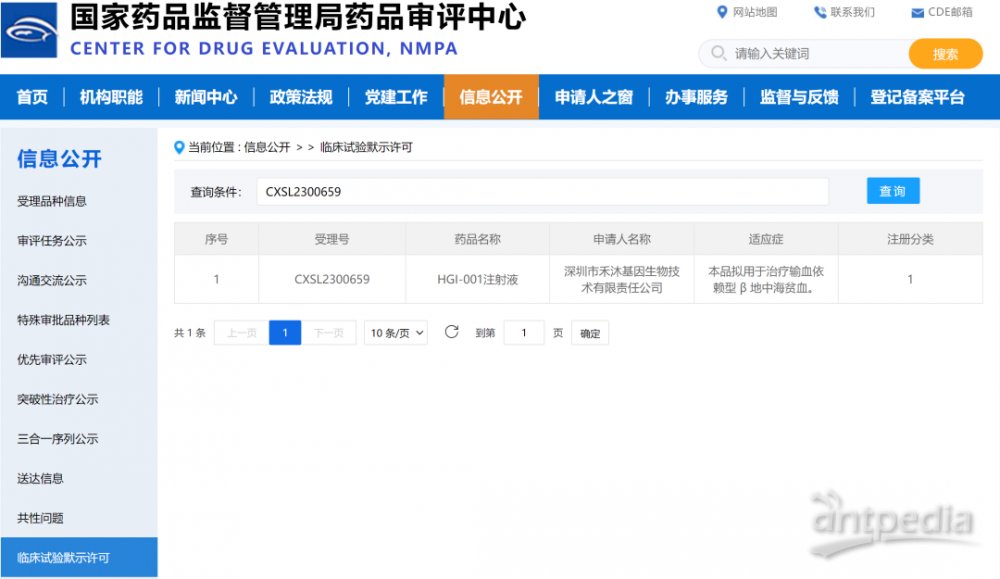
该产品技术原理与蓝鸟生物的相同,生产流程相近,不过在制备工艺上进行了优化。在IIT试验中,5位完成细胞回输的患者均已无需输血治疗,最长摆脱输血时间达34个月(截至2023年12月),并且未发现与基因治疗相关的副作用。


BCL11A是一种可以抑制红系细胞中的γ-珠蛋白表达和胎儿血红蛋白HbF合成的转录因子,BCL11A基因的表达与γ-球蛋白表达成负相关。因此,通过基因编辑抑制BCL11A的表达,或是直接针对γ-珠蛋白的启动子来增强表达都可以提升HbF水平。
Vertex/CRISPR:exa-cel(CTX001)
exa-cel是一款由Vertex和CRISPR Therapeutics合作研发的CPRSPR基因编辑疗法,通过对CD34+造血干细胞的BCL11A红细胞特异性增强子(红系增强子)区域进行基因敲除(电穿孔方式),以降低BCL11A的红系细胞特异性表达,可诱导HbF的表达。
2023年12月8日,FDA批准CRISPR/Cas9基因编辑疗法CASGEVY(exa-cel)上市,用于治疗伴有复发性血管闭塞危象(VOC)的镰状细胞病(SCD)。CASGEVY是全球首个获批的CRISPR/Cas9基因编辑疗法,开启了基因编辑赛道的新纪元。
Sangamo/赛诺菲:BIVV003
BIVV003(ST-400)由Sangamo Therapeutics/赛诺菲共同研发,使用ZFN基因编辑系统对患者自体造血干细胞和祖细胞(HSPCs)进行基因编辑,靶向BCL11A基因,抑制其功能使得细胞能够重新表达HbF,目前正在进行治疗输血依赖型β-地中海贫血的Ⅰ/Ⅱ期临床试验。
邦耀生物:BRL-101
BRL-101是一款依托邦耀生物自主研发的基因编辑技术创新平台(CRISTARS®)和造血干细胞平台(ModiHSC®)开发的靶向BCL11A红系增强子的一款基因治疗产品。基于这两大技术平台,邦耀研发的治疗重型β-地中海贫血的基因治疗候选产品在IIT临床研究中,在全球范围内成功治愈6例β-地贫患者,创造了全世界首次通过CRISPR基因编辑技术治疗β0/β0型重度地贫的成功案例。2022年8月,BRL-101的IND申请获得CDE许可,目前即将完成Ⅰ期探索性注册临床,计划明年进入关键性确证临床试验。
博雅辑因:ET-01
博雅辑因打造了以基因编辑技术为基础的四大平台:造血干细胞平台、通用型CAR-T平台、RNA碱基编辑平台和新药研发平台。基于四大技术平台,ET-01是CRISPR/Cas9基因修饰BCL11A红系增强子的自体CD34+造血干祖细胞注射液,通过在基因组层面阻断BCL11A表达提升HbF水平。2021年1月,公司宣布ET-01的IND申请获得NMPA批准,2022年11月宣布完成了对多中心Ⅰ期临床试验最后一例的输注。ET-01是中国首个获国家药监局批准开展临床试验的基因编辑疗法产品和造血干细胞产品。
Editas:EDIT-301
Editas Medicine公司的EDIT-301是一种体外基因编辑疗法,由患者来源的CD34+造血干细胞和祖细胞组成,通过使用核酸酶AsCas12a来对CD34+HSC的HbF基因(HBG1与HBG2)的启动子进行基因编辑,使得红细胞中HbF被重新激活而持续表达,来缓解或治愈镰状细胞性贫血和输血依赖性β地中海贫血。目前,EDIT-301在输血依赖型β-地中海贫血患者中的Ⅰ/Ⅱ期临床试验正在进行,已公布的6例患者的最新有效性和安全性积极数据显示该疗法的巨大潜力。
瑞风生物:RM001
瑞风生物自主研发的基因编辑药物RM001(HBG基因修饰的自体CD34+造血干细胞注射液)同样针对HBG1/2靶序列,用于治疗β-地中海贫血,通过CRISPR/Cas9可直接重新激活γ-珠蛋白基因表达来实现HbF表达水平的上调,避免编辑BCL11A这一重要多功能转录因子,具有更好的安全性。据瑞风生物最新公布的RM-001的临床研究数据,7名IIT患者和9名IND入组临床Ⅰ期患者在治疗后均成功脱离输血依赖,患者的随访时间最长接近2年,且未发现产品相关的不良事件。2022年11月1日,瑞风生物自主研发的β-地中海贫血基因编辑药物RM-001IND申请获得国家药监局默示许可,随着RM-001临床试验的持续进展和成功,瑞风生物计划在2024年开展临床Ⅱ期试验,该疗法的成功应用为β-地贫患者提供了新的治疗选择。
Beam:BEAM-101
Beam Therapeutics的领先的体外基因编辑候选产品BEAM-101是一种自体造血干细胞(HSC)研究疗法,它结合了碱基编辑技术。这项疗法模仿遗传性胎儿血红蛋白(HPFH)个体中观察到的单核苷酸多态性,以潜在缓解导致镰状细胞病或β-地中海贫血的突变的影响。通过HbF基因启动子中的碱基交换来构建可导致HbF遗传持久性的自然变异,提高患者体内HbF的表达水平,有同时治疗镰状细胞病或β-地中海贫血的潜力,该药物目前正在进行一项针对β-地中海贫血的Ⅰ/Ⅱ期临床试验。
新芽基因:GEN7010
新芽基因拥有自主知识产权的碱基编辑器TAM BE的全球专利,该平台是基于活化B细胞中激活诱导的脱氨酶(AID)高活性变体为基础开发而成的胞嘧啶脱氨酶,在sgRNA的引导下,TAM BE能在特定位点实现C>T, G>A的转换。并且平台可以通过将拼接位点保守的G转换为A,破坏拼接位点,从而实现RNA不同的拼接体形成,以用于多种拼接相关的疾病的治疗。基于该技术平台,新芽基因研发了针对β地贫的基因疗法GEN7010,目前尚处于临床前研究阶段。
Graphite Bio公司的使用CRISPR-Cas9基因编辑技术研发了下一代基因编辑自体HSC疗法,基于UltraHDR平台,将CRISPR基因编辑从切割和破坏基因转变为DNA的定向精确修复。找到突变基因位点后,HiFi Cas9通过高精度DNA切割来去除突变DNA,并使用AAV6递送正确DNA模板进行修复。
GPH102是基于UltraHDR平台研发的基因替代方法,使用功能基因替换突变的β-珠蛋白基因,来恢复HbA的表达水平。但首款基于UltraHDR平台的候选产品(nula-cell,GPH101)在治疗镰状细胞病的Ⅰ/Ⅱ期临床试验中出现不良事件,公司自愿暂停了该临床试验,并搁置了 GPH102 的IND申报,目前GPH102还处在临床前阶段。
目前采用HDR技术设计基因治疗药物的企业很少,该技术面临着优化需求,但同时也是基因治疗的一大终极发展方向。
β-地中海贫血作为遗传性血红蛋白病的代表,其清晰的致病机制和治疗思路使其成为基因治疗领域的热门赛道。随着技术的创新与迭代,基因治疗手段不断更新,从慢病毒载体到CRISPR-Cas9基因编辑,再到基于CRISPR的HDR,治疗的安全性和持久获益逐渐提升。然而,每种技术都存在一定的风险,需要不断尝试和改进。未来,我们期待更多的技术突破,为基因治疗带来安全高效的落地路径,真正释放基因疗法的无限潜力。
相关阅读
【新闻速递】谱新生物祝贺深圳市禾沐基因生物技术有限责任公司HGI-001注射液项目获批IND!

【新闻速递】国内首个CAR-T商业化委托生产订单花落谱新生物

关于谱新
谱新生物,总部位于美丽的太湖之滨苏州市吴中区,拥有苏州总部(10000㎡GMP厂房和研发中心)、深圳和上海基地,初步形成全国布局的生产基地网络布局;美国北卡基地也在建设中,同步进行全球布局。搭建了细胞药物专用的核酸平台、悬浮无血清病毒生产平台、全封闭的细胞工艺开发平台和质控检测技术平台,打造了细胞药物从发现到产品交付的高速公路。平台已支持多个合作伙伴成功孵化了多款CAR-T、TCR-T、干细胞等药物。谱新生物致力于让更多项目更早更快地达到下一里程碑,把更多细胞药物推向市场,造福更多患者,让细胞药物谱写生命新篇章。

04-08
哈希高品质供水水质分析与检测技术论坛04-08
应用专家服务周丨福建站04-08
相约厦门丨2024年度华东地区(电子)显微学学术交流会04-08
限时优惠 | 警惕"两虫"危害!守护饮用水安全04-07
喜讯 | 广电计量成为亚马逊SPN服务商 助力跨境企业出海!04-07
走进实验室 | 3分钟,带您了解测绘计量!04-07
走进实验室 | 天津广电计量服务能力介绍,看完就知道!04-07
聚焦新材料,新材料(磁性材料)分析测试解决方案技术研讨会暨“全国分析测试技术联盟”成立会议圆满落幕04-07
新锐产品 │ 海光原子吸收E50荣获“仪器设备新锐产品”殊荣04-07
2024青岛分析测试学会盛会即将开幕04-07
致力创新 │ 海光荣获“北京市企业技术中心”称号04-07
海光邀您参加第二十五届全国光谱仪器学术研讨会04-07
原子荧光光度计培训班欢迎您参加!04-07
德国斯派克常州用户交流会期待您的莅临04-07 市场部
会议回放|screenIT™ - 以 CRYSTAL POWDERDOSE 简化催化筛选04-06 力扬 NIKYANG
千里莺啼绿映红,巢湖观鸟公益行04-04 WAYEAL皖仪
科技驱动 中国智造 | 皖仪科技即将远航,亮相慕尼黑Analytica 2024国际舞台04-04 WAYEAL皖仪
清明 | 护净水清泉,润世间万物04-04
气清景明 万物赋新04-04
