Bigfoot高光系列应用之——小鼠28色免疫分型及高维分选方案
2023-10-09 14:13:59, 赛默飞生命科学 赛默飞世尔科技生命科学产品
全光谱流式细胞术是近年来发展起来的一种新型流式检测技术,因其能够解析光谱特征高度相似的不同染料而备受瞩目。通过全波长光谱解析,可以大大扩展流式实验方案的分析维度,从而可以发现传统流式检测不出来的稀有细胞和自发荧光很强的细胞亚群。
通过以下实验我们详细阐述了利用Bigfoot全光谱流式分选仪检测不同组织样本中28色小鼠免疫分型的流式结果,以及用Attune NxT流式细胞仪评估六路分选后不同细胞亚群的分选效率、纯度和回收率。
28色小鼠免疫分型方案——
高参数流式分析的重要性
免疫分型方案是利用流式细胞术鉴定、表征和区分样本中不同种类免疫细胞亚群的实验方法,主要是通过荧光标记的抗体来检测细胞表面或细胞内表达的抗原水平来实现。过去受传统流式细胞仪检测通道数量的限制,一次实验检测的抗原指标有限,不仅浪费试剂、样本和上机时间,而且还不能检测共表达的细胞亚群。例如,小鼠Ly6G是单核/巨噬细胞和粒细胞的常规检测指标,但某些T细胞也有表达,因此当淋巴细胞和髓系细胞分开检测时,通常不会研究表达Ly6G的CD4和CD8 T细胞,从而限制了对免疫功能评价的全面了解。然而利用Bigfoot全光谱流式细胞分选仪和经过优化的小鼠28色免疫分型方案可以全面、高效地分析和分选样本中的不同免疫细胞亚群。

材料和方法
01
样本制备
分别取无特定病原体(SPF)的BALB/c小鼠的脾、淋巴结、股骨和胫骨组织,用完全培养基[含GlutaMAX™ 添加物 (货号: A41923-01)的Gibco™ BenchStable™ RPMI 1640培养基; 5% Gibco™ 热灭活的胎牛血清 (货号: A5209501); 50 单位/mL Gibco™青链霉素 (货号: 15070-063)]冲洗股骨和胫骨获取骨髓样本,并用70um细胞筛网进行过滤。脾和淋巴结经研磨后分别用上述完全培养基制备单细胞悬液,并用70um细胞筛网进行过滤待用。
脾细胞和骨髓样本用Invitrogen™ eBioscience™ 10X 红细胞裂解液 (货号: 00-4300-54)裂解红细胞,之后用含100 μg/mL DNase I (Millipore-Sigma, 货号: 11284932001)的完全培养基进行洗涤,用Invitrogen™ Countess™ 3 FL自动细胞计数仪 (货号: A49893)进行细胞计数,并调整细胞浓度为1 x 10⁷ 个/mL。
02
样本染色
上述细胞先用Invitrogen™ eBioscience™ Staining Buffer (货号: 00-4222-26)和小鼠Fc Block™ (BD, 货号: 553142) 孵育5分钟后,用含5 μL/test的Invitrogen™ CellBlox™ Blocking Buffer (货号: B001T03F01) 和5 μL/test 的Invitrogen™ eBioscience™ Super Bright Complete Staining Buffer (货号: SB-4401-42)的流式抗体(表2)4°C避光孵育20分钟进行抗体染色;之后用Invitrogen™ LIVE/DEAD™ Fixable Olive Viability Kit (货号: L34978) 4°C避光孵育20分钟进行死活细胞染色;最后用2% 甲醛 (BioLegend, 货号: 420801) 室温避光固定30分钟。

设门策略
在SSC-A/SSC-H点图中圈出单个细胞群
在FSC-A/SSC-A点图中去除细胞碎片
利用LIVE/DEAD Fixable Olive死活染料去除死细胞
通过指标TER-119⁺去除红细胞,并圈出CD45⁺细胞进行进一步分析
中性粒细胞共表达Ly6G 和 Ly6C
进一步分析Ly6G⁻细胞中Siglec-H和Ly6C的表达情况
实验结果

图1. 利用28色免疫分型方案鉴定和分选小鼠脾细胞的设门策略。蓝色代表顺序逻辑设门关系;绿色代表分析出的各种细胞亚群;橙色代表分选出的各种细胞亚群。

图2. 脾细胞样本中各细胞亚群鉴定和分选的流式结果。

图3. 骨髓和脾细胞中各个B细胞亚群表达情况的比较。
分选后评估
01
分选效率
分选效率是指分选仪报告的细胞数占样本中所有目的细胞的百分比。用分选的6种细胞亚群分别重复3次实验,每次分选的样本和细胞数不同,但样本中目的细胞亚群的阳性率是一致的 (MZB 细胞 = 1.5%, CD8+ naive T 细胞 = 2.5%, NK 细胞 = 2.7%, Treg 细胞 = 3.4%, T1B 细胞 = 1.9%, and DCs = 0.38%)。
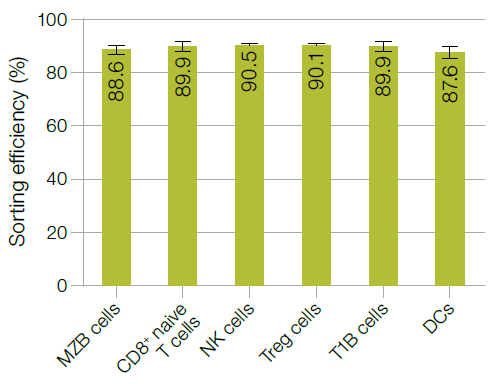
图4. 分选效率评估结果。
02
回收率
回收率是指分选出的目的细胞占分选前样本中所有目的细胞的百分比。

图5. 分选回收率评估结果。
03纯度
纯度是指分选样本中的目的细胞占所有细胞的百分比。
图6. 分选纯度评估结果。小鼠脾细胞中分选出的不同细胞亚群的纯度结果,分选前后的设门策略没有进行调整。
结论
Bigfoot全光谱流式细胞分选仪可以高维解析光谱特征相近的荧光染料,因此可以大大扩展流式多色方案,从而获得更多样本信息。通过以上28色小鼠免疫分型方案可以鉴定出20多种不同的细胞亚群,并且通过六路分选高效地分选出不同组织样本中的稀有细胞。
以下为不同小鼠细胞亚群的分型方案(上下滑动查看更多):
参考文献(上下滑动查看更多):
1. Andrä I, Ulrich H, Dürr S et al. (2020) An evaluation of T-cell functionality after flow cytometry sorting revealed p38 MAPK activation. Cytometry 97:171–183.
2. Richardson GM, Lannigan J, Macara IG (2015) Does FACS perturb gene expression? Cytometry A 87:166–175.
3. Box A, DeLay M, Tighe S et al. (2020) Evaluating the effects of cell sorting on gene expression. J Biomol Tech 31:100–111.
4. Beliakova-Bethell N, Massanella M, White C et al. (2014) The effect of cell subset isolation method on gene expression in leukocytes. Cytometry A 85:94–104.
5. Cochran M, Bergeron A, Box A et al. (2015) Evaluating the effects of cell sorting on gene expression. Paper presented at the Association of Biomolecular Resource Facilities conference, Salt Lake City, Utah, USA 2015.
6. Thermo Fisher Scientific. Bigfoot Cell Sorter: factors affecting efficiency, purity, and recovery. White paper on thermofisher.com
下面简单介绍一下本实验用到的
流式细胞仪、抗体试剂以及赛家流式培训课程
👇🏻👇🏻👇🏻
Bigfoot全光谱超高速流式细胞分选仪
——高效、准确、安全、灵活

Bigfoot是全球第一台全光谱、超高速、高性能的流式细胞分选仪,具有强大的光谱解析和分选能力,是免疫学研究和生物医药开发领域的强有力工具。
其主要技术优势如下:
配置高达9激光60参数
实时全光谱拆分及传统补偿调节模式可供选择
超高的分析和分选速度
强大的分选性能及灵活的分选模式
整合式II级生物安全柜及气溶胶管理系统
智能型全自动仪器校准及质控
流式抗体及试剂
eBioscience是全球三大知名流式抗体品牌之一,陪伴着每一代流式科学家和技术人员获得成功、共同成长!以FoxP3流式抗体为代表的产品深受广大科研人员的喜爱,全新推出的Brilliant Violet、Brilliant Ultra Violet和NovaFluor新型光谱染料标记的抗体每月上新,欢迎关注!
以梦为马,享学启程
Dr.赛精心准备的流式系列线上课程是帮助大家成为流式达人的宝藏资源,利用碎片时间,享学启程吧!

Bigfoot高光系列应用之——全光谱高维分选小鼠干祖细胞
流式细胞术和成像技术对单细胞分选后细胞活力、增殖和功能的研究
带自动图像分析功能的流式细胞仪上新啦!
06-27
大盘取厚势 落子开新局:战略聚焦开启品牌发展新篇章——访Veralto大中华区总裁秦晓培06-27 星羽
实验操作 | 质粒构建、转化、提取、鉴定、转染、测定(完整版)06-27 小 M
有投必奖 | 大家都用 MCE 产品做了啥? (感染领域)06-27 小 M
科研助攻 | 一文讲清:如何破解 PPI 靶点成药难题06-27 小 M
干货分享 | 谈谈天然产物的改构策略06-27 小 M
玉研口鼻暴露系统 | 精准、可控、高通量的动物肺部疾病造模工具,助力创新药物研发06-26 玉研仪器
医药行业指南:电位滴定仪选型攻略来啦~06-26
屹路同行 悦启新程06-26 屹尧科技
徕卡精准空间生物学解决方案 第四弹06-26 童昕、南希
【直播预告】第一届大湾区生物电镜制样讲习班06-26 徕卡显微系统
徕卡常规显微镜历经严苛的ISO9022标准测试06-26 徕卡显微系统
Viventis LS2 Live 光片显微镜发布会06-26 徕卡显微系统
前沿应用 | 经皮无创血糖检测中葡萄糖拉曼峰直接观测06-26 鉴知技术
SNEC光伏展圆满落幕 | OTT HydroMet闪耀时刻精彩回顾06-26 OTT HydroMet
激光指向稳定在光刻系统应用中的关键作用,及其优化方案!06-26 圈内人都会关注
推陈出新!通微公司携新品亮相本届CPHI06-26 Unimicro
远离氟污染!开启无氟接触前处理技术新篇章06-26
浑然一体的ChemiSEM技术:集成式扫描电镜成像与 X 射线能谱解决方案06-26
荧光计 VS 分光光度计,倒底怎么选?06-25