NK细胞疗法生产工艺探索
2023-05-19 16:43:15, Cytiva 颇尔(中国)有限公司

NK 细胞是先天免疫系统的一部分,可在无抗体和 MHC 情况下,识别并杀伤肿瘤细胞。因 NK 细胞疗法有助于移植物抗肿瘤反应(GvT),但不引发移植物抗宿主病(GvHD)的特点,受到越来越多的关注。据统计,全球 NK 相关的细胞疗法临床试验数量达 283 个(图 1)。

图 1. 细胞疗法临床试验概览(数据来源Nature Reviews Drug Discovery,截至2022/4/15)
NK 细胞来源主要有:外周血;骨髓或脐带血;多能诱导干细胞(iPS)诱导分化;癌细胞系,如 NK92,NKG,NKL 等。在外周血单个核细胞中 NK 细胞约占 5 %-20 %。经表型 CD3-/CD56+ 定义。因外周血中 NK 细胞数量有限,如何有效分离并扩增至足够治疗剂量成为 NK 疗法的主要技术瓶颈。
本次研究中 Cytiva 开发了一套符合 cGMP 的 NK 细胞制备流程,单次平均可获得大于 109 个 NK 细胞。经体外培养,NK 细胞纯度>97%,且经无异源扩增培养后,NK 细胞被有效激活。以下为该临床级别 NK 细胞制备流程的具体描述。
NK 细胞分离
利用全封闭,半自动化的 Sepax C-pro 的 BeadWash 程序,搭配磁力分选系统,自单采血中依次分离表型为 CD3-与 CD56+的细胞。
具体操作
利用 Sepax C-pro 的 BeadWash 程序,共孵育单采血样本与 CD3 磁珠。
输出袋穿刺连接(或无菌接管)至磁力分选系统耗材,利用磁力分选系统进行磁珠分选。
获得的 CD3-组分再次与 CD56 磁珠孵育后分选。以此得到 CD3-/CD56+表型的细胞。
经两步磁珠分选,NK 细胞的纯度从 4%-11% 提升至>90%(图 2A, B),回收率>98%(图 2C)。搭配 Sepax C-pro 的 BeadWash 程序,可将原本开放操作的磁珠孵育步骤,优化至封闭式半自动化设备运行。更高纯度的 NK 细胞有利于降低 GvHD,这一点在同种异体疗法中尤为重要。

图 2. 分离后 NK 细胞的纯度和回收率
NK 细胞培养
培养基
HyClone 商品化无异源培养基(1% P/S),NK 活化试剂盒,350 IU/mL Xuri IL-2。
预扩增
初步分离的 NK 细胞在细胞培养板或培养瓶中静置培养,保持 1×106 cells/mL,37℃,5% CO2 培养 6 天。6 天后,调整细胞浓度至 1.5×106 cells/mL 继续培养 2-4 天,直至细胞达到 2×106 cells/mL 至少 500 mL 后,将此时的细胞作为种子,接种至 Xuri W25 细胞扩增系统。
大量扩增
按照 Xuri W25 的操作规程,将预扩增的细胞种子接种至 Xuri 一次性细胞培养袋中,细胞浓度维持 2×106 cells/mL,逐渐添加新鲜培养基,直至总培养体积达到 1L 后,启动灌流培养。每日取样检测细胞密度和活性,灌流速度随细胞密度变化而调整,保证细胞始终有充分的营养环境,且乳酸代谢物水平保持在 25 mM 以下(图 3)。摇摆速度 6 rpm,角度 6 度。
总共 20 天的培养后,NK 细胞总数达到 2.6×109 至 7.4×109 cells(图 4A)。培养结束时,NK 细胞纯度>97%(图 4B,C)。表型分析 NK 细胞活化标志物 NKp44(NCR2)和 CD69,证明被激活的 NK 细胞比例从<5% 上升至>90%。

图 3. NK 细胞培养灌流策略
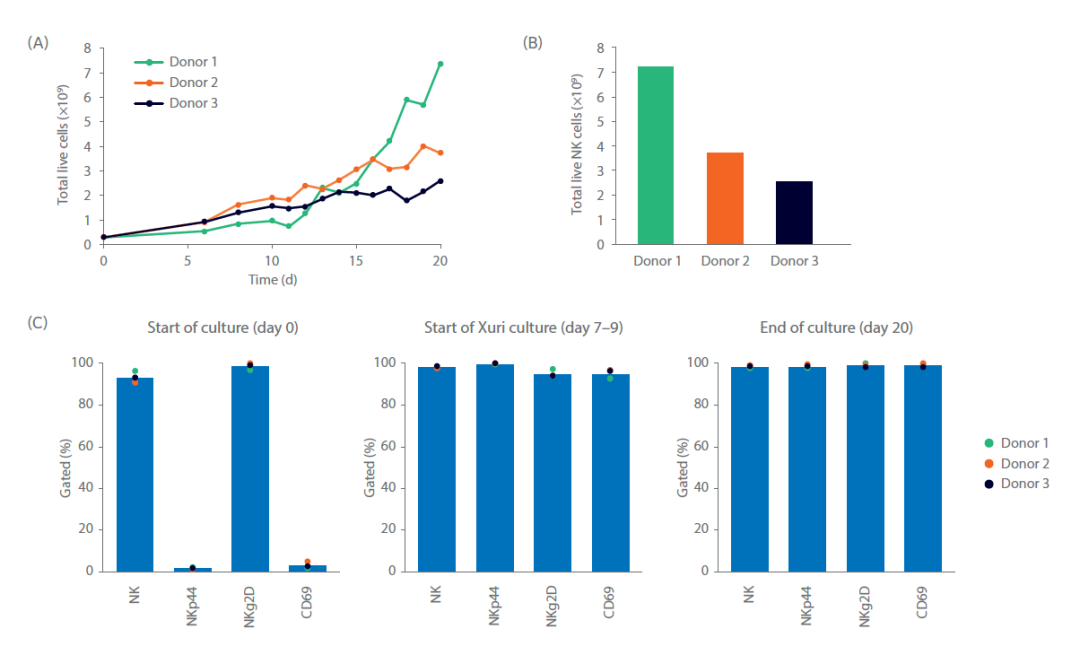
图 4. 细胞扩增培养及表型分析
NK 细胞收获
这里我们采用 Sefia S-2000 细胞处理系统,搭配 FlexCell 程序,洗涤回收 NK 细胞。
· 洗涤液:DPBS-/- ,添加 1 mM EDTA 和 2% 热灭活人 AB 血清。
·洗涤程序:2 次洗涤循环,每次离心 400×g,5 min。1L 细胞培养物经洗涤浓缩后,终体积收集 100 mL。
·重悬液:NK 基础培养基。
经洗涤浓缩,细胞的活率约下降 8.5%(图 5A),优化离心条件可改善对细胞活率的影响。表型分析可见,收获前和收获后,NK 表面标志物 NKg2D/NKp44 和 CD69 无明显变化(图 5B)。K562 杀伤试验证明,收获前后,NK 的杀伤能力无明显差别,体外杀伤率>70%(图 5D)。
图 5A,B. Sefia 回收前后,细胞回收率,活率及表型变化
图 5D. 杀伤试验
NK 细胞冻存和复苏
复苏后,使用 NC-200 设备做细胞计数,NK 细胞活率和回收率>70%,纯度>97%,且无 T 细胞残留(图 6A,B)。优化冻存复苏条件,可提高细胞活率和回收率。表型分析证明冻存和复苏对 NK 细胞表型无影响(图 6C)。
图 6. 冻存和复苏
与其他活化方法的对比
Feeder cell。使用 feeder cell 可达到很高的扩增倍数,然而这种方法很难 scale-up。同时 feeder cell 若未被很好的移除,会对病人带来风险。
细胞因子活化。目前,Xuri IL-2, IL-15, IL-21 符合 USP<1043>, 可用于细胞疗法的辅助材料。
这里,为了与上文提到的 NK 活化试剂盒+IL2 的活化方法对比,我们测试了细胞因子组合(350 IU/mL Xuri IL-2, 66.7IU/mL IL-15, 0.341 IU/mL IL-21)的活化能力和扩增效果。结果显示,NK 活化试剂盒 +IL2 的方法可能可获得更高的扩增倍数,但两种方法无明显的统计学差异(图 7)。

图 7. 不同活化方法间的对比
总 结
以上,Cytiva 的技术人员展示了一种符合 cGMP 合规要求的 NK 细胞产品的工业方案,在关键步骤中,使用封闭式、自动化设备进行分离、培养、收获制剂、冻存复苏等操作,得到的 NK 细胞数量达到临床需求,且纯度高于 97%,活化率大于 90%。
更多相关内容,欢迎登录Cytiva学堂观看课程 《细胞治疗全流程的工艺解决方案》
声明:本文为作者原创首发,严禁私自转发或抄袭,如需转载请联系并注明转载来源,否则将追究法律责任




中文官网
扫码关注
官方视频号
客服热线
06-27
大盘取厚势 落子开新局:战略聚焦开启品牌发展新篇章——访Veralto大中华区总裁秦晓培06-27 星羽
实验操作 | 质粒构建、转化、提取、鉴定、转染、测定(完整版)06-27 小 M
有投必奖 | 大家都用 MCE 产品做了啥? (感染领域)06-27 小 M
科研助攻 | 一文讲清:如何破解 PPI 靶点成药难题06-27 小 M
干货分享 | 谈谈天然产物的改构策略06-27 小 M
玉研口鼻暴露系统 | 精准、可控、高通量的动物肺部疾病造模工具,助力创新药物研发06-26 玉研仪器
医药行业指南:电位滴定仪选型攻略来啦~06-26
屹路同行 悦启新程06-26 屹尧科技
徕卡精准空间生物学解决方案 第四弹06-26 童昕、南希
【直播预告】第一届大湾区生物电镜制样讲习班06-26 徕卡显微系统
徕卡常规显微镜历经严苛的ISO9022标准测试06-26 徕卡显微系统
Viventis LS2 Live 光片显微镜发布会06-26 徕卡显微系统
前沿应用 | 经皮无创血糖检测中葡萄糖拉曼峰直接观测06-26 鉴知技术
SNEC光伏展圆满落幕 | OTT HydroMet闪耀时刻精彩回顾06-26 OTT HydroMet
激光指向稳定在光刻系统应用中的关键作用,及其优化方案!06-26 圈内人都会关注
推陈出新!通微公司携新品亮相本届CPHI06-26 Unimicro
远离氟污染!开启无氟接触前处理技术新篇章06-26
浑然一体的ChemiSEM技术:集成式扫描电镜成像与 X 射线能谱解决方案06-26
荧光计 VS 分光光度计,倒底怎么选?06-25