一看就懂!类器官入门级概述——培养分离篇
2022-12-19 20:41:01, 景辉 丹纳赫生命科学

概念及分类
随着生物学和医学研究的不断深入,传统的研究模型难以准确反映组织、器官在机体中的生理现象,新的研究模型系统随之出现。
类器官(Organoid)是来源于干细胞或器官组织的细胞,经过体外三维培养,可分化和自组织形成具有人体相应器官的部分特定功能和结构的细胞团。通俗来说,类器官就是干细胞通过体外3D培养形成的“类似”器官的生物结构。
由于类器官具有人源性,可以模拟器官发育和形成,在体外长期扩增中具有基因组稳定性,并能够形成活体生物库进行高通量筛选等优势,成为近年来备受关注的体外模型。

根据细胞来源不同,类器官可以分为:多能干细胞来源和组织来源。
(1) 多能干细胞来源:人类多能干细胞(Pluripotent stem cell,PSC)具有无限自我更新的能力,并且可以分化为几乎所有器官特异性的细胞类型。
多能干细胞衍生的类器官又可以包含了胚胎干细胞(Embryonic stem cell,ESC)和诱导多能干细胞(Induced pluripotent stem cell,iPSC)两类。其中,胚胎干细胞因涉及伦理问题使用受限。
(2) 组织来源:分为正常组织或肿瘤组织衍生的类器官。
正常组织来源:由成体干细胞(Adult stem cell,ASC)刺激分化形成类器官。通常来源于患者的活检组织,其分化能力十分有限,一般仅含有器官的上皮部分,缺乏基质、神经和血管系统。
肿瘤组织来源:指将患者活检、穿刺或手术切除组织在基质胶中培养数周得到的类器官。
研究历史及进展
起源
1907年,美国贝克罗莱那大学教授威尔逊(H. V. Wilson)发现通过机械分离的海绵细胞可以重新聚集并自组织成为新的具有正常功能的有机体,这项发现成为了未来类器官技术发展的起源。
干细胞技术
1998年,美国生物学家James Thomson首次分离得到人胚胎干细胞。飞速发展的干细胞技术为类器官研究带来了新的契机。
2009年,荷兰Hans Clevers研究团队证实了体外培养的肠道干细胞能够形成类器官。随后,越来越多科学家们利用多能干细胞和原代成体干细胞培育出多种类器官。

(图片来源:可画)
肿瘤类器官
2011年,Sato等人从结肠腺瘤、腺癌及巴雷特食管中建立肿瘤类器官模型,发现肿瘤类器官不仅能够实现和患者匹配,而且培养高效,有望为癌症患者在时间窗内提供诊疗方案。
自此,开启了肿瘤个性化诊断及治疗的新纪元。
2018年2月,《Science》报道了首个肠癌类器官药敏临床疗效观察试验,并获得了88%的阳性预测值和100%的阴性预测值的结果,首次证明患者来源的类器官可预测抗癌药物的有效性。
近几年,抗癌药物筛选、药物毒性分析、寻找潜在治疗靶点已经成为肿瘤类器官研究的热点领域。此外,随着肿瘤类器官培养技术的优化,已经建立起重建肿瘤微环境的方法,为研究肿瘤微环境与肿瘤细胞的互作提供了一个更成熟的模型。
肿瘤类器官的应用前景
类器官技术为肿瘤基础研究提供了许多新的实验模型,凭借其多功能性、强大的体内情况建模能力以及快速发展的应用,类器官技术有望在未来继续对基础癌症研究和临床癌症治疗产生重大影响。

(图片来源:可画)
研究发病机制
类器官模型最显著的优势是人源性和近生理性,肿瘤患者来源的类器官为研究复杂的、尚未阐明的风险基因位点和表型高度异质性的疾病机制提供可能。
药物筛选
在药物研究中,尤其是针对罕见病或缺乏大规模临床试验时,类器官能够为深度测序和功能测试、突变位点或表型分析提供足够资源,是药物毒性预测、新药筛选、个体化治疗的较好模型。
精准治疗
精准医疗的基本理念是整合个性化疾病信息,从而针对每个患者制定精准的诊断和治疗策略。对于癌症精准治疗而言,体外模型必须在生物学特性、基因突变谱上与体内肿瘤保持一致,而且能够维持高度异质性和基因型稳定性,如今肿瘤类器官的出现为癌症精准医疗创造了新的机遇。
肿瘤类器官的研究方法

(图片来源:可画)
1、 分离样本
操作步骤:
(1) 分离样本时注意区分正常组织和肿瘤组织,在提取肿瘤组织时,要尽量提取富含血管和含有上皮细胞的部位,去除坏死组织、脂肪以及肌肉组织。
(2) 分离后的肿瘤组织应留取部分进行冻存,可用于免疫组化切片和分子生物学实验(和培养后的肿瘤类器官进行对比鉴定)。
(3) 将肿瘤组织剪碎后进一步进行消化解离,可以参考对应的正常组织的消化液,一般由胶原酶、胰酶、DNA 酶和透明质酸构成;消化条件为37℃恒速水平摇床下消化,时间不超过1h,可在消化中途取上清液在镜下观察,如果出现3-10个的细胞团形成,则停止消化。
(4) 用100μm筛网对细胞悬液进行过滤,再用PBS清洗筛网,PBS离心洗涤细胞沉淀。
注意事项:
(1) 样本若不能及时处理,应放入对应的组织样本保存液中。最好用新鲜取材的样本做肿瘤类器官培养,成功率更高。
(2) 如果原位取材建系失败,可考虑取转移灶中的肿瘤组织,或者分选循环肿瘤细胞进行诱导培养。
2、 种板培养
操作步骤:
(1) 向细胞沉淀中加入适量基底膜提取物(Basement Membrane Extract,BME)。BME的用量取决于细胞数量,约1×10^4个细胞接种在50-60μL BME中。BME需要置于冰上,防止凝固。
(2) 将混合物接种于37℃预热的培养板上,放入37℃ CO2培养箱孵育30min,待胶体凝固后将培养板取出,加入37℃预热的培养基。
(3) 每天镜下观察类器官的形态、增殖速度、微生物污染等情况,培养2-3天后,根据类器官的生长形态更换培养基。
注意事项:
(1) 基底膜提取物(BME)是一种包含有细胞外基质(ECM)的基质胶,其中包含胶原蛋白、层粘连蛋白、巢蛋白和硫酸肝素蛋白聚糖等成分,为细胞粘附和细胞结构提供了底物。
(2) 细胞种板密度:肿瘤干细胞是肿瘤类器官形成的种子细胞,而肿瘤干细胞在消化后的肿瘤组织悬液中比例极低,这就要求我们种板的密度不能太低。但是太高的种板密度会导致由过多的其它肿瘤细胞凋亡引起的肿瘤类器官培养失败。所以,建议进行不同细胞密度梯度预实验来摸索最佳的种板密度。
(3) 肿瘤类器官培养基成分:诱导培养基是在基础培养基DMEM/F-12中添加各种因子,而这些因子组分是肿瘤类器官形成的关键。由于肿瘤组织存在基因突变的个体差异,所以我们需要自行摸索和查阅培养基中添加的各种组分因子,这些组分因子一般都会包含以下四类:
Wnt信号通路激活剂,主要促进血管生成:Wnt信号配体和GR5的配体Rspo-1等
酪氨酸受体激酶的配体,刺激上皮细胞增殖:EGF、FGF10、NGF等
TGF- β信号通路抑制剂,抑制上皮细胞分化:Noggin、A83-01
ROCK抑制剂,保持干细胞多能性:Y-27632
3、 传代消化
操作步骤:
(1) 弃去培养基后,加入预冷基质胶回收液吹打基质胶,将培养孔内的基质胶全部回收后离心,弃去胶回收液,加入Tryple消化液进行消化,一般消化10~15min,期间可在镜下观察,若类器官团块大部分解离为3~10个的细胞团时,则停止消化。
(2) 消化后细胞进行传代,此时的细胞含有大量的肿瘤干细胞,消化后的每个细胞小团块都可能会形成类器官,可根据之前收获类器官时培养孔内类器官的生长个数和大小综合考虑传代密度,一般以第一代的肿瘤类器官种板密度达到20-30%为宜。
注意事项:
如果需要做药敏实验,一般建议选择第一代或者第二代的肿瘤类器官进行,传代次数越多,发生基因突变的概率越高。
4、鉴定
参考Hans Clevers最早关于乳腺癌类器官的报道,我们可以通过以下层面对肿瘤类器官进行鉴定:
细胞水平:通过显微镜和H&E染色观察形态,鉴定类器官是否具备起源组织的组织病理学特征。
基因水平:通过基因组和转录组测序,分析类器官是否保持起源组织的遗传特征。
蛋白水平:可以用Western Blot、qPCR、免疫荧光、流式细胞术检测是否表达相应肿瘤标志物。
功能水平:检测类器官是否具有功能,例如检测胃类器官能否分泌胃酸、肿瘤类器官的药敏活性检测。
丹纳赫生命科学的解决方案
丹纳赫生命科学通过对旗下品牌的优势技术与产品进行整合,提供类器官研究从类器官制备到鉴定,以及后续延申的科研应用的丰富解决方案。
1
组织/细胞收集
制备类器官的培养基成分差异将造成细胞的发育与分化的差异。丹纳赫生命科学旗下贝克曼库尔特的Vi-CELL MetaFLEX高速细胞培养生化分析仪,能够快速鉴定培养基组分,具有35s快速检测、系统免维护等优点。


贝克曼库尔特Vi-CELL MetaFLEX
高速细胞培养生化分析仪
贝克曼库尔特的Avanti J-15R冷冻离心机采用UHT(Ultra Harmonic Technology)超平稳技术,离心速度稳定准确。同时,搭配加减速脉冲功能,缓慢增减速有效防止高速制动带来的细胞损伤。

贝克曼库尔特Avanti J-15R冷冻离心机
2
3D培养的换液与用药
贝克曼库尔特自动化工作站Biomek系列,用吸头移液方法实现自动化实验操作,是类器官自动化培养与换液的全能助手。可匹配后续核酸提取以及二代测序DNA/RNA建库流程,实现从细胞培养到分析应用的全自动化。

贝克曼库尔特Biomek i5实验室自动化工作站
对于有药筛实验需求的研究,可在Biomek自动化系统基础上搭配Echo 650移液工作站。利用Echo无接触、体积小的特点,将化合物转移到实验板里。

贝克曼库尔特Echo 650移液工作站
3
类器官检测与鉴定
类器官培养后一般需要进行质控的过程,最常见的手段是检测特异性的细胞表面抗原,从而确定是否发生了明显的细胞分化。另外,细胞凋亡情况、细胞活力也是常见的检测参数。贝克曼库尔特提供CytoFLEX系列流式细胞仪,具有操作简单、高灵敏度等特点。

贝克曼库尔特CytoFLEX系列流式细胞仪
使用一般的倒置显微镜较难清晰观察到类器官的多层组织结构,因此需要利用到共聚焦成像、3D成像等新技术手段。丹纳赫生命科学旗下徕卡显微系统的 M系列研究体视镜与荧光体视镜,可以直接多角度、多维度观察细胞的形态与结构。

徕卡M系列研究体视镜
此外,Leica还提供MICA多模态显像成像系统,满足不同检测精细度及应用目的需要,还可以直接培养并观察细胞。

Leica MICA多模态显像成像系统
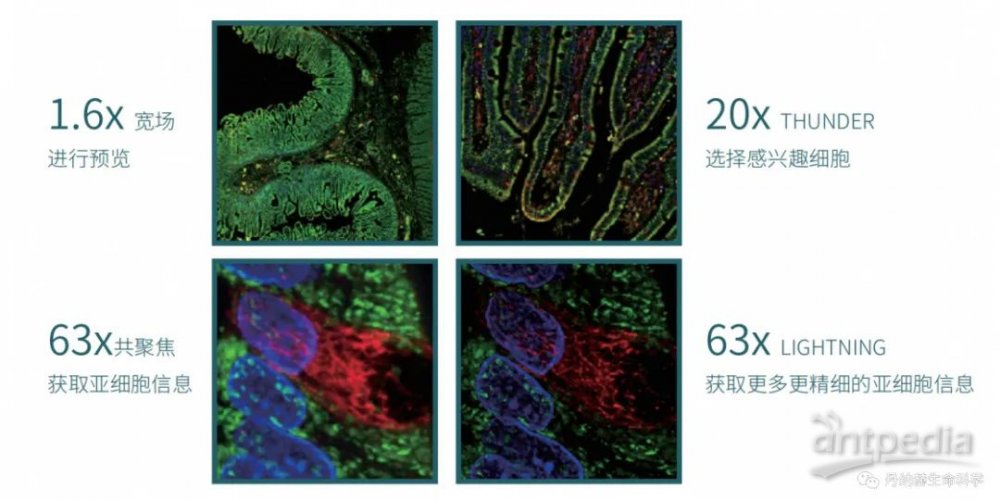
丹纳赫生命科学旗下美谷分子仪器的ImageXpress Confocal HT. ai智能型共聚焦高内涵成像与分析平台,在药效鉴定、药毒性筛查、科学研究中提供各种类型类器官模型高通量成像与3D分析。

MD ImageXpress Confocal HT.ai
智能型共聚焦高内涵成像与分析平台

参考资料:
俞东红, 曹华, 王心睿, 等. 类器官的研究进展及应用. 生物工程学报, 2021, 37(11): 3961-3974.
张秀梅, 翟运开, 赵 杰, 赵 萌. 类器官模型国内外数据库近10年文献研究热点分析[J]. 中国组织工程研究, 2021, 25(8): 1249-1255.
冯紫伊, 梁珊珊, 于炜婷, 王若雨. 患者来源肿瘤类器官的培养与研究及应用[J]. 中国组织工程研究, 2021, 25(25): 4082-4088.
Gao D, Vela I, Sboner A, et al. Organoid cultures derived from patients with advanced prostate cancer. Cell, 2014, 159(1): 176-187.
Kretzschmar K. Cancer research using organoid technology. J Mol Med (Berl). 2021 Apr;99(4):501-515.
Di Lullo E, Kriegstein AR. The use of brain organoids to investigate neural development and disease. Nat Rev Neurosci, 2017, 18(10): 573-584.
Fujii M, Sato T. Somatic cell-derived organoids as prototypes of human epithelial tissues and diseases. Nat Mater, 2021, 20(2): 156-169.
Driehuis E, Kretzschmar K, Clevers H. Establishment of patient-derived cancer organoids for drug-screening applications. Nat Protoc. 2020 Oct;15(10):3380-3409.

更多产品信息咨询,
请点击“阅读原文”,与我们联系。


04-18 德国元素
拒绝网络谣言,守护清朗园区04-18 国产精密仪器厂家
橙达仪器受邀参加中国化学会第十八届全国有机合成化学学术研讨会04-17 Orienda
以旧换新 │福禄克助力测试测量仪器提质焕新04-17 福禄克公司
直播邀约 | 2024新版新功率理论及标准详情解读04-17 福禄克公司
直播邀约 | 保障网络稳定安全,高标准机房都在这样做04-17 福禄克公司
福禄克计量校准部新品发布会—北京场04-17 福禄克公司
如何以科技助力高校发展?郑州这场会有答案04-17 市场部
英诺德德国慕尼黑首秀告捷,以创新点亮Smart Lab主题04-17 市场部
探讨水资源保护:薄膜微萃取法检测地表水中的农药04-17 英诺德INNOTEG
肿瘤防治宣传周——科学防治,精准检测04-17 赛默飞基因科学
展会回顾 | 2024 CBIFS 食品安全技术论坛04-17 Restek
精彩回放:CBIFS 食品安全技术论坛圆满落幕!04-17
STTT | 北京协和医院发现胰腺囊性肿瘤新型囊液糖蛋白标志物04-17
聚焦丨TRT-V8000隧道超前地质预报新品发布暨隧道检测技术交流会精彩回顾04-17 物探部
【聚焦激光】Ophir5款激光功率表头,您所期待的,这里都有!04-17
皖仪科技Analytica2024,闪耀慕尼黑,走出国际范儿!04-17 WAYEAL皖仪
质在精准,谱于“英”用 —— “专家云讲堂”临床质谱精准营养专题今晚开播!04-17
2024科学仪器开发者大会“真空技术论坛”会议通知(第一轮)04-17
GLMY创想仪器丨亮相河南铸锻年会 共促产业低碳创新发展04-17 国产精密仪器厂家