Neurostar全自动脑立体定位仪系统 |小动物脑科学研究的得力助手
2022-11-16 18:04:25, 玉研仪器 上海玉研科学仪器有限公司

据世界卫生组织的统计,包括各种神经类和精神类疾病在内的脑相关疾病,是所有疾病里社会负担最大的,占到了28%,超过了心血管疾病,也超过了癌症。其中,中国在脑卒中的发生率以及卒中引发的疾病负担方面,高居全球榜首。因此,深入对脑科学相关的研究以促进重大脑疾病的诊断和干预,是未来脑科技领域一项非常重要的内容。
在脑科学研究中,鼠脑和人脑的相似性极高。例如鼠和人脑内都有大量的5-羟色胺受体分布,5-羟色胺主要参与情绪调节、认知和冲动,并与多种精神疾病相关(比如情绪障碍、焦虑症和自闭症等);再比如自闭症模型鼠,可以出现和人类相似的社会行为,如强迫性咀嚼和交流障碍、自我理毛、反复筑巢、易怒等,这些情绪和行为的改变,能够很好拟合疾病特征,也有助于我们理解疾病发病机制。在类似大小鼠的小动物脑科学研究中,脑立体定位仪是必不可少的工具。
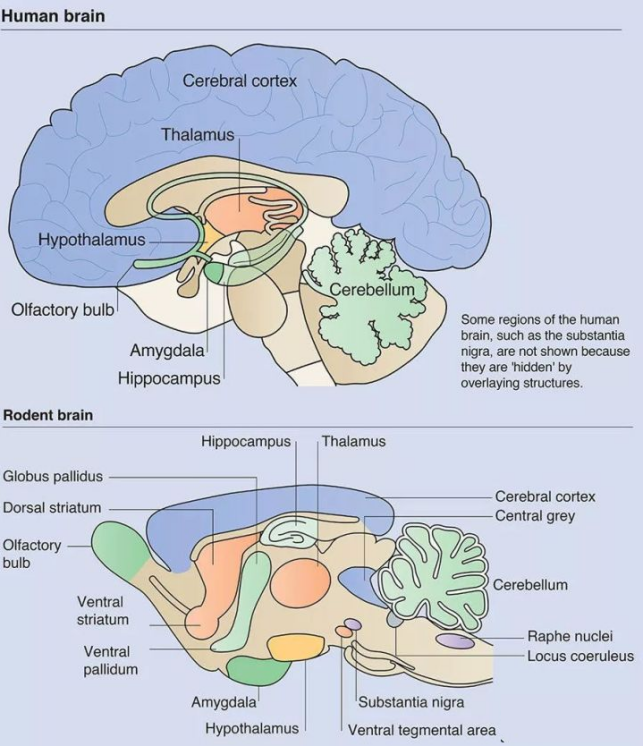
小动物脑立体定位仪分类
小动物脑立体定位仪按照结构及功能等通常可分为标准型脑立体定位仪、数显型脑立体定位仪和全自动脑立体定位仪。
其中,全自动脑立体定位仪具有自动化、高精度、高通量和高重复性等特点,不仅解放了实验者的双手,而且大大提高了实验效率,使操作更加精准,因而广受科研工作者的青睐。
| 类别 | 描述 | |
| 标准型定位仪 | 基础脑立体定位装置,激光雕刻工艺,游标卡尺式读数 | |
| 数显型定位仪 | 增加高精度位移传感器,实时显示三轴定位,精度高 | |
| 全自动定位仪 | 软件驱动,集成脑图谱,计算机控制,超高精确度 | |
NeuroStar公司是全球全自动脑立体定位仪的最大供应商,最新型全自动脑立体定位仪替代了传统的手动操作及简单的数字显示的方式,整个过程由软件控制,全自动完成。

全自动脑立体定位仪对于小动物脑立体定位来说,是一种可靠且多功能的设备,能够确保电极、微管以及其它设备在实验过程中的精确定位。
除此之外,NeuroStar还提供与全自动脑立体定位仪相配套的颅钻注射机器手、脑立体颅钻机器手、微量注射机器手、玻璃毛细管纳米注射器等全自动设备。
全自动脑立体定位仪——StereoDrive

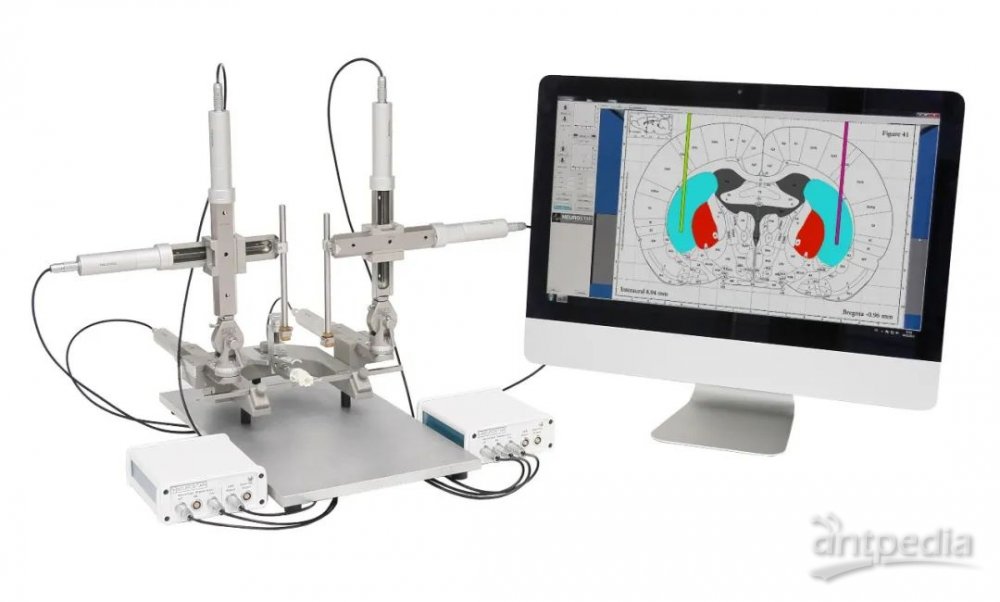

① 研究者不再需要专注于将框架坐标向脑图谱坐标的转换,通过观察脑图谱,让软件执行所有的计算操作;
②StereoDrive实现了前所未有的高精度定位,这是手动和数显型定位仪无法实现的;
③通过使用StereoDrive,探头的定位完全由计算机控制执行,从而避免了手控振动的产生。

√ 可选配不同动物适配器,如大鼠、小鼠、豚鼠等适配器
√ 马达驱动,移动平稳、精确、无噪音
√ 软件控制,软件中集成脑图谱
√ 操作臂三维 X、Y、Z方向最大行程:80mm
√ 操作臂移动精确度:0.001mm
√ 稳定性高,温度变化对精确度无影响
√ 特殊表面处理工艺,耐腐蚀,可长期保持良好的清洁度
√ 动物鼻夹采用曲线设计,固定更紧密牢靠
√ 可配套使用微量注射泵、颅钻、气体麻醉机

颅钻注射机器手-Drill&Injection Robot

颅钻注射机器手将颅骨钻孔和微量注射结合使用,实现在动物颅骨上自动钻孔后无需更换工具即可完成超高精度注射。装载注射器后,无需重新校准,就可以在动物脑部进行注射。脑图谱集成、立体定位框架和对准校正均由计算机直观控制,确保了操作程序的精确高效。

颅钻自动停止功能:该功能能够通过电测量检测颅骨穿透并立即停止运行,在不损伤脑组织的前提下实现颅骨钻孔。


√ 自动颅钻和微量注射互联模块
√ 包括全自动脑立体定位系统
√ 包括电动颅钻和微量注射模块
√ 全自动脑立体定位控制(包括控制软件)
√ 脑立体定位仪图谱
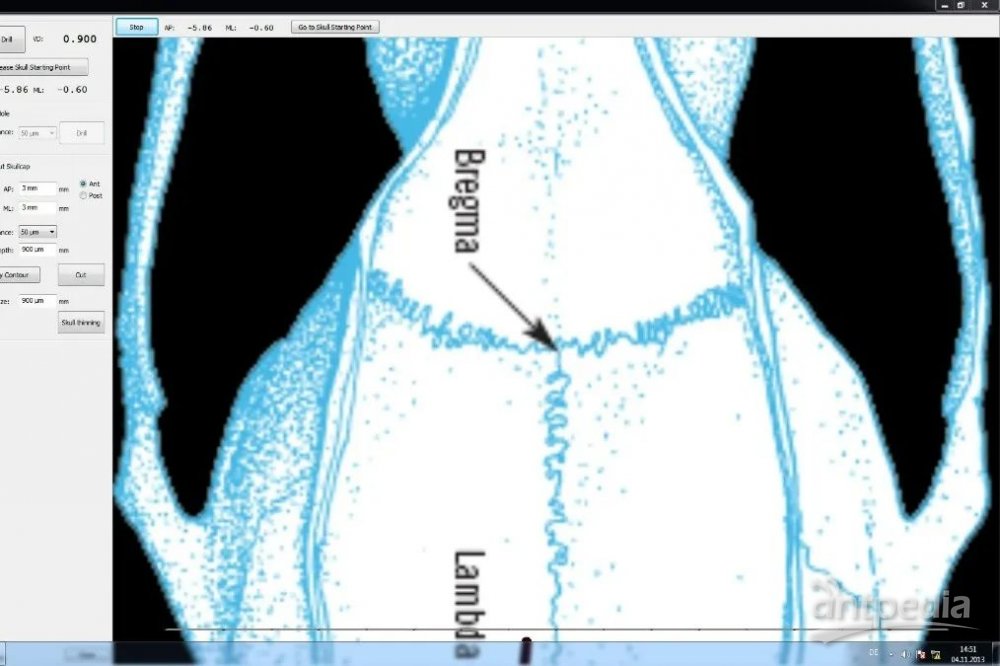
√ Lambda/Bregma归零, 倾斜误差校正功能
√ 单个脑图谱缩放,直观的运动控制功能
√ 不会伤及底层脑组织的自动颅钻程序设置功能
√ 高精度控制颅骨钻孔位置
√ 钻孔后无需更换工具
√ 使用Bregma相关坐标定位操作
√ 便捷的注射程序,用户自定义的注射速率
√ 基于脑图谱的注射器尖端和注射部位实时可视化功能
√ 兼容大多数商用注射器
√ 不含动物适配器、耳杆和探头支架
√ 兼容Windows 10系统

脑立体颅钻机器手-Stereotaxic Drill Robot

脑立体颅钻机器手完全由全自动脑立体定位系统驱动,钻头(50um以下)的推进步骤由计算机控制,避免了人为操作引起的偏差。该颅钻机器手可以为颅骨钻孔程序实现前所未有的精度,适用于注射或安置电极等需要事先钻孔的程序。



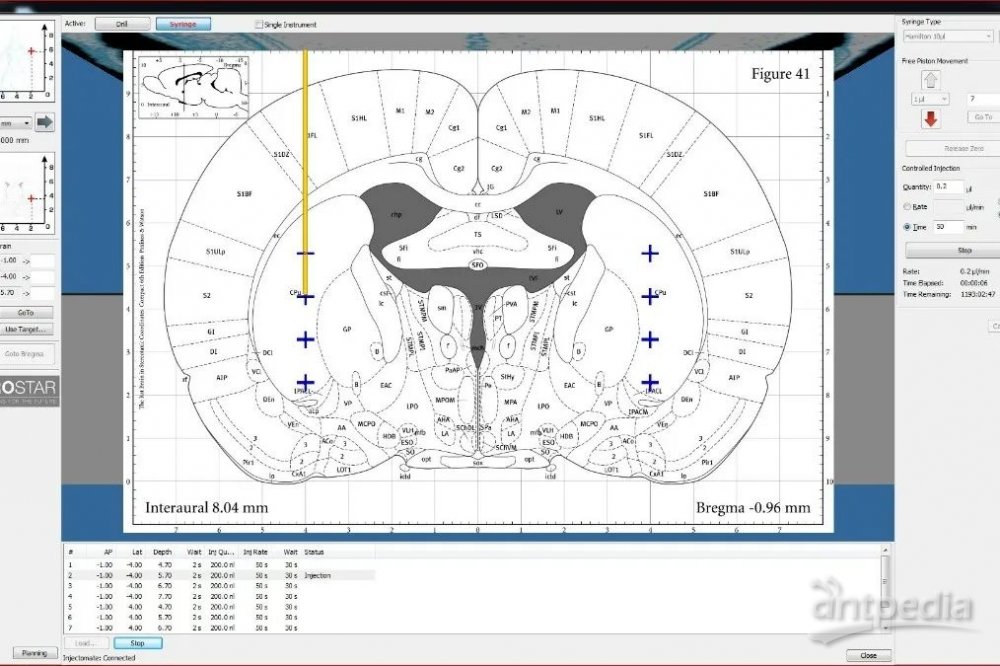
微量注射机器手-Microinjection Robot

微量注射机器手是唯一具有软件控制和脑图谱集成的超精密立体定向注射系统。只需定义目标和注射程序,机器手将执行整个注射过程,并可实现多部位的微量注射。这种完全由计算机控制的设置为实施准确、可重复和高通量的实验提供了可能。




玻璃毛细管纳米注射器
Glass Capillary Nanoinjector

玻璃毛细管纳米注射器(Glass Capillary Nanoinjector)专为执行精确的超精密纳米注射而设计。Nano使用硼硅酸盐毛细管,其尖端可拉至超薄,最大限度地减少对组织的伤害。



√ 玻璃毛细管超精密纳米注射
√ 计算机控制,界面直观
√ iPhone/iPad 控制(可选)
√ 用户自定义注射量,从1 nL开始
√ 用户自定义注射速率,从 2 nL/s 开始
√ 使用精密活塞直接推进
√ 可安装在显微操纵臂或脑立体定位仪上
√ 机器手模式,与全自动脑立体定位仪相结合实现多位点注射
√ 兼容Windows 10系统
智能前囟点探测器
Smart Bregma Finder

智能前囟点探测器为前囟点的定位提供了自动图像驱动功能,使实验人员能够多角度、全方位地实时观察探针位置以便精确定位。
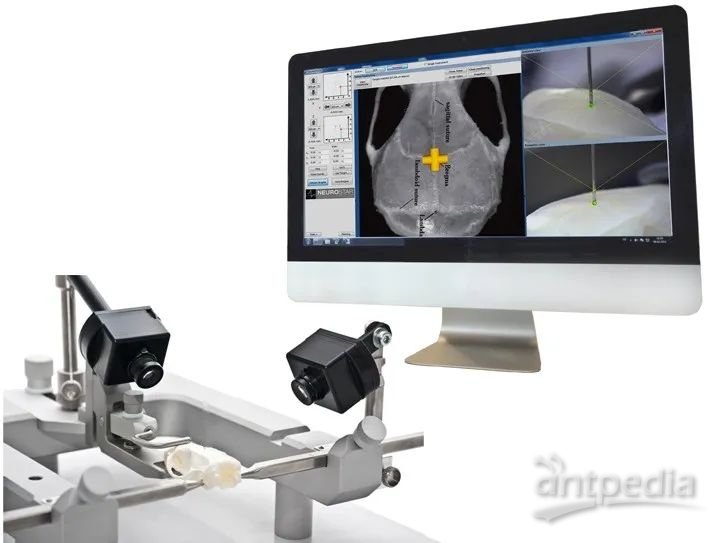
该智能前囟点探测器能够与任意一款Neurostar全自动脑立体定位仪结合使用(全自动脑立体定位仪、颅钻/注射机器手),增加了实验的简便性和灵活性。


√ 前囟探测
√ 图像驱动定位
√ 超高的精度
√ 实验监控
√ 避免人为失误
√ 视频流
√ 脑图谱集成
| 耳棒 | ||
| 传统大鼠耳棒 | ||
| 非穿刺大鼠耳棒 | ||
| 双侧大鼠耳棒 | ||
| 传统猫/猴耳棒 | ||
| 非穿刺猫/猴耳棒 | ||
| 双侧小鼠耳棒 |
| 适配器 | ||
| 小鼠适配器 | ||
| 小鼠和新生大鼠适配器 | ||
| 大型动物适配器 |
| 定向立体气体麻醉面罩 |
| 注射器 | ||
| Neurostar 提供专为神经科学应用设计的 Hamilton 注射器 | ||
| 该注射器尖端具有理想的长度以防止弯曲 | ||
Neurostar公司长期致力于开发和制造用于深部脑刺激 (DBS) 手术和超精密机动脑立体定向系统的仪器设备,在产品研发和更新迭代过程中,非常注重产品的质量和创新性,以最大努力满足广大脑科学科研工作者的实验需求。
参考文献
1. Albéri, L., Lintas, A., Kretz, R., Schwaller, B., & Villa, A. E. (2013). The calcium-binding protein parvalbumin modulates the firing 1 properties of the reticular thalamic nucleus bursting neurons. Journal of neurophysiology, 109(11), 2827-2841.
2. Sonati, T., Reimann, R. R., Falsig, J., Baral, P. K., O’Connor, T., Hornemann, S., Aguzzi, A. (2013). The toxicity of antiprion antibodies is mediated by the flexible tail of the prion protein. Nature, 501(7465), 102-106.
3. Ali, I., O’Brien, P., Kumar, G., Zheng, T., Jones, N. C., Pinault, D., O’Brien, T. J. (2013). Enduring Effects of Early Life Stress on Firing Patterns of Hippocampal and Thalamocortical Neurons in Rats: Implications for Limbic Epilepsy. PLOS ONE, 8(6), e66962.
4. Bell, L. A., Bell, K. A., & McQuiston, A. R. (2013). Synaptic Muscarinic Response Types in Hippocampal CA1 Interneurons Depend on Different Levels of Presynaptic Activity and Different Muscarinic Receptor Subtypes. Neuropharmacology.
5. Bolzoni, F., Bączyk, M., & Jankowska, E. (2013). Subcortical effects of transcranial direct current stimulation (tDCS) in the rat. The Journal of Physiology.
6. Bolzoni, F., Bączyk, M., & Jankowska, E. (2013). Subcortical effects of transcranial direct current stimulation (tDCS) in the rat. The Journal of Physiology.
7. Babaei, P., Tehrani, B. S., & Alizadeh, A. (2013). Effect of BDNF and adipose derived stem cells transplantation on cognitive deficit in Alzheimer model of rats. Journal of Behavioral and Brain Science, 3, 156-161.
8. Gilmartin, M. R., Miyawaki, H., Helmstetter, F. J., & Diba, K. (2013). Prefrontal Activity Links Nonoverlapping Events in Memory. The Journal of Neuroscience, 33(26), 10910-10914.
9. Feng, L., Sametsky, E. A., Gusev, A. G., & Uteshev, V. V. (2012). Responsiveness to nicotine of neurons of the caudal nucleus of the solitary tract correlates with the neuronal projection target. Journal of Neurophysiology, 108(7), 1884-1894.
10. Clarner, T., Diederichs, F., Berger, K., Denecke, B., Gan, L., Van der Valk, P., Kipp, M. (2012). Myelin debris regulates inflammatory responses in an experimental demyelination animal model and multiple sclerosis lesions. Glia, 60(10), 1468-1480.
11. Girardet, C., Bonnet, M. S., Jdir, R., Sadoud, M., Thirion, S., Tardivel, C., Troadec, J. D. (2011). Central inflammation and sickness-like behavior induced by the food contaminant deoxynivalenol: A PGE2-independent mechanism.Toxicological Sciences, 124(1), 179-191.
12. Hruška-Plocháň, M., Juhas, S., Juhasova, J., Galik, J., Miyanohara, A., Marsala, M., Motlik, J. (2010). A27 Expression of the human mutant huntingtin in minipig striatum induced formation of EM48+ inclusions in the neuronal nuclei, cytoplasm and processes. Journal of Neurology, Neurosurgery & Psychiatry, 81(Suppl 1), A9-A9.
13. Brooks, S., Jones, L., & Dunnett, S. B. (2010). A29 Frontostriatal pathology in the (C57BL/6J) YAC128 mouse uncovered by the operant delayed alternation task. Journal of Neurology, Neurosurgery & Psychiatry, 81(Suppl 1), A9-A10.
14. Yu, L., Metzger, S., Clemens, L. E., Ehrismann, J., Ott, T., Gu, X., Nguyen, H. P. (2010). A28 Accumulation and aggregation of human mutant huntingtin and neuron atrophy in BAC-HD transgenic rat. Journal of Neurology, Neurosurgery & Psychiatry, 81(Suppl 1), A9-A9.
15. Baxa, M., Juhas, S., Pavlok, A., Vodicka, P., Juhasova, J., Hruška-Plocháň, M., Motlik, J. (2010). A26 Transgenic miniature pig as an animal model for Huntington’s disease. Journal of Neurology, Neurosurgery & Psychiatry, 81(Suppl 1), A8-A9.
关于玉研
上海玉研科学仪器有限公司是专业为动物实验、动物研究领域提供科学仪器和技术服务的公司。我们着力引进国外的先进科学仪器和实践经验,选择使用广泛、应用成熟、性能先进的实验仪器和实验方法,为国内实验室建设、研究课题进展提供科学、合理的解决方案。
更多产品信息,欢迎来电咨询021-35183767!

扫码关注

04-23 飞飞
【报名火爆】2024单细胞蛋白质组学技术与产业应用研讨会线上直播通道发布!04-23
特洁安Aquafine助力河南电子半导体客户高品质生产,为“中国芯”提供有力保障04-23
Aliben动态 | 俄罗斯科学院院士Valery Tuchin教授到访艾立本科技参观交流04-23 艾立本科技
春启青莲礼,血浆免费试 | 高深度血浆蛋白质组限时免费测!04-23
德国元素TOC总有机碳分析仪线下用户培训邀请函(第一轮通知)04-23
最高91分,机会巨大!答题赛最后12小时,通道即将关闭!04-23 市场宣传部
【 Stage-RTL反射率测试】典型配置、硬件说明、软件操作04-23
从专家共识看吉比爱如何布局质谱自动化及应对临床质谱挑战04-22 华大吉比爱
精彩回顾|华大吉比爱质谱整体解决方案亮相第五届北京临床质谱论坛04-22 华大吉比爱
汪建:三十而立,要立得正、立得稳,走出一片新的光辉04-22 华大集团
尹烨:想成为对人类历史有伟大贡献的组织,就必须秉承痴心和使命04-22 华大集团
答题有礼|世界地球日,与哈希一起保护世界上最重要的资源04-22
世界地球日,哈希助力保护水资源04-22
【惊喜不断】前处理产品秒杀季,超低优惠!04-22 电商部
德国元素耗材之星 | 线状铜(还原铜)04-22
飞凡焕新,锂想质选 | 赛默飞亮相CIBF202404-22
重磅 | 赛默飞与高校分测分会再续合作新篇章,赋能本土科研创新与人才培养04-22
农业新质生产力从生物育种开始04-22 飞飞
飞凡焕新,锂想质选 | 赛默飞亮相CIBF202404-22