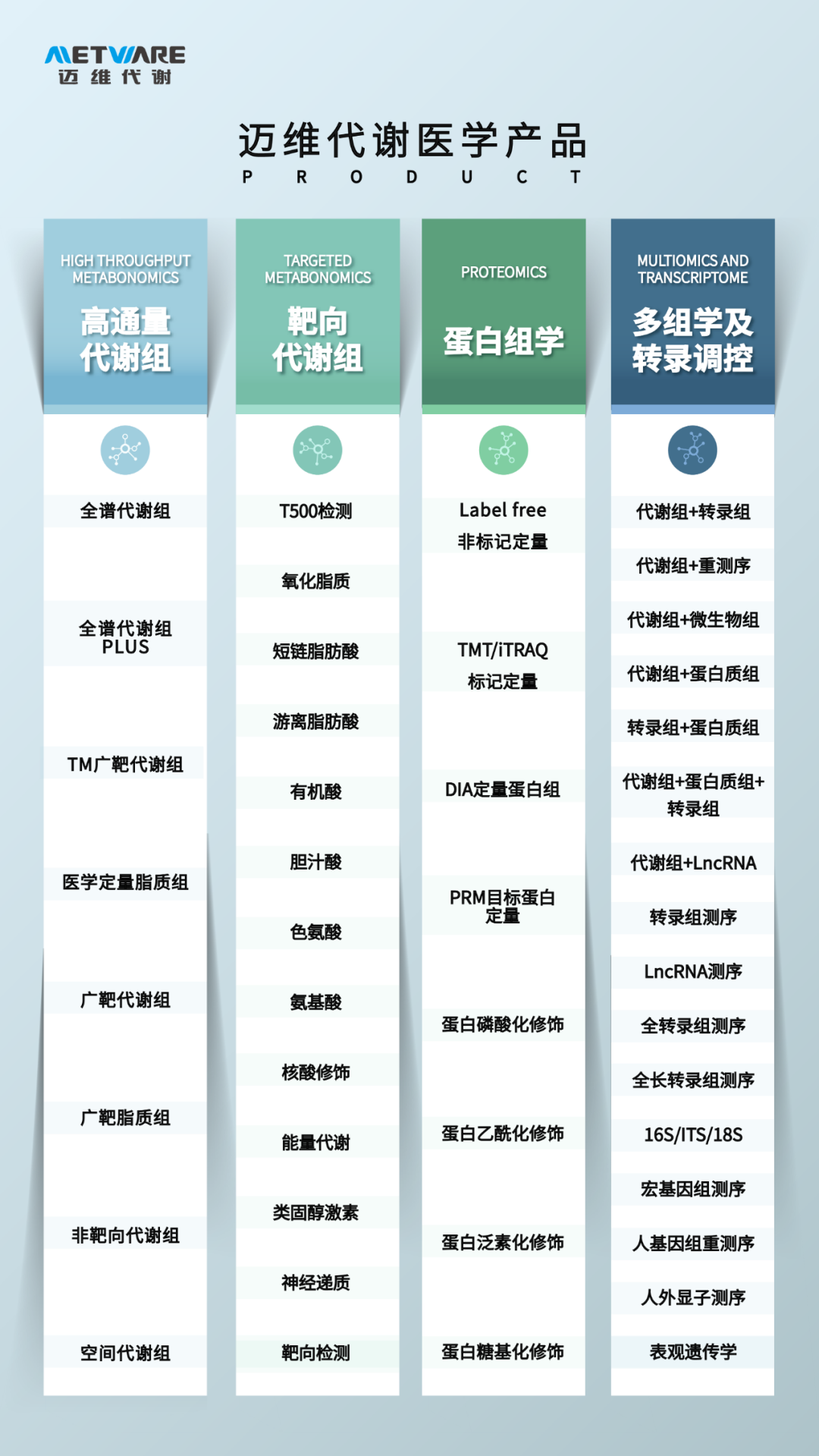
项目文章 | 能量代谢和全谱代谢组学助力新华医院皮肤科团队发现了一种新的疾病——CAOP综合征
2022-05-25 21:54:54, 小迈 武汉迈特维尔生物科技有限公司

●发表单位:上海交通大学医学院附属新华医院
●发表期刊:EMBO Molecular Medicine
●影响因子:12.137
●发表时间:2022.04.01
2022年4月,上海交通大学医学院附属新华医院姚志荣教授团队在国际著名学术期刊EMBO Molecular Medicine上发表题为“S1P defects cause a new entity of cataract, alopecia, oral mucosal disorder, and psoriasis-like syndrome”的文章,该研究历时10年,不仅发现了CAOP综合征的致病基因膜结合转录因子肽酶,位点1(MBTPS1),而且发现一种参与线粒体代谢的新分子S1P,通过线粒体电子转移黄素蛋白(ETF)调控线粒体代谢。陈付英、倪成、王晓晓、程茹虹、潘超兰为该文共同第一作者,上海新华医院皮肤科姚志荣教授和李明教授、复旦大学基础医学院张思教授为该论文的共同通讯作者。 迈维代谢为本文提供能量代谢和全谱代谢组检测分析服务。

在临床治疗中,发现一名14岁的中国男性患者(患者1)和一名5岁的西班牙裔女性患者(患者2),首次被诊断为白内障、脱发、口腔粘膜病和银屑病样(CAOP)综合征,其特征是早发性双眼晶状体白内障、全身性无瘢痕脱发、口腔黏膜疾病和严重的累及头皮、面部、腹股沟、臀部和下肢的银屑病样皮肤损害,严重影响了患者的生活质量。研究CAOP的发病原因和机制,将为该病寻找有效的治疗方案提供可能。
本文旨在研究CAOP综合征的病因,并尝试阐明这种新疾病的发病机制。



1.CAOP综合征个体的临床特征及变异
两例患者均表现为轻度毛囊性角化病、鱼鳞病、全面性脱发、畏光、牙龈红肿、银屑病样病变、甲沟炎和双眼白内障(图1A)。组织病理学检查也显示银屑病样血管炎(图1B)。进一步进行全外显子组测序(图EV1A)和Sanger测序(图1C),在中国患者的MBTPS1基因(NM_003791.4)中发现了由p.Val355Gly(c.1064T>G)和p.Ter1053Arg(c.3157T>C)组成的复合杂合体变异。测序分析表明,他的亲生父母都是MBTPS1基因变异的杂合子携带者,而他健康的兄弟两种变异都是阴性的(图1D)。同样,在患者2中发现了MBTPS1的复合杂合变异,其中包括与中国患者相同氨基酸位置的p.Ter1053Cys(c.3159A>T)和c.2072-2A>T(图1C-E)。
作者从公共数据库中筛选了1200个健康等位基因,并从内部数据中筛选了1500个额外的外显子,从而确认了在患者1和2中发现的变异是致病的。所有已识别的变异都没有出现在公共数据(1,000genomes,ClinVar,Ensemble,andgnomAD)和健康对照中。MBTPS1基因的p.Ter1053Arg(c.3157T>C)(患者1)和p.Ter1053Cys(c.3159A>T)(患者2)变异导致终止密码子破坏并产生比野生型S1P更长的蛋白质(EV1B),为了研究c.2072-2A>T变异的作用(患者2),进行了逆转录聚合酶链式反应研究。mini基因剪接产物表明,c.2072-2A>T变异体的存在部分取消了正常转录产物(648-bp带)的表达,导致跳过16号外显子(491-bp带)(图EV1C)。对这些聚合酶链式反应产物进行测序,发现存在两种不同的转录本。


■ ■ ■ ■ ■
图1:CAOP综合征患者携带MBTPS1变异和炎症性疾病

■ ■ ■ ■ ■
图EV1:CAOP综合征中MBTPS1(S1P)的变异
2.S1P缺乏导致线粒体形态异常和胆固醇代谢缺陷
通过超微结构分析,患者1皮损处线粒体数量明显增加(增加161.5%),线粒体形态通常(长度增加100.7%,长宽比下降10.3%)(图2A和C)。此外,线粒体板层脊结构紊乱,表明线粒体受到严重破坏(图2A)。然而,在患者1的皮肤病变中未发现明显的内质网异常(图EV2a,上图),这表明线粒体异常不是由全细胞疾病引起的。
已有研究表明S1P对于溶酶体的生物发生是必不可少的,并且在患者中也发现异常的溶酶体(图EV2A,下图)。在患者的皮肤损伤中观察到脂质沉积被证明为细胞质脂滴增加(图EV2A,下图)。相应地,我们还观察到在HaCaT细胞(一种永生化的人类角质形成细胞系)中MBTPS1基因敲除(MBTPS1-KO),胆固醇酯和甘油三酯显著增加,但与胆固醇和脂肪酸代谢有关的游离脂肪酸和二甘油没有显著变化(图EV2B)。
为了研究线粒体异常是否由S1P缺乏引起,作者构建了MBTPS1-cKO(皮肤特异敲除)小鼠,在出生后第一天的皮肤活检中发现了银屑病样血管周炎(图EV2C)、脂肪堆积(图EV2D)和线粒体异常(图2B和图2E),其中包括线粒体数量增加(增加180.0%)和形态异常(长度增加88.8%,长宽比减少14.9%)。此外,在MBTPS1-cKO小鼠中观察到线粒体在溶酶体中的包裹,这是线粒体自噬的一个重要标志(图EV2E)。


■ ■ ■ ■ ■
图EV1:S1P功能障碍损害线粒体转运,导致线粒体异常

■ ■ ■ ■ ■
图EV2:S1P功能障碍导致脂质代谢和溶酶体异常
3.S1P与ETFA和ETFB蛋白形成三聚体复合体
电子转移黄素蛋白(ETF)由ETFA和ETFB两个不同的亚基组成,是线粒体电子传递链中仅次于复合体I和复合体II的第三大电子供给者,ETF的功能是一个中枢,它从至少14个脱氢酶中获取电子,并将它们送入线粒体呼吸链,ETFA或ETFB基因突变会引起代谢紊乱,如多发性酰辅酶A脱氢酶缺乏症(MADD)。
核黄素缺乏会导致白内障、畏光、口炎、角化过度和发育迟缓,这些症状与我们在患者中观察到的症状类似,蛋白质-蛋白质相互作用网络表明ETF可能在S1P相关的线粒体信号转导中发挥核心作用,随后的Co-IP进一步证明了S1P与HaCaT细胞中ETFA/ETFB复合体之间的稳定关联(图3B,3C),然后通过谷胱甘肽-S转移酶(GST)下拉试验证实S1P与ETFA/ETFB之间的直接相互作用(图3D)。共聚焦免疫荧光进一步证明S1P与ETFA/ETFB共定位于HaCaT细胞(图3e)。基于蛋白质数据库中的X射线晶体结构,生成了计算三维复杂结构模型。这些氨基酸形成的“发夹”结构将FAD包裹在复合体中(图3F)。综上所述,这些结果表明S1P与ETFA/ETFB形成了三聚体络合物。



■ ■ ■ ■ ■
图3:S1P与电子转移黄素蛋白(ETF)A和ETFB蛋白形成三价络合物
4.MBTPS1的功能障碍损害影响ETF稳定性
患者1皮肤活检组织中ETFA和ETFB的蛋白水平降低(图4A和B),但ETFA和ETFB的mRNA表达没有显著变化(图4B)。在MBTPS1-KOHaCaT细胞(图EV4A和B)和MBTPS1-cKO小鼠(图4C和D,以及EV4C和D)中,ETFA和ETFB的蛋白水平也观察到类似的下降。
MBTPS1基因敲除不影响ETF的mRNA水平(图EV4E),但诱导HaCaT细胞ETF蛋白的快速降解,表明S1P可能维持ETF的蛋白质稳定性(图4E)。与野生型S1P相比,突变体S1P(p.Val355Gly和p.Ter1053Arg)与ETFA和ETFB的结合较少,这表明MBTPS1突变体失去了与ETF形成三聚体复合物的能力(图4F)。已有研究证明ETFA和ETFB之间的联系通过FAD介导的黄素化作用(在ETF形成复合体后将FAD辅助因子纳入ETF)来防止它们的降解并维持它们的稳定性,作者发现野生型S1P而不是突变体S1P(p.Val355Gly和p.Ter1053Arg)增加了ETFA与ETFB的结合,这表明S1P增强了ETF的构象稳定性(图4G)。在野生型S1P存在下,420和460nm峰显著增强(图4H)。综上所述,这些结果表明,野生型S1P而不是变异型S1P促进了ETFA/ETFB的结合和随后的ETF黄素化,从而维持了ETF的稳定性。



■ ■ ■ ■ ■
图4:S1P功能障碍损害ETF的黄化和稳定性
5.S1P的丢失损害了线粒体的呼吸,增加了糖酵解能力
氧消耗速率(OCR)的测量显示,与对照细胞相比,MBTPS1-KOHaCaT细胞的线粒体呼吸减少,基础呼吸减少38.3%,最大呼吸能力减少53.1%,OCR偶联ATP产生减少47.6%(图5A)。作者使用有针对性的靶向代谢组学来研究S1P如何影响能量代谢。S1P的丧失导致三羧酸(TCA)循环的两个碳源显著减少(乙酰-CoA减少到47.1%,L-谷氨酰胺减少到23.8%)(图5B,小组1-2)。观察到琥珀酸的浓度没有显著变化(图5B,图3),在三羧酸循环中观察到适度的代谢中间体积累,如琥珀酸辅酶A(147.8%)(图5B,图4)、柠檬酸盐(56.2%)、草酰乙酸酯(55.8%)和a-酮戊二酸(KG)(100.1%)。这些发现表明,S1P的丢失损害了线粒体呼吸和TCA循环活动。此外,还观察到在MBTPS1-KOHaCaT细胞中,糖酵解代谢产物,如丙酮酸(增加205.3%)、L-乳酸(增加41.7%)(图5B,图5-6)、D-果糖1,6-二磷酸(增加50.7%)、二羟丙酮磷酸(DHAP)(增加2160.4%)和磷酸烯醇式丙酮酸(增加578.3%)(附录S3B)。我们进一步测量了胞外酸化率(ECAR),它主要代表糖酵解到乳酸的通量。我们观察到MBTPS1-KOHaCaT细胞的ECAR与对照组相比增加(图5C)。此外,在MBTPS1-KOHaCaT细胞中观察到总ATP产量比对照细胞减少54.3%(图5D),这表明细胞总能量代谢受损。线粒体代谢的破坏破坏了细胞内线粒体的氧化还原动态平衡。作者还观察到MBTPS1-KOHaCaT细胞线粒体超氧化物歧化酶的产生增加了79.2%(图5e)。
综上所述,这些结果表明,S1P的功能异常造成了代谢转换,其特征是线粒体呼吸减少(例如,TCA循环活性和FAO活性),糖酵解增加,丙酮酸从为TCA循环提供燃料(较少转化为乙酰辅酶A)转向糖酵解(更多转化为乳酸)(如图5F所示)。


■ ■ ■ ■ ■
图5:S1P功能障碍损害细胞OXPHOS并增加糖酵解
6.核黄素治疗通过恢复ETF稳定性来挽救氧化磷酸化(OXPHOS)缺陷
由于MBTPS1变异体损害ETF的稳定性,作者尝试用核黄素治疗逆转MBTPS1功能异常引起的线粒体异常,治疗CAOP综合征。正如预期的那样,S1P缺乏引起的ETFA和ETFB的下降可被核黄素以浓度依赖的方式逆转(图6A),而线粒体呼吸和细胞ATP产量的下降可被核黄素恢复(图6B和C),此外,过表达ETFA/ETFB也能恢复S1P缺乏导致的线粒体呼吸和细胞ATP生成的下降(图6B和C)。
患者1从14岁开始口服核黄素,每天3.4-10毫克,他对这种治疗表现出良好的反应。患者开始治疗后随访3年,严重的炎性病变明显减轻,包括口腔炎、银屑病样病变、甲沟炎和唇炎,畏光和舌裂略有改善,指甲营养不良、脱发、毛囊角化或鱼鳞病样皮肤病变无变化(图6D)。这些数据强烈提示,MBTPS1变异诱导的ETF降解和线粒体异常可引起CAOP综合征的严重炎性损害。


■ ■ ■ ■ ■
图6:核黄素治疗通过恢复ETF的稳定性来挽救OXPHOS缺陷

(1)CAOP综合征是由线粒体膜结合转录因子多肽酶/位点1蛋白酶(MBTPS1,S1P)的常染色体隐性缺陷引起的;
(2)S1P可以作为一种新的线粒体蛋白,与ETFA和ETFB形成三聚体复合体,以增强ETF的黄素化,并保持其稳定性;
(3)患者S1P变异使ETFA/ETFB不稳定,损害线粒体呼吸,降低脂肪酸β-氧化活性,并将线粒体氧化磷酸化(OXPHOS)转变为糖酵解;
(4)补充核黄素可显著改善患者1的线粒体功能障碍和炎症损害,恢复ETFA/ETFB的稳定性。

本文采用了全谱代谢组+能量代谢的检测分析方法。
全谱代谢组,即采用广泛靶向专利技术,一次性针对样本中6500余种代谢物进行稳定检测,全面覆盖氨基酸、有机酸、核酸、碳水化合物、甾醇脂、脂肪酰、鞘脂、甘油脂、甘油磷脂、辅酶及维生素等多个类别,能够挖掘更丰富、更精准、更有效的代谢组学数据,助力科研新发现。
能量代谢又称为中心碳代谢(centralcarbonmetabolism,CCM),维持着生命体最基本的生命活动。能量代谢主要是葡萄糖的无氧酵解和有氧呼吸生成ATP产生能量的过程,也包括氨基酸、脂质等物质分解产生底物进入三羧酸循环参与代谢的过程。主要有糖酵解途径、三羧酸途径、磷酸戊糖途径和氨基酸转氨作用。
全谱代谢组技术特色:
1.全面覆盖不同性质代谢物,稳定检出1500+,相当普通非靶4倍数据量;
2.靶向人类疾病生理重要功能代谢物6000+,排除外源干扰;
3.广泛靶向创新专利技术,MRM定量黄金标准,提供稳定可靠数据;
4.1对1专业售前售后服务,从实验设计到数据解读,解决后顾之忧
能量代谢技术特点:
1.定性准确:每一种代谢物都经标准品开发,定性准确
2.高灵敏:采用超高灵敏度ABSCIEX 6500+质谱仪,检测下限低至pg级
03-28 麦特绘谱
绘谱学堂 | 4月10日15:00开讲《代谢组学助力心血管疾病研究》03-28 麦特绘谱
Cell Metab | 巨噬细胞的代谢支持维持结肠上皮细胞稳态03-28 麦特绘谱
非酒精性脂肪肝赛道大热!绘云生物走进精准医疗的“黄金时代”03-28 绘云生物
药物合成必杀技:玩转烯烃复分解反应【文末有福利】03-28 默克生命科学
成功讲座!默克与天津制药企业深入合作,助力行业布局03-28
焕新升级,科研赋能03-28 珀金埃尔默
解密生活饮用水中的铝含量:石墨炉原子吸收法的应用03-28 珀金埃尔默
实验室运营好帮手 | 珀金埃尔默租赁服务火热依旧03-28 珀金埃尔默
小“珀”图 | 一秒定输赢,揭秘F1赛车中的分析技术应用03-28 珀金埃尔默
复星、恒瑞、康方、科伦博泰……众多大咖齐聚2024中国医药创新100峰会03-28
是的,你的社区换新啦(点击有03-28
赋能新污染物标准升级,助力环保“新质生产力”提升03-28 飞飞
补铁要补三价铁还是二价铁?赛默飞带您细探究竟03-28 飞飞
重磅!首个毛发中滥用药物及其代谢物国标4月1日发布实施,55种!03-28 分析中心
新污染物检测特色分析技术——红外拉曼显微镜助力微塑料化学成像可视化分析03-28 创新中心
海外展会预告——莱伯泰科邀您相约慕尼黑国际分析生化博览会(analytica 2024)03-28
耗材专区 | EZscan,让热解析管的管理变简单!03-28
耗材专区 | EZsep™WAX固相萃取柱应用于肉制品中合成着色剂的检测03-28
特洁安TrojanUV Signa™助力夏威夷污水厂紫外线消毒升级03-28 特洁安