【前沿技术】生物样品基质中寡核苷酸治疗药物的前处理及LC/MS分析
2021-08-04 10:26:59, 艾杰尔飞诺美 艾杰尔-飞诺美(Agela & Phenomenex)
原作者:M.McGinley; J.Rudge; Kevin Zhao Phenomenex, Inc.
翻译:Kevin Zhao, Phenomenex Technical consultant
前言
基于跟生物分子的联系,以及其特化学性质,寡核苷酸药物分子在其生物基质中的前处理分离及液质分析存在着一定的挑战难度。全新混合模式固定相的固相萃取(SPE)填料对低浓度范围(ng/mL)的样品提供了高回收率及高灵敏度的样品前处理方法。优化液质方法的流动相,以及质谱的参数设定,能有效地提高寡核苷酸及其代谢物的相应值和检测灵敏度。
背景介绍:
科学家对研发寡核苷酸治疗药物所面临的一大挑战就是在样品前处理中化合物提取步骤和代谢产物的分析以及进行小分子化合物的药代动力学研究。RNA分子通常会与生物分子(如细胞、蛋白等)出现共同迁移,因此会让萃取的方法出现问题。一般情况下,我们比较常见的寡核苷酸萃取方法有使用液-液萃取(LLE)和反相固相萃取两种。这种方法的缺点通常萃取时间较长,对样品操作的过程中也可能导致寡核苷酸降解并且也会对后续的自动化萃取流程建立造成一定的局限性。样品萃取后,高极性/中性的RNA在不使用离子配对试剂的反相色谱柱中基本不可能保留,然而,离子对试剂的使用也会降低质谱的灵敏度。尽管如此,但是有某些离子对试剂如六氟异丙醇(HFIP)在作为改性剂添加到流动相时能有效地提高质谱的灵敏度,但需要优化系统设定而让灵敏度达到最大化。下述实验详细介绍了一些关于寡核苷酸样品萃取和分析的解决方案。此方案介绍了一种简单而快速的混合模式离子交换SPE萃取试剂盒套件。此外,对比原来的分析方法,通过提高使用离子对试剂的比例:如三乙胺(TEA)和HFIP,该方案能够有效地提高质谱的敏感度。
实验材料
本实验的所有化学品和试剂都是从Sigma Chemicals (St. Louis, MO, USA)购买,除非有特殊的说明。寡核苷酸样品是从两个不同公司分别购买(Integrated DNA Technologies, Coralville, IA, USA 或者 ISIS: Carlsbad, CA, USA; USC Oligonucleotide Laboratory, Los Angeles, CA, USA)HPLC溶剂是通过EMD (San Diego, CA, USA)购买。血清和血浆样品是通过Bioreclamation (Liverpool, NY, USA)购买。
实验方法
将寡核苷酸标准物添加到血清和血浆样品中以特显出方法的实用性。将同等分量的Phenomenex Clarity®OTX™上样缓冲液和血清/血浆样品混合在一起并上样到SPE小柱。SPE 萃取分离小柱(Clarity OTX 100 mg/3mL 小柱) 先用甲醇平衡,之后再用Clarity OTX配套的平衡缓冲液(10 mm磷酸盐缓冲液,pH 5.5)平衡小柱。上样之后,小柱先用平衡缓冲液冲洗两次,然后再用OTX洗涤缓冲液(10 mm磷酸盐缓冲液,pH 5.5/50%乙腈)清洗一遍。最后,寡核苷酸会被试剂盒的洗脱缓冲液(100mM碳酸氢铵,pH8.0/40%乙腈/10%四氢呋喃)洗脱下来。样本既可以冷冻干燥,也可以快速真空旋蒸干燥,用于LC分析的重新定溶。进行LC-UV分析,样品被注入到Agilent HP1100HPLC, 并使用Phenomenex Clarity 3μm Oligo-RP 或者Phenomenex Clarity 2.6μm Oligo-MS HPLC色谱柱(注明:Phenomenex 最新bioZen Oligo HPLC色谱柱可以实现完全替代及更优效果)。而使用LC/MS分析时, 会在Phenomenex公司实验室使用AB SCIEX API 3000 (进行检测或在Novatia公司实验室使用Novatia Olego HTCS高效液相色谱系统 (Monmouth Junction, NJ, USA) 连用LTQ®Orbitrap®质谱仪(Thermo,San Jose, CA, USA)进行分析。寡核苷酸离子谱已使用ProMass®软件(Novatia)重建。我们公司开发了一种梯度色谱分离方法,该方法使用水相流动相A: 8 mM三乙胺/200 mM六氟异丙醇pH 8.0; 有机流动相B: 乙腈。根据不同的情况,我们采用了不同的梯度方法,和使用不同的色谱柱或者检测仪器以及特定的寡核苷酸样品。
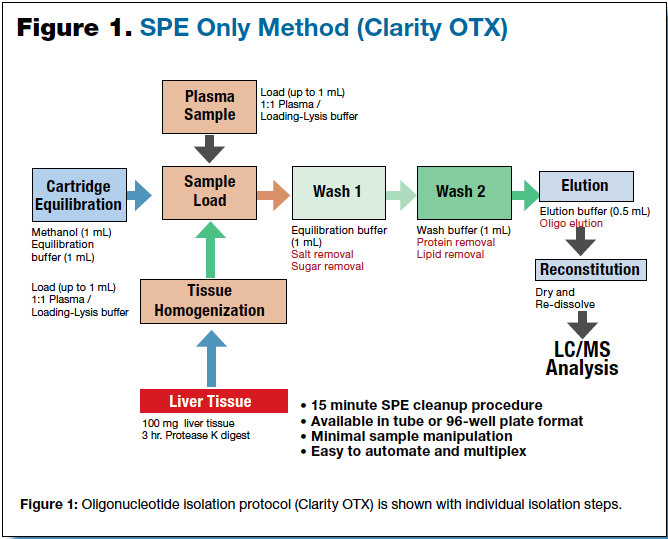




结果与讨论

寡核苷酸的萃取分离
一个基于混合模式SPE方法 (Clarity OTX)用于分离治疗生物基质中的寡核苷酸(图1)。含寡核苷酸的血清或血浆样品混合杂色/洗涤缓冲液(pH5.5左右)后上样到混合模式的SPE填料中。之后用低pH缓冲液清洗,实现了寡核苷酸在较高的pH(pH≈8)下中度有机溶剂的洗脱。严格控制pH值是这个萃取方法至关重要的关键;DNA持续暴露在pH 5以下会导致脱嘌呤和RNA暴露在pH 9以上可导致2‘-3’异构化核糖糖。通过一个色谱图(图2)的例子来展示萃取后的净化效果。此色谱图为添加了27聚体DNA的硫代磷酸寡核苷酸注入血浆样品,并使用Clarity OTX方案进行纯化与对照寡核苷酸进行LCMS的分析比较。几乎全部的寡核苷酸(97%)从少量的基质污染物中被回收并被分离出来,从色谱结果来看,寡核苷酸和其代谢物可以实现良好的分离。
另一个示例如图3中HPLC色谱图的分析,其中19mer 2’甲氧基乙基 (2’MoE) gapmer RNA/DNA的嵌合体从血浆中的回收率能大概达到76%(参考回收率的范围65%-99%),这是取决于寡核苷酸与其生物样品基质是如何被分离的以及如何进行线性的计算。为了更好地去理解一些影响样品回收率的因素,我们进行了更多的研究。快速旋转蒸发器通常用于浓缩HPLC分析进样前的寡核苷酸。常规的做法是完全把样品干燥后再重新用流动相定溶。但是,以下的结果显示绝对的干燥会影响寡核苷酸的回收率。图4的结果显示,蒸发至“完全干燥”的样品有明显的回收率损失,而相比起来“接近干燥”的样品相对有更好的回收率。根据这样的结果,低浓度寡核苷酸的萃取分离应该避免使用快速旋转蒸发的方法。选择冷冻氮吹干燥似乎是更有效更稳定的寡核苷酸样品定溶的方法而不会影响回收率。

寡核苷酸的LC/MS分析
我们通常使用离子对反相法对寡核苷酸进行LC/MS的分析,其中HFIP和TEA的混合离子对试剂被用来改性及保留高极性且带阴离子的寡核苷酸分子。在LC/MS应用中,离子对所提供的保留必须与其离子抑制相平衡而最大限度地提高MS的灵敏度。如图5所示,不同浓度的离子对缓冲液流动相会给寡核苷酸LC/MS分析带来不同的结果。最大限度地提高MS敏感度需要通过平衡离子抑制和保留能力而实现;较高浓度的离子对缓冲液的保留率更高而且对寡核苷酸的分离度也更好,但这仅限于特定的一个浓度范围。虽然优化流动相条件很重要,但是质谱参数的设定和数据采集会有更大的影响力。如图6所展示的是在血样中不同浓度的19mer硫代磷酸化后的RNA寡核苷酸通过使用Clarity OTX试剂盒萃取后使用Orbitrap MS在Olego HTCS的系统上分析。在50 ng/mL的样品浓度水平上的离子强度远远超过了远离这一应用检测极限。
结论
生物基质中的寡核苷酸及其代谢物的分析比起小分子化药的分析具有更大的挑战。本文从方法学上对市面上热点的对生物样品基质中寡核苷酸的ADME/药代动力学分析提供了不同的解决方案。使用混合模式SPE对生物样品中寡核苷酸的萃取分离更为快速而且复用性效果非常好,这种方法适合用于需要处理大量的样本临床试验。然而,在任何情况下萃取的方法建立都必须保证不会造成回收率的损失或大量消耗化学溶剂。在分析寡核苷酸药物时,萃取方法的重要性与LC/MS分析条件的建立同等重要。寡核苷酸分析时离子对流动相条件的优化和高效液相色谱柱的正确选择能有效地提高分离度和保留能力,同时也能减少离子抑制影响。
资料参照
1. G. Zhang, J. Lin, K Srinivasan, O. Kavetskaia, and J. Duncan. Journal of Analytical Chemistry 79(9) p3416-3424, 2007
2. Tanya A. Watanabe, Richard S. Geary, Arthur A. Levin. Oligonucleotides 16(2): p169-180, 2006
3. Antisense drug technology: principles, strategies, and applications. Edited by Stanley T. Crooke, CRC Press, p189-199, 2007
4. G. Scott, H. Gauss, B. Rivera, and M. McGinley. “Rapid Extraction of Oligonucleotides from Primary Tissues for LC/MS Analysis…” Poster Presentation from Tides 2009 Conference, Las Vegas, NV, May 17-20, 2009.
5. K. Speicher, O. Kolbas, S. Harper, and D. Speicher. Journal of Biomolecular Techniques 11:p74-86, 2000
6. A. Apffel, J. Chakel, S. Fisher, K. Lichtenwalter, W. Hancock. Analytical Chemistry 69 (7) p1320-1325, 1997
7. R. Griffey, M. Greig, and H. Gaus. Journal of Mass Spectrometry 32: p305-313, 1997
8. M.Gilar. Journal of Analytical Biochemistry 298 (2) p196-206, 2001
如您在实验过程中有任何技术疑问,欢迎联系艾杰尔-飞诺美技术支持团队,我们为您全天候提供免费的技术支持服务。全国免费服务热线:400-606-8099


04-15
塑料实验室光源暴露试验荧光紫外灯方法04-15
浙江万马高分子材料集团有限公司对我炭黑含量测试仪认可04-15
感谢安徽工程大学对我司同步热分析仪的认可04-15
聚碳酸酯PC再生塑料性状及性能要求04-15
奖品更多?名额增加?色谱能力验证大赛第二届来袭!04-15 市场宣传部
【展会预告】第25届中国环博会04-15 元析仪器
元析仪器 | 2024德国慕尼黑分析生化博览会圆满落幕04-15 METASH
为什么质粒的合规是CAR-T细胞药物合规的起点?04-15
【新品上市】Dynamica新品台式离心机V18R Plus重磅上市04-15 天美生化
兰友科技挂牌“专精特新”专板04-15
科学仪器第三方测试、可靠性工程与技术就绪度评估培训通知04-13
中国科学院昆明动物研究所党委书记施鹏带队赴华仪宁创考察交流04-13
化繁为简 | 维生素D检测“POCT”模式新体验04-12 Chromai IVD
【邀】 科诺美与您相约沈阳“药品质量控制与检验技术大会"04-12
山海之滨话食安 | 科诺美精彩亮相第十六届食品安全技术论坛04-12
会议预告|华大吉比爱邀您共聚第五届北京临床质谱论坛04-12
IFCC秘书长莅临华大吉比爱,共同探讨创新发展04-12
专家共识|中国儿童维生素A、维生素D临床应用专家共识(2024)04-12
会议预告|第十七届中国科学仪器发展年会04-12