张觉超徕卡显微系统一直追求聚焦于科技前沿,不断推出最先进的成像技术以丰富研究者们的“武器库”。针对免疫学研究中显微成像的难点,徕卡推出了《免疫学成像解决方案》,帮助用户们轻松完成多色荧光标记、活细胞观察、精细结构展示、大视野拼图等成像需求。今天我们就来盘点一下徕卡在多重标记荧光成像方面有哪些小妙招。 Immunology is the study of the body’s defense against infection.免疫学是研究机体防御外源感染的学科。——《Janeways Immunobiology》9e研究热点免疫学作为相对新兴的学科,其发展十分迅速。早期免疫学阶段(19世纪之前)和传统免疫学阶段(19世纪期间)集中于研究机体对外源病原体入侵的防御机制。现代免疫学将传统免疫学与分子生物学、生物化学、发育学、病理学等学科结合,关注于免疫系统发育、免疫细胞功能、免疫应答机制及病理条件下免疫系统调控异常的机制。近期,受到基金委青睐的重点项目多集中在肺部炎症与修复的发生发展机制、免疫细胞分化及应答机制、代谢疾病的免疫调控机制、衰老相关炎症机制、免疫调控异常与靶向干预和肿瘤免疫治疗等研究方向。 图1免疫学研究高频检索词汇云图2017-2019国家自然科学基金免疫学项目名称词云分析免疫学成像需求、挑战及解决方案
图1免疫学研究高频检索词汇云图2017-2019国家自然科学基金免疫学项目名称词云分析免疫学成像需求、挑战及解决方案 免疫细胞/组织多色荧光成像解决方案免疫系统的复杂性决定了免疫学研究中常常需要同时关注几种甚至几十种生物标志分子。荧光基团串色、光谱拆分假阳性、染料选择少等难题使成像技术在免疫学领域的应用总是受到限制。下面几款徕卡高端成像设备专精于多重标记荧光成像,能帮助您扫清免疫学多色成像的障碍。宽场荧光成像系统——THUNDER Imager
免疫细胞/组织多色荧光成像解决方案免疫系统的复杂性决定了免疫学研究中常常需要同时关注几种甚至几十种生物标志分子。荧光基团串色、光谱拆分假阳性、染料选择少等难题使成像技术在免疫学领域的应用总是受到限制。下面几款徕卡高端成像设备专精于多重标记荧光成像,能帮助您扫清免疫学多色成像的障碍。宽场荧光成像系统——THUNDER Imager 图2 DMi8 THUNDER倒置荧光成像系统
图2 DMi8 THUNDER倒置荧光成像系统
超分辨率共聚焦成像系统——STELLARIS 图3 STELLARIS 5激光共聚焦成像系统
图3 STELLARIS 5激光共聚焦成像系统
标配具备光子计数能力的高灵敏HyD检测器
检测范围扩展到410-850nm,染料选择更加灵活
选配白激光光源,最大440-790nm激发范围, 高效荧光激发,避免荧光串色
TauSense技术:从荧光寿命维度避免组织自发光干扰
选配FALCON(快速荧光寿命检测)技术,实现样本多组分精准拆分成像
超多标单细胞空间组学——Cell DIVE
图4 Cell DIVE成像仪
成像图片展示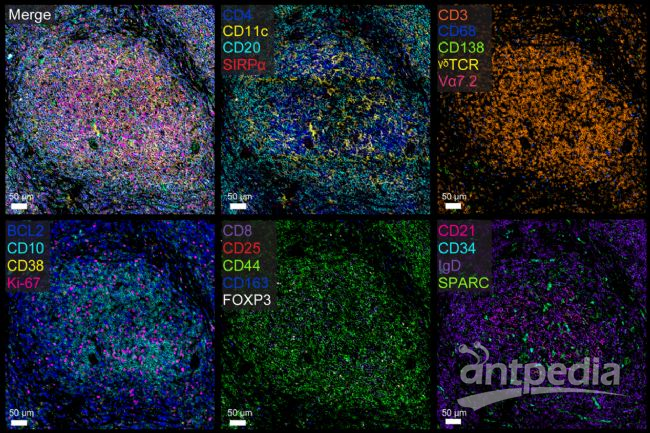 图5 淋巴瘤样本IBEX技术22色标记成像成像仪器:STELLARIS共聚焦显微镜(Radtke, A.美国NIH)
图5 淋巴瘤样本IBEX技术22色标记成像成像仪器:STELLARIS共聚焦显微镜(Radtke, A.美国NIH)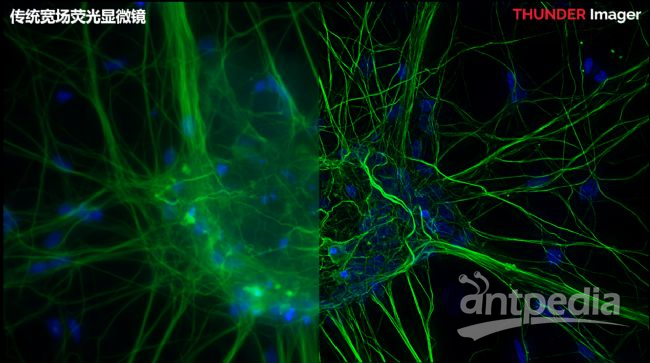 图6 中枢神经元微管蛋白(绿)成像仪器:THUNDER荧光显微镜(FAN GmbH, Magdeburg (Germany))左,宽场荧光显微镜;右,THUNDER
图6 中枢神经元微管蛋白(绿)成像仪器:THUNDER荧光显微镜(FAN GmbH, Magdeburg (Germany))左,宽场荧光显微镜;右,THUNDER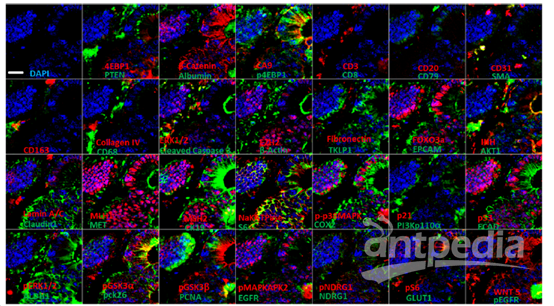 图7 结肠癌组织55色标记成像成像仪器:Cell DIVE超多标成像仪(刊稿杂志:Nat Commun.[5])
图7 结肠癌组织55色标记成像成像仪器:Cell DIVE超多标成像仪(刊稿杂志:Nat Commun.[5])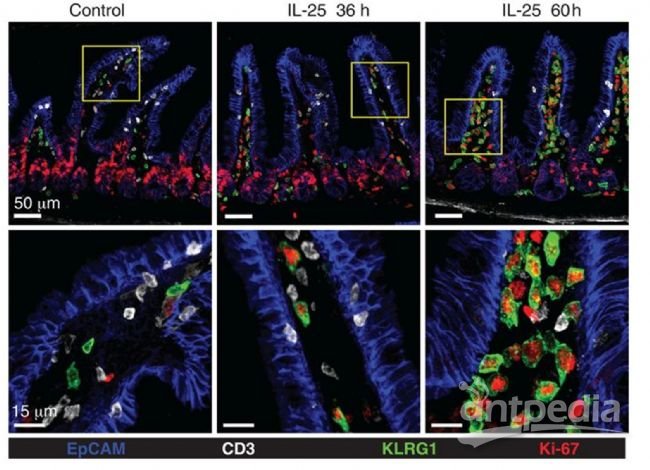 图8 小鼠小肠组织ILC成像成像仪器:共聚焦(刊稿杂志:Science [7]) 设备代表性文献THUNDER[1] Jarret A, et al. Enteric Nervous System-Derived IL-18 Orchestrates Mucosal Barrier Immunity. Cell, 2020.[2] Guccini I, et al. Senescence Reprogramming by TIMP1 Deficiency Promotes Prostate Cancer Metastasis. Cancer Cell, 2020.[3] Tosetti N, et al. Essential function of the alveolin network in the subpellicular microtubules and conoid assembly in Toxoplasma gondii. eLife Sciences, 2020.Cell DIVE[4] Gerdes M J, et al. Highly multiplexed single-cell analysis of formalin-fixed, paraffin-embedded cancer tissue. PNAS, 2013.[5] Uttam S, et al. Spatial domain analysis predicts risk of colorectal cancer recurrence and infers associated tumor microenvironment networks. Nature Communications, 2020.[6] Ziju Y, et al. Immune Profiling and Quantitative Analysis Decipher the Clinical Role of Immune-Checkpoint Expression in the Tumor Immune Microenvironment of DLBCL. Cancer immunology research, 2019.Confocal (SP8/STELLARIS)[7] Huang Y, et al. S1P-dependent interorgan trafficking of group 2 innate lymphoid cells supports host defense. Science, 2018.[8] Mao K, et al. Innate and adaptive lymphocytes sequentially shape the gut microbiota and lipid metabolism. Nature.[9] Chaido S, et al. PD-1 Inhibitory Receptor Downregulates Asparaginyl Endopeptidase and Maintains Foxp3 Transcription Factor Stability in Induced Regulatory T Cells. Immunity, 2018.了解更多:徕卡显微
图8 小鼠小肠组织ILC成像成像仪器:共聚焦(刊稿杂志:Science [7]) 设备代表性文献THUNDER[1] Jarret A, et al. Enteric Nervous System-Derived IL-18 Orchestrates Mucosal Barrier Immunity. Cell, 2020.[2] Guccini I, et al. Senescence Reprogramming by TIMP1 Deficiency Promotes Prostate Cancer Metastasis. Cancer Cell, 2020.[3] Tosetti N, et al. Essential function of the alveolin network in the subpellicular microtubules and conoid assembly in Toxoplasma gondii. eLife Sciences, 2020.Cell DIVE[4] Gerdes M J, et al. Highly multiplexed single-cell analysis of formalin-fixed, paraffin-embedded cancer tissue. PNAS, 2013.[5] Uttam S, et al. Spatial domain analysis predicts risk of colorectal cancer recurrence and infers associated tumor microenvironment networks. Nature Communications, 2020.[6] Ziju Y, et al. Immune Profiling and Quantitative Analysis Decipher the Clinical Role of Immune-Checkpoint Expression in the Tumor Immune Microenvironment of DLBCL. Cancer immunology research, 2019.Confocal (SP8/STELLARIS)[7] Huang Y, et al. S1P-dependent interorgan trafficking of group 2 innate lymphoid cells supports host defense. Science, 2018.[8] Mao K, et al. Innate and adaptive lymphocytes sequentially shape the gut microbiota and lipid metabolism. Nature.[9] Chaido S, et al. PD-1 Inhibitory Receptor Downregulates Asparaginyl Endopeptidase and Maintains Foxp3 Transcription Factor Stability in Induced Regulatory T Cells. Immunity, 2018.了解更多:徕卡显微

 图1免疫学研究高频检索词汇云图2017-2019国家自然科学基金免疫学项目名称词云分析免疫学成像需求、挑战及解决方案
图1免疫学研究高频检索词汇云图2017-2019国家自然科学基金免疫学项目名称词云分析免疫学成像需求、挑战及解决方案 免疫细胞/组织多色荧光成像解决方案免疫系统的复杂性决定了免疫学研究中常常需要同时关注几种甚至几十种生物标志分子。荧光基团串色、光谱拆分假阳性、染料选择少等难题使成像技术在免疫学领域的应用总是受到限制。下面几款徕卡高端成像设备专精于多重标记荧光成像,能帮助您扫清免疫学多色成像的障碍。宽场荧光成像系统——
免疫细胞/组织多色荧光成像解决方案免疫系统的复杂性决定了免疫学研究中常常需要同时关注几种甚至几十种生物标志分子。荧光基团串色、光谱拆分假阳性、染料选择少等难题使成像技术在免疫学领域的应用总是受到限制。下面几款徕卡高端成像设备专精于多重标记荧光成像,能帮助您扫清免疫学多色成像的障碍。宽场荧光成像系统—— 图2 DMi8 THUNDER倒置荧光成像系统
图2 DMi8 THUNDER倒置荧光成像系统 图3 STELLARIS 5激光共聚焦成像系统
图3 STELLARIS 5激光共聚焦成像系统
 图5 淋巴瘤样本IBEX技术22色标记成像成像仪器:STELLARIS共聚焦显微镜(Radtke, A.美国NIH)
图5 淋巴瘤样本IBEX技术22色标记成像成像仪器:STELLARIS共聚焦显微镜(Radtke, A.美国NIH) 图6 中枢神经元微管蛋白(绿)成像仪器:THUNDER荧光显微镜(FAN GmbH, Magdeburg (Germany))左,宽场荧光显微镜;右,THUNDER
图6 中枢神经元微管蛋白(绿)成像仪器:THUNDER荧光显微镜(FAN GmbH, Magdeburg (Germany))左,宽场荧光显微镜;右,THUNDER 图7 结肠癌组织55色标记成像成像仪器:Cell DIVE超多标成像仪(刊稿杂志:Nat Commun.[5])
图7 结肠癌组织55色标记成像成像仪器:Cell DIVE超多标成像仪(刊稿杂志:Nat Commun.[5]) 图8 小鼠小肠组织ILC成像成像仪器:共聚焦(刊稿杂志:Science [7]) 设备代表性文献THUNDER[1] Jarret A, et al. Enteric Nervous System-Derived IL-18 Orchestrates Mucosal Barrier Immunity. Cell, 2020.[2] Guccini I, et al. Senescence Reprogramming by TIMP1 Deficiency Promotes Prostate Cancer Metastasis. Cancer Cell, 2020.[3] Tosetti N, et al. Essential function of the alveolin network in the subpellicular microtubules and conoid assembly in Toxoplasma gondii. eLife Sciences, 2020.Cell DIVE[4] Gerdes M J, et al. Highly multiplexed single-cell analysis of formalin-fixed, paraffin-embedded cancer tissue. PNAS, 2013.[5] Uttam S, et al. Spatial domain analysis predicts risk of colorectal cancer recurrence and infers associated tumor microenvironment networks. Nature Communications, 2020.[6] Ziju Y, et al. Immune Profiling and Quantitative Analysis Decipher the Clinical Role of Immune-Checkpoint Expression in the Tumor Immune Microenvironment of DLBCL. Cancer immunology research, 2019.Confocal (SP8/STELLARIS)[7] Huang Y, et al. S1P-dependent interorgan trafficking of group 2 innate lymphoid cells supports host defense. Science, 2018.[8] Mao K, et al. Innate and adaptive lymphocytes sequentially shape the gut microbiota and lipid metabolism. Nature.[9] Chaido S, et al. PD-1 Inhibitory Receptor Downregulates Asparaginyl Endopeptidase and Maintains Foxp3 Transcription Factor Stability in Induced Regulatory T Cells. Immunity, 2018.了解更多:
图8 小鼠小肠组织ILC成像成像仪器:共聚焦(刊稿杂志:Science [7]) 设备代表性文献THUNDER[1] Jarret A, et al. Enteric Nervous System-Derived IL-18 Orchestrates Mucosal Barrier Immunity. Cell, 2020.[2] Guccini I, et al. Senescence Reprogramming by TIMP1 Deficiency Promotes Prostate Cancer Metastasis. Cancer Cell, 2020.[3] Tosetti N, et al. Essential function of the alveolin network in the subpellicular microtubules and conoid assembly in Toxoplasma gondii. eLife Sciences, 2020.Cell DIVE[4] Gerdes M J, et al. Highly multiplexed single-cell analysis of formalin-fixed, paraffin-embedded cancer tissue. PNAS, 2013.[5] Uttam S, et al. Spatial domain analysis predicts risk of colorectal cancer recurrence and infers associated tumor microenvironment networks. Nature Communications, 2020.[6] Ziju Y, et al. Immune Profiling and Quantitative Analysis Decipher the Clinical Role of Immune-Checkpoint Expression in the Tumor Immune Microenvironment of DLBCL. Cancer immunology research, 2019.Confocal (SP8/STELLARIS)[7] Huang Y, et al. S1P-dependent interorgan trafficking of group 2 innate lymphoid cells supports host defense. Science, 2018.[8] Mao K, et al. Innate and adaptive lymphocytes sequentially shape the gut microbiota and lipid metabolism. Nature.[9] Chaido S, et al. PD-1 Inhibitory Receptor Downregulates Asparaginyl Endopeptidase and Maintains Foxp3 Transcription Factor Stability in Induced Regulatory T Cells. Immunity, 2018.了解更多: