实体肿瘤与各类型基质细胞共存于严酷的肿瘤微环境(TMEs)中。在肿瘤增殖和转移过程中,肿瘤细胞和基质细胞都会经历快速的代谢适应。肿瘤细胞与其“邻居”通过代谢协调或者竞争来维持生物合成与能量代谢的需求,同时逃避免疫监视或治疗干预。先前的研究已发现致癌信号和致癌代谢物调控的癌细胞代谢重塑,最近多项研究也聚焦到肿瘤细胞与TMEs之间的代谢通信与治疗干预。宾夕法尼亚大学M. Celeste Simon教授对肿瘤细胞与异质性基质成分在原发性和转移性TMEs中代谢通信的最新进展进行了阐述,并探讨了通过靶向代谢信号来改善癌症治疗的新策略,相关成果发表于《 Developmental Cell 》。
实体瘤内部的代谢交流
实体瘤内部存在显著的代谢异质性,这在很大程度上源于血管的完整性以及与产生氧气和营养物质的脉管系统的远近。比如人类非小细胞肺癌中,血管化良好的肿瘤亚区可利用多种营养物质,而灌注不良的区域则以葡萄糖作为主要碳源。重要的是曾被认为是代谢废物的乳酸比葡萄糖更被肿瘤细胞偏爱以用于TCA循环。乳酸代谢可影响细胞内的氧化还原状态,并使葡萄糖转向磷酸戊糖途径和氨基己糖生物合成。
肿瘤腔内的癌细胞会合作形成代谢“共生”。乳酸穿梭就是其中一个示例,在缺氧区域的癌细胞通过厌氧糖酵解消耗葡萄糖并释放乳酸,然后乳酸被邻近含氧肿瘤区域的癌细胞用于三羧酸循环的燃料。乳酸穿梭可能是由单羧酸转运蛋白(MCTs)的差异表达引起的:缺氧癌细胞表达高水平的MCT4作为乳酸主要的输出转运蛋白,而富氧癌细胞表达MCT1作为乳酸输入转运蛋白。有研究表明,肿瘤核心的氨基酸水平高于其边缘区域,包括谷氨酰胺、精氨酸、天冬酰胺、丝氨酸和天冬氨酸,推测边缘癌细胞释放这些氨基酸以供内部癌细胞利用。此外,缺氧癌细胞会增加外源性不饱和脂肪酸摄取来维持脂质稳态,可能受益于富氧癌细胞的脂肪酸合成(图1)。
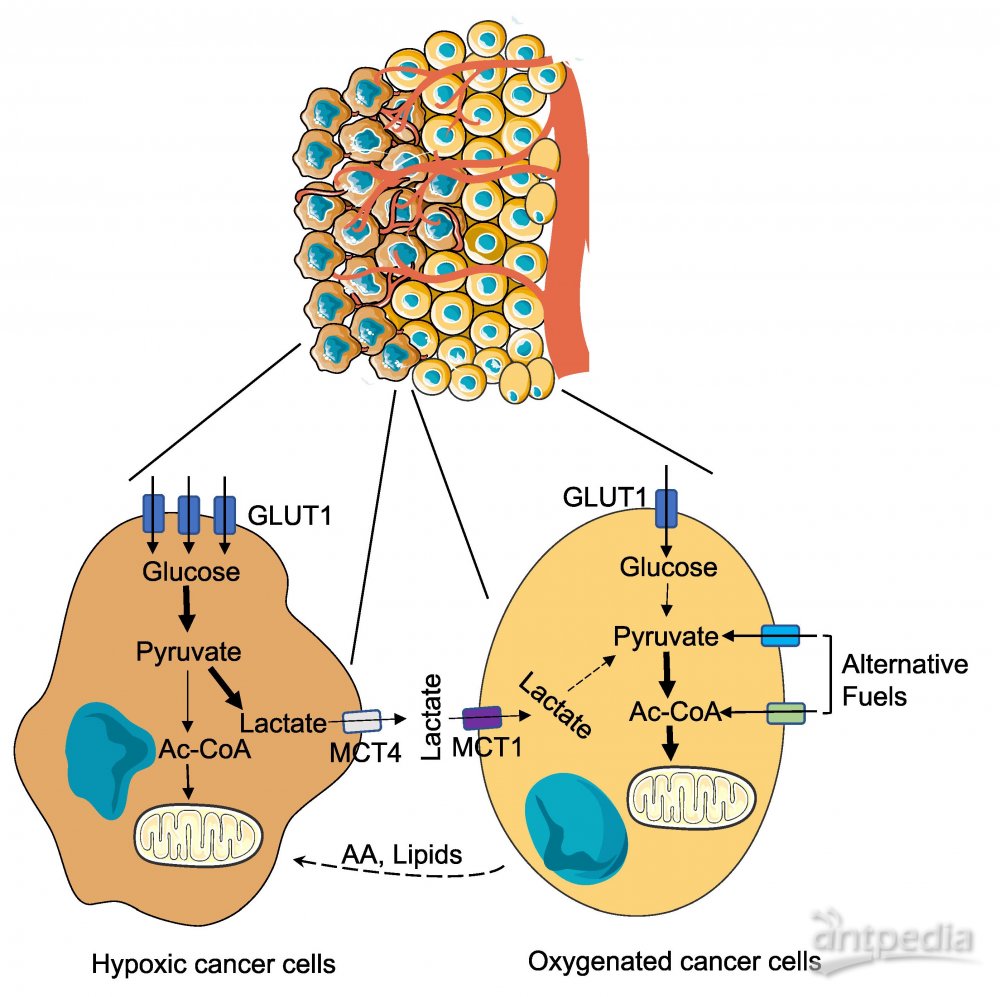
Figure 1. Metabolic Heterogeneity and Symbiosis among Solid-Tumor Compartments
癌细胞-成纤维细胞代谢共生
肿瘤细胞和基质细胞之间的双向代谢通信一方面有助于肿瘤的生长,另外也会影响治疗反应。癌症相关成纤维细胞(CAFs)对肿瘤的发生、进展和转移有重要的调节作用,癌细胞与CAFs通过多种机制进行代谢交流(图2)。比如乳酸穿梭,也被称为“反向Warburg效应”,即CAFs通过无氧糖酵解代谢葡萄糖产生乳酸,然后被富氧癌细胞吸收并利用。而“反向Warburg效应”并不是应用于所有CAF-癌细胞之间的通信,这可能由起源的细胞或组织决定,比如,乳腺癌和结肠癌细胞消耗葡萄糖并向周围成纤维细胞释放乳酸,而胰腺和卵巢CAFs消耗葡萄糖却不释放乳酸,因为糖酵解活性低。
胰腺星状细胞(PSCs)是胰腺CAFs的主要类型,其被胰管腺癌(PDAC)细胞激活,通过增强自噬分泌丙氨酸,从而为PDAC细胞提供主要的碳源,减轻它们对葡萄糖和谷氨酰胺的依赖。PSCs还分泌溶血磷脂酰胆碱(LPC),支持PDAC细胞合成磷脂酰胆碱和溶血磷脂酸(LPA)。此外,CAFs还释放大分子支持癌细胞生长,比如,肺CAFs通过自噬逐渐释放二肽,前列腺和胰腺CAFs释放外泌体来运输氨基酸、脂肪酸(FAs)和TCA循环的代谢物以供癌细胞吸收和利用。
癌细胞经常受到强烈的氧化还原应激的挑战,特别是在化疗的情况下,CAFs会调节邻近癌细胞的氧化还原稳态。研究表明,卵巢CAFs向癌细胞释放谷胱甘肽(GSH)和半胱氨酸,从而维持氧化还原平衡和化疗耐药。类似的,骨髓基质细胞输入胱氨酸并将其转化为半胱氨酸,然后释放到微环境中,并被慢性淋巴白血病细胞用于GSH的合成。下调的肝细胞代谢与肝星状细胞之间的通信促进肝脏肿瘤的发生,为TMEs中CAFs与非肿瘤细胞之间增加另一层代谢联系。不过,驱动CAFs代谢重塑的癌细胞来源代谢物仍有待在不同的组织环境中进行验证。
肿瘤细胞代谢物的免疫调节
逃避免疫监测是癌症的一个特征。肿瘤细胞采用多种策略来抑制免疫系统,包括分泌代谢物来调节TME-免疫谱(图2)。在低氧肿瘤区域,癌细胞来源的高浓度乳酸对免疫细胞有多向性作用。乳酸阻断单核细胞和树突状细胞的分化,并抑制T细胞活化和肿瘤免疫监测。另外,乳酸促进肿瘤相关巨噬细胞(TAMs)向M2样表型分化和极化,精氨酸酶-1(ARG1)和甘露糖受体C型1(CD206)表达升高。反过来,M2样TAMs产生免疫抑制细胞因子(如IL-10)和细胞分裂所需的代谢物如多胺。但减少乳酸的产生是否可以提高抗癌免疫治疗的效果,仍有待进一步的体内研究。
癌细胞促进色氨酸分解代谢产生犬尿氨酸,激活CD4+T细胞中犬尿氨酸-芳基烃受体(AHR)信号轴,有利于其分化为免疫抑制调节T细胞。鼠肉瘤细胞产生维甲酸(RA)使瘤内单核细胞向TAMs分化极化,而不是树突状细胞,导致免疫抑制和肿瘤生长。此外,肿瘤浸润的髓系细胞,包括髓源性抑制细胞(MDSCs)和TAMs中的脂质积累能促进代谢重编程,并使这些免疫细胞向免疫抑制表型倾斜,这些脂质可能部分来自脂肪酸合成增强的邻近癌细胞。因此,肿瘤细胞衍生的代谢物为疾病的进展创造了有利的免疫微环境,有些代谢物也作为信号分子发挥功能。
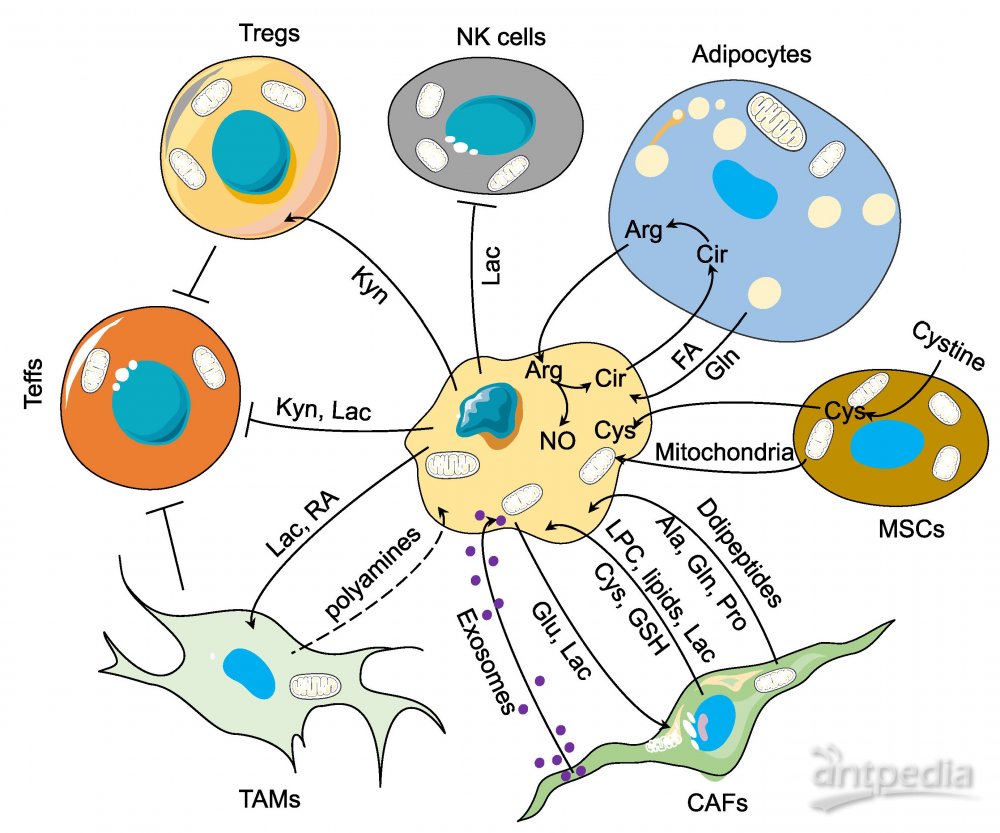
Figure 2. Tumor-Stroma Metabolic Communications in the TME
肿瘤细胞与脂肪细胞之间的代谢通信
肥胖与多种癌症的风险和恶性程度增加密切相关,脂肪细胞和脂肪组织(AT)直接介导肥胖的一些原致癌作用,比如脂肪细胞为癌细胞提供外源性脂类。人网膜脂肪细胞诱导共培养的卵巢癌细胞过度表达CD36,增强FA摄取、胆固醇和脂滴(LD)积累以及肿瘤生长。在缺氧条件下,癌细胞增加胞外脂质的利用,以满足对生物能量和生物合成的需求,以及维持膜稳态。由于CAFs可能通过外泌体将脂肪酸传递给癌细胞以及白蛋白结合的脂质可能通过微胞吞吸收,这些内吞途径或许也参与了脂肪细胞向癌细胞的脂质转移。此外,卵巢脂肪基质细胞也能通过精氨酸代谢与癌细胞进行代谢通信。
癌细胞与免疫细胞之间的营养竞争
为了最大限度地利用营养,癌细胞必须与基质细胞竞争有限的底物,特别是在代谢压力下。因为代谢可塑性与免疫细胞亚群的功能活性有关,本文聚焦新兴的癌症-免疫细胞营养竞争(图3)。
葡萄糖浓度严重影响细胞代谢与生长。肿瘤细胞中葡萄糖利用增加,导致胞外水平低和浸润免疫细胞的代谢受限。比如,黑色素瘤细胞的葡萄糖消耗限制了T细胞的葡萄糖供应,导致糖酵解中间代谢物磷酸烯醇丙酮酸(PEP)水平降低。PEP通过抑制sarco/ERCa2+-ATP酶(SERCA)活性来调节T细胞受体介导的Ca2+-NFAT信号传导和效应功能。同样,鼠肉瘤细胞代谢葡萄糖消耗限制了T细胞及其效应功能。因此,通过阻断癌细胞对葡萄糖的摄取,并将更多的葡萄糖重定向到浸润的T细胞,可以恢复抗肿瘤T细胞的反应。
癌细胞对胞外精氨酸的依赖性增加。几种癌症缺乏尿素循环酶精氨酸琥珀酸合成酶1(ASS1),使它们无法合成内源性精氨酸,完全依赖外源供应。充足的精氨酸诱导整体代谢的变化,促进中央记忆样细胞的产生,而精氨酸的限制相反地通过直接剥夺氨基酸来抑制T细胞效应器的功能。目前,补充精氨酸和抑制精氨酸降解是恢复T细胞效应功能的有力策略。
肿瘤细胞和巨噬细胞可通过增加摄取和分解代谢耗尽色氨酸。吲哚-2,3-双加氧酶(IDO)是色氨酸通过犬尿氨酸途径分解代谢的第一个酶和限速酶,通常由肿瘤细胞和巨噬细胞高度表达。色氨酸分解代谢进一步产生免疫抑制代谢物犬尿氨酸,促进调节T细胞分化。
丝氨酸是非必需氨基酸,可外源摄入,也可通过丝氨酸合成途径(SSP)从头合成。某些癌症如乳腺癌和黑色素瘤,即使外源添加丝氨酸,仍显示SSP酶的基因扩增并依赖SSP来生存。许多其他癌细胞选择性地消耗外源丝氨酸,将其转化为细胞内甘氨酸和一碳单位,以产生核苷酸并维持线粒体氧化还原稳态。重要的是,细胞外丝氨酸是最佳T细胞扩增和效应功能所必需的。
癌细胞消耗蛋氨酸可能会影响T细胞的活化和分化。蛋氨酸分解代谢中的酶,MAT2A在癌症中过表达。蛋氨酸被活化的T细胞迅速吸收,并作为维持S-腺苷基-L-甲硫氨酸(SAM)池的主要底物。蛋氨酸限制降低组蛋白H3K4三甲基化和参与Th17细胞增殖及细胞因子产生的关键基因的表达。
总之,癌细胞对必需营养的优先摄取直接限制了肿瘤杀伤免疫细胞,特别是细胞毒性T细胞的营养物质可用性,并产生免疫抑制代谢物(如乳酸和犬尿氨酸),共同导致抗肿瘤免疫受损(图3)。此外,癌细胞还通过过表达营养摄取转运蛋白和营养分解代谢酶来竞争,这些转运蛋白主要受致癌信号通路和/或致癌代谢物的控制。
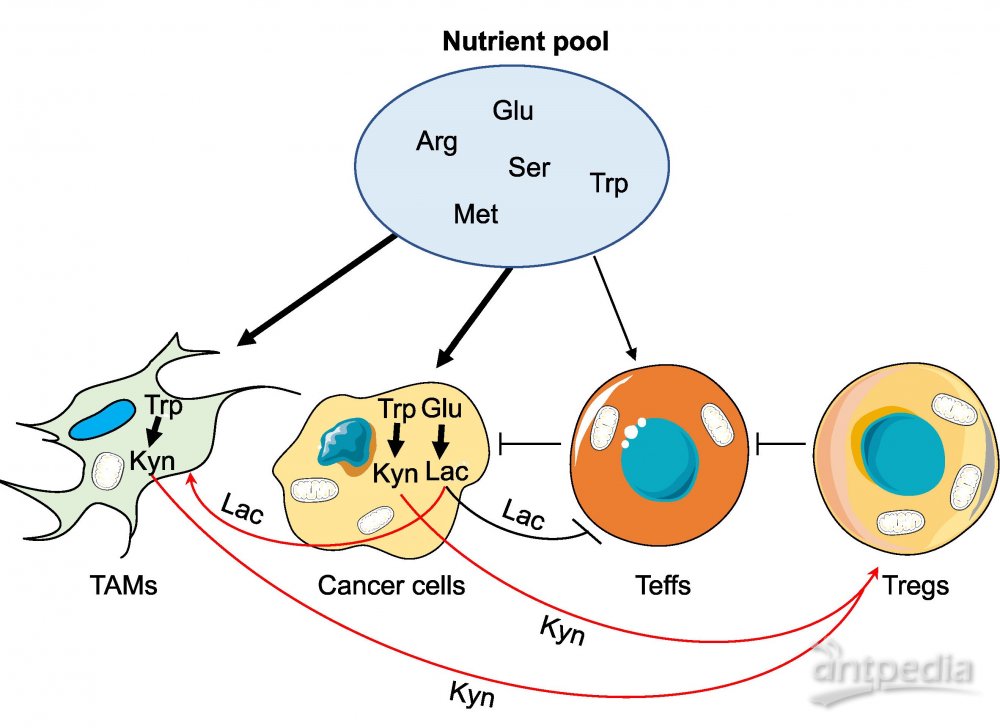
Figure 3. Nutrient Competition between Cancer Cells and Immune Cells
代谢物介导TMEs细胞间通信
近年来研究发现,代谢物不仅是参与生物能量和大分子生物合成的代谢中间体或最终产物,其在调节信号转导和基因表达方面的作用也有了很大的拓展。细胞自主机制包括代谢产物与信号通路蛋白质组分的直接相互作用、调节代谢物传感器通路、修饰蛋白质的稳定性或活性以及调节表观基因组和表观转录组。非自主方式可释放代谢物到TME中,将信号传递给邻近细胞从而介导胞间通信。
乳酸对TMEs中的各种细胞类型具有多向性效应,如影响局部pH值、调节细胞代谢和/或氧化还原状态。最近的研究为乳酸如何直接调节信号转导和基因表达提供了新的见解(图4)。乳酸与NDRG3(PHD2/VHLl底物)结合并使其稳定,介导缺氧诱导的Raf-ERK通路激活,与HIFs调控的细胞适应缺氧机制不同。有研究表明,乳酸能促进巨噬细胞中一种新的组蛋白翻译后修饰,称为乳酸化,即葡萄糖产生的乳酸进一步形成乳酰-CoA,通过乙酰转移酶p300将乳酰基团贡献给组蛋白赖氨酸尾部,激活伤口愈合基因,形成M2样表型。
TMEs中检测到腺苷累积,腺苷是通过外切核苷酸酶(CD39和CD73)在肿瘤和调节性T细胞中产生的,这些酶将细胞外三磷酸腺苷(ATP)转化为腺苷,腺苷与细胞毒性T细胞和NK细胞表面腺苷2A受体(A2AR)结合,抑制抗肿瘤免疫。
如上文所述(图2),犬尿氨酸和RA是来源于癌细胞的两种代谢物,在免疫细胞中起作用,犬尿氨酸通过AHR途径促进调节T细胞分化和上调CD8+T细胞中的PD-1,而RA通过RAR信号通路将瘤内单核细胞分化为TAMs。
(R)-2-羟基戊二酸(R-2-HG)和琥珀酸是致癌代谢物,通过干扰依赖于α-酮戊二酸(α-KG)的双加氧酶而作为表观遗传修饰剂。IDH1突变胶质瘤衍生的R-2-HG被T细胞吸收,干扰NFAT转录活性和多胺生物合成,导致T细胞活性被抑制。因此,通过抑制突变体IDH1的酶功能可提高抗肿瘤免疫。癌细胞释放琥珀酸,激活琥珀酸受体(SUCNR1)-PI3K-HIF-1α轴,将巨噬细胞极化为TAMs,在功能上促进肿瘤转移。
衣康酸,由TCA循环中顺式乌头酸合成,特别是在活化的巨噬细胞中。衣康酸在小鼠模型中介导巨噬细胞代谢与腹膜肿瘤生长之间的通信,即肿瘤细胞诱导腹腔组织巨噬细胞代谢重编程和衣康酸积累,而抑制衣康酸合成会抑制MAPK的激活和肿瘤的生长。但衣康酸在TMEs中的作用和机制仍需进一步研究。
其他代谢物,例如,氨基酸浓度影响像mTORC1和GCN2-ATF4途径这样的传感器,和/或影响下游代谢物,如与表观遗传相互作用的α-KG、ac-CoA和SAM。脂肪酸能通过结合具体的转录因子直接调控基因表达。因此,这些代谢物也可以通过多种机制发挥信号分子的作用,这取决于具体的TME情况。
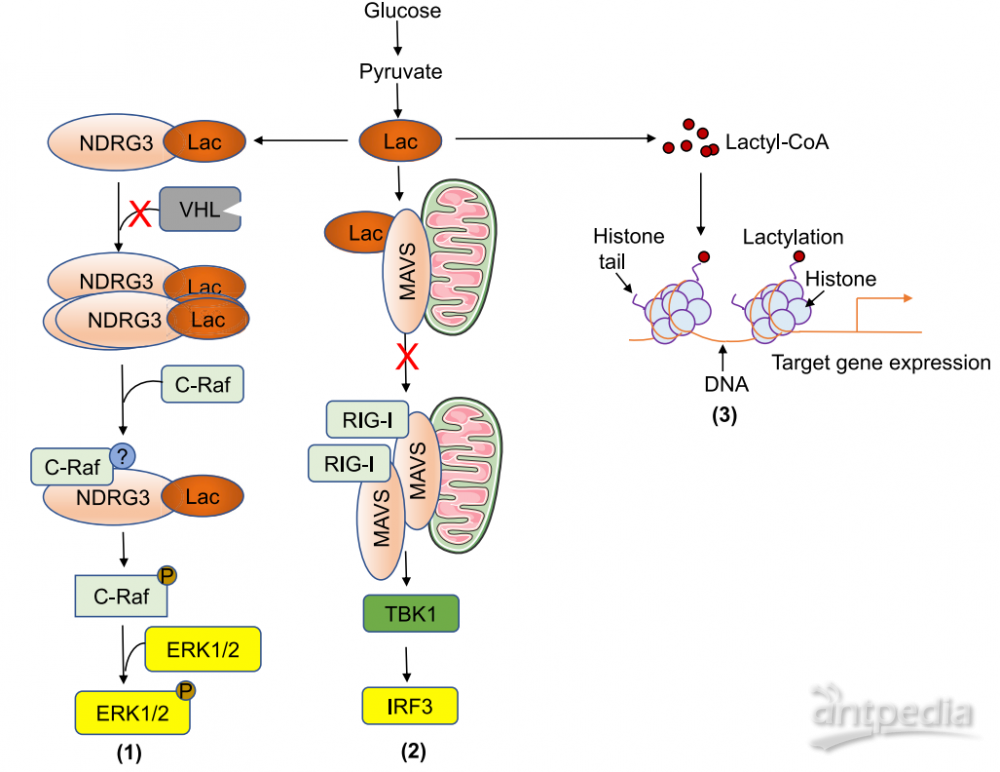
Figure4. Emerging Functions of Lactate in Regulating Signal Transduction and Gene Expression
转移性TMEs的代谢适应与交流
肿瘤细胞转移是癌症患者死亡的主要原因。由于器官特异性,包括结构或细胞组成、代谢和免疫谱以及营养供应,原代肿瘤细胞相应地在循环和转移的TMEs中进行代谢适应和交流(图5)。转移性肿瘤细胞必须在循环中存活,其中氧和营养的有用性及细胞-基质的相互作用被显著改变。NRF2-HO1轴下游BACH1的稳定可触发代谢重塑,促进肺癌细胞的糖酵解依赖性转移。能量传感器AMP活化蛋白激酶(AMPK)在基质分离的癌细胞中被激活,通过减少脂肪酸合成中的NADPH消耗和增加脂肪酸氧化(FAO)产生NADPH以维持NAPDH稳态。此外,癌细胞将线粒体氧化脱羧与胞浆还原羧化结合,以维持氧化还原平衡和非贴附性生长。
大脑具有独特的代谢重塑能力,以响应不同的营养供应。脑转移瘤利用局部丰富的非葡萄糖底物,包括乙酸、谷氨酰胺和BCAAs,表现出显著的代谢适应性。另外,从星形胶质细胞释放的多不饱和脂肪酸可激活过氧化物酶体增殖物激活受体γ(PPARγ),促进脑转移癌细胞的增殖,而全身给药PPARγ拮抗剂可显著减少体内脑转移。
肝脏是维持全身能量平衡的一个整体代谢器官,其代谢分区赋予转移性乳腺肿瘤优先参与低氧区糖酵解代谢的能力。转移性结直肠癌细胞分泌肌酸激酶、脑型B(CKB),磷酸化肝细胞释放的胞外肌酸,然后导入磷酸肌酸,补充细胞内ATP池。
作为人类的主要呼吸器官,肺受到高浓度氧和有毒化合物的氧化应激。因此,肺转移在代谢上承受氧化损伤。由于丙酮酸在肺部特别丰富,转移性肿瘤上调丙酮酸羧化酶(PC),利用丙酮酸而非谷氨酰胺来促进TCA循环。丙酮酸代谢通过脯氨酸-4-羟化酶(P4HA)创造了一个富含胶原的利基,以支持乳腺癌来源的肺转移。由于脯氨酸分解代谢主要支持肺转移形成,这种富含胶原的利基也可能有助于肿瘤的脯氨酸稳态。
骨是前列腺癌和乳腺癌的常见转移部位,后者释放丝氨酸和乳酸,促进破骨细胞的分化和代谢能力,形成溶骨性转移后微环境。卵巢癌优先转移到网膜(主要由脂肪细胞组成的代谢器官),共培养的卵巢癌细胞刺激脂肪细胞中的脂解,产生被癌细胞用作能量来源的脂质。最后,淋巴结(LNs)内的转移性肿瘤生长依赖于由转录辅助激活因子YES相关蛋白(YAP)驱动的FAO,该蛋白由LNs中积累的胆汁酸激活,药理抑制FAO可抑制小鼠LN转移。
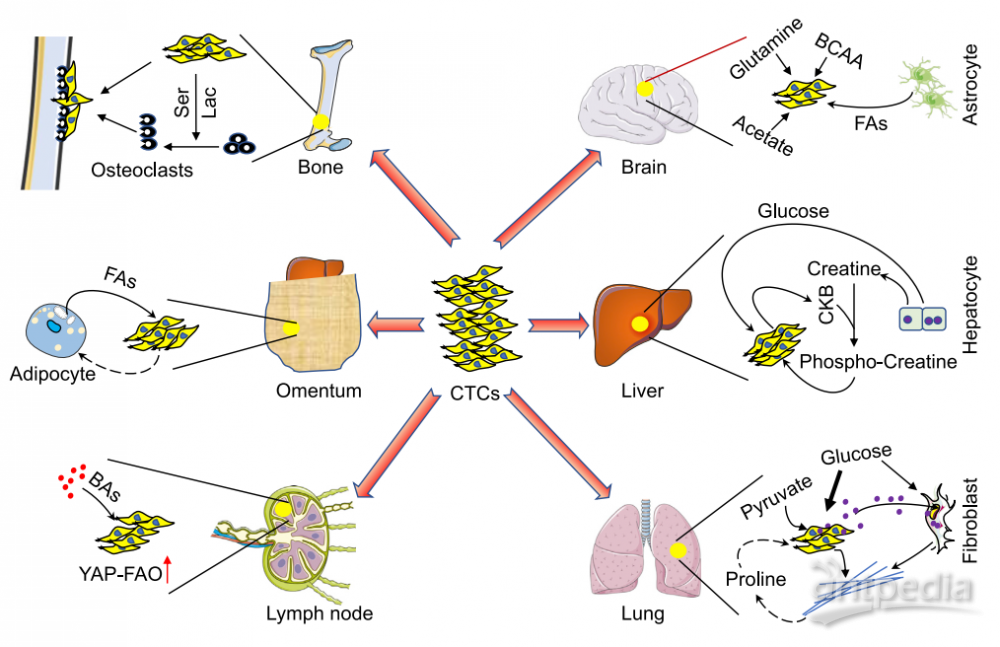
Figure5. Organ-SpecificMetabolicCommunicationinMetastaticTME
小结:靶向代谢通信用于癌症治疗
目前已提出多种策略来增强抗肿瘤免疫的代谢途径,通常包括针对癌症特异的代谢弱点、限制免疫抑制以及通过增强肿瘤特异性免疫细胞的代谢适应来增强效应功能。理想情况下,代谢方法与免疫治疗协同作用,选择性和可持续地清除肿瘤细胞,但应考虑肿瘤代谢是由内在和外在因素共同决定的。起源组织和局部微环境影响癌症的代谢适应和重塑,而某些遗传或表观遗传修饰和肿瘤可塑性对代谢干预具有不同的敏感性。因此,未来有必要将某些类型的癌症分为最适合精确治疗的分子和代谢亚型,随之单个肿瘤内的癌细胞在进展和转移以及对治疗的反应过程中经历代谢重塑,从而导致TMEs代谢重编程,进而引起不同的免疫微环境。总之,TMEs中靶向代谢通信应考虑肿瘤类型、分期、位置和潜在的补偿机制。
参考文献
Fuming Li, M. Celeste Simon. Cancer Cells Don’t Live Alone: Metabolic Communication within Tumor Microenvironments. Developmental Cell (2020), https://doi.org/10.1016/j.devcel.2020.06.018.
原文阅读,请长按识别下方二维码

精彩推荐
1. 绘谱导读︱7月代谢组学文献精选
2. 绘谱导读︱8月代谢组学文献精选
3. Nature Communications | 肿瘤微环境中的细胞代谢差异
4. BJC | 癌症中脂肪酸代谢的重编程
5. Science | 肿瘤转移到淋巴结需要YAP依赖的代谢适应
6. Nature Reviews Clinical Oncology | 代谢调节提高免疫治疗
7. Cell Metabolism | 黑色素瘤和乳腺癌通过上调丝氨酸合成获得生长优势
8. NATURE REVIEWS DRUG DISCOVERY | 色氨酸代谢—最火的疾病治疗靶点成药性如何?









