冠状病毒因为包膜上密布着类似日冕的棘突而得名,属于冠状病毒科,正冠状病毒亚科的冠状病毒属。根据血清学和基因组学特点,该属名代表了α、β、γ和δ四个属。目前已知感染人的冠状病毒包括7种,即α属的普通冠状病毒HCoV‑229E和HCoV‑OC43,β属的HCoV‑NL63、HCoV‑HKU1、严重急性呼吸综合征(SARS)-CoV和中东呼吸综合征(MERS)-CoV,以及此次导致武汉不明原因肺炎的新型冠状病毒(2019-nCoV)。其中,HCoV‑HKU1、SARS-CoV、MERS-CoV和2019-nCoV可以导致人类肺炎,其他是成人普通感冒的病原,儿童较敏感,可致上呼吸道感染。 早在2008年的《Cell》中,一组来自日本科学家发表了一篇题为《Visualizing spatiotemporal dynamics of multicellular cell-cycle progression》的文章,文中表示:他们得到了两种新型荧光蛋白,其中一种能使得G1期细胞核呈现红色,而另一种使得S/G2/M期细胞核呈现出绿色,研究人员将这些蛋白称为荧光泛素化细胞周期标志物(Fucci)。
 图1 Cell封面图片:处于不同细胞周期的细胞核发出红色或绿色荧光
图1 Cell封面图片:处于不同细胞周期的细胞核发出红色或绿色荧光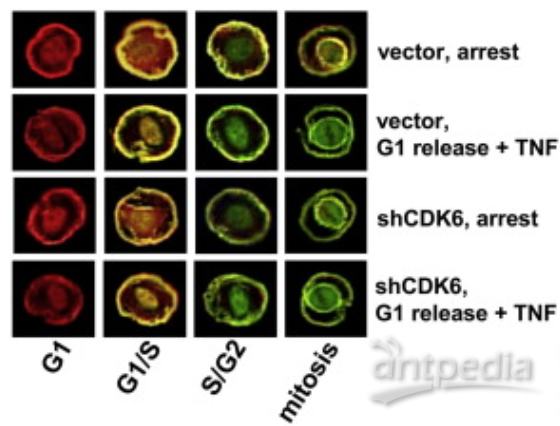 图2 LMD-切割细胞的典型周期状态
图2 LMD-切割细胞的典型周期状态
利用这一发现,来自德国吉森大学药理学的Poppe与他的合作者们研究了冠状病毒对细胞NF-κB通路和染色质分布的影响。 研究人员首先用HCoV-229E感染A549肺癌细胞模型,然后通过激光显微切割(LMD6000)结合免疫荧光用于分解(i)被HCoV-229E感染的细胞,(ii)与感染细胞紧邻的细胞,(iii)距离感染细胞至少150μm的细胞(“远端细胞”)和(iv)单独的未感染的细胞。
 图3 细胞株示意图
图3 细胞株示意图
他们分离了表达冠状病毒N蛋白的细胞,并提取了整个RNA。
 图4 借助免疫荧光和激光显微切割分离细胞株
图4 借助免疫荧光和激光显微切割分离细胞株
Laser microdissection实验过程:
细胞接种在加入2μm 青霉素(PEN)的30mm的圆形培养皿中。
免疫染色和LMD按照预定方案*进行,并进行如下修改。
处理结束时,细胞用Hank's平衡盐溶液(HBSS)洗涤2次,每次5分钟,并用2ml乙醇固定5分钟。
在HBSS中洗涤30秒,然后用2ml HBSS /0.1% Saponin加10%驴血清封闭,孵育3分钟。
稀释1:50的N蛋白抗体或1:400的P(S2)-pol II,在含0.1%皂素的400μm Hank’s BSS中37℃孵育。
用Hank’s BSS/0.1%皂素洗涤30秒。
用y3抗体(1:50)和Dylight488二抗(1:400),室温400μl HBSS/0.1% Saponin。
在2 ml HBSS中洗涤3次,每次30秒,然后在2ml DEPC水中洗涤30次,然后在40℃干燥30分钟。
使用Leica LMD6000系统将未感染的细胞和感染的细胞切除并收集在微量离心管中,用荧光显微镜检测。
Leica激光显微切割系统优势
从病理样本、细胞样本或涂片中,采用激光切割、分离收集特定染色体,细胞,组织,从而进行精准细胞的下游基因组、转录组、蛋白组、或代谢组水平的分析及验证。
可应用于特定的单个染色体、细胞、整个组织区域,甚至骨骼、牙齿、大脑、植物等的切割分离。专利重力非接触收集模式(专利号:DE 10057292, EP 1207392, JP 3641454)精准、无污染。可配备自动高通量切割及收集模式。操作过程中无需移动样品,而是通过专利的激光光束任意扫描切割(专利号:EP 1276586、US 7035004、JP 3996773),灵活又精准。重力收集模式又很好地避免了样品污染。
采用独特的激光设计和易用的动态软件,高达5000 Hz脉冲的349nm,干净、高效的切割目标物边缘,而目标物体无需接触激光,不受影响。
采用普通的0.2或0.5ml离心管即可收集,耗材成本低。
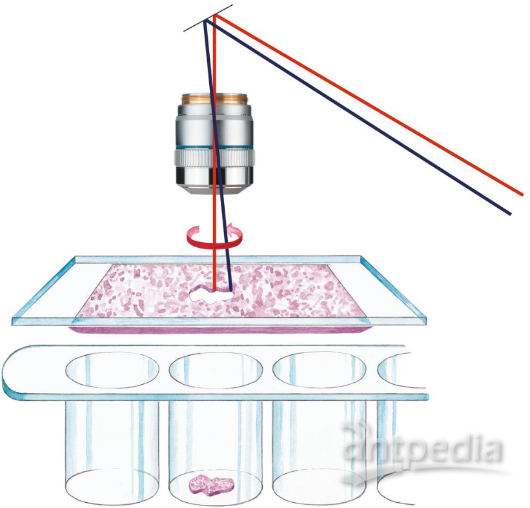
图5 LMD切割示意图
接着,研究人员通过利用RT-qPCR和微阵列分析发现,与感染细胞紧邻的细胞在单细胞水平上表征与存在于相同或不同培养物中的相邻的未感染细胞相反,感染后的基因表达发生了变化。并通过HCoV-229E病毒N蛋白的免疫荧光(DMIRE2,DMi8)分析来监测HCoV-229E感染并在A549细胞中扩散。 病毒学中荧光显微镜可以更好地满足研究人员的需求。然而,在对动物组织进行研究时,仍有机会进行明场显微镜检查,比如检查病毒感染后组织的形态变化等。 此外,在细胞培养实验室中使用明视野显微镜检查已经感染或将会感染的细胞(DM IL,DMi1,PAULA)的健康状况和生长状态。
 图6 极化上皮细胞MDCK的明场图像
图6 极化上皮细胞MDCK的明场图像
Leica显微镜在病毒学中的应用远不止这些,而这些看似基础的研究工作恰恰起到了直接作用。另外还有其他用于病毒可视化的技术,例如电子显微镜(EM)可以分解病毒颗粒、单分子检测(TCS SP8 SMD)、荧光寿命成像(FLIM) (STELLARIS 8 FALCON)以及多光子显微镜(SP8 DIVE)是适用于病毒学的其他方法,这些今后为您介绍。参考文献:[1] Chin J Prev Med, March 2020, Vol.54, No.3[2] Nat Rev Microbiol. 2013;11(12):836–48. pmid:24217413[3] Mol Cell. 2014;53(2):193–208.[4] Cell, Vol 132, 487-498, 08 February 2008* Am J Pathol. 1999;154(1):61-6.

 图1 Cell封面图片:处于不同细胞周期的细胞核发出红色或绿色荧光
图1 Cell封面图片:处于不同细胞周期的细胞核发出红色或绿色荧光 图2 LMD-切割细胞的典型周期状态
图2 LMD-切割细胞的典型周期状态  图3 细胞株示意图
图3 细胞株示意图 图4 借助免疫荧光和激光显微切割分离细胞株
图4 借助免疫荧光和激光显微切割分离细胞株
 图6 极化上皮细胞MDCK的明场图像
图6 极化上皮细胞MDCK的明场图像