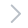诚信认证:
工商注册信息已核实! 扫一扫即可访问手机版展台
扫一扫即可访问手机版展台
使用人 iPSC 源性心脏细胞球评估药物对 心肌细胞生理学的影响
| 领域: | 细胞生物学,蛋白/抗体/蛋白质组,生物安全 | ||
| 资料类型: | 其他资料 | ||
| 资料文件名 | 资料大小 | 下载 |
|---|---|---|
使用人 iPSC 源性心脏细胞球评估药物对 心肌细胞生理学的影响 |
0.00MB | 下载此篇资料 |
简介
为了更好地模拟体内微环境并且预测化合物的功效和毒性,细胞模型变得愈加复杂。人们对使用三维 (3D) 细胞球进行组织生物学建模和毒性评估越来越感兴趣。使用 3D 培养物开发通量更高的定量检测是一个活跃的研究领域。在本研究中,我们开发了用人诱导多能干细胞 (iPSC)形成 3D 细胞球的方法。使用高内涵成像 (HCI) 和快速动力学荧光成像 (FLIPR),我们用钙敏感染料监测细胞内钙水平的变化,测量了各种化合物对心脏细胞球搏动率和模式的影响。
心脏细胞球的形成
使用了来自 Cellular Dynamics International (CDI) 的冷冻保存的iCell心肌细胞进行此研究。将细胞解冻并铺板至超低吸附的(ULA) U 形底 96 孔板(20,000 个细胞/孔)和384 孔板(Corning)中(10,000 个细胞/孔),并在维持培养基中孵育 4 天以形成细胞球培养物。心脏细胞球在 48 小时内由 iPSC 源性心肌细胞有效形成,并在培养 3-4 天后自发收缩。然后,这些 3D 细胞模型可用 Ca2+ 敏感染料染色以评估心脏毒性。细胞内 Ca2+ 流引起的荧光强度变化被用作细胞球收缩的替代标记。在对心脏活性和心脏毒性化合物的刺激下,观察到基线搏动模式的显著改变。
我们在这里描述了两种记录、定量和表征 iPSC 源性心脏细胞球搏动模式的方法:使用高内涵成像(ImageXpress® Micro 高内涵成像系统)和快速动力学荧光成像(FLIPR Tetra® 高通量细胞筛选系统)。
优势
使用高内涵成像采集延时图像并分析心脏细胞球搏动模式
使用 FLIPR Tetra system 对所有孔中的钙流进行同步动力学
读取测量不同化合物对心脏细胞球活性的影响
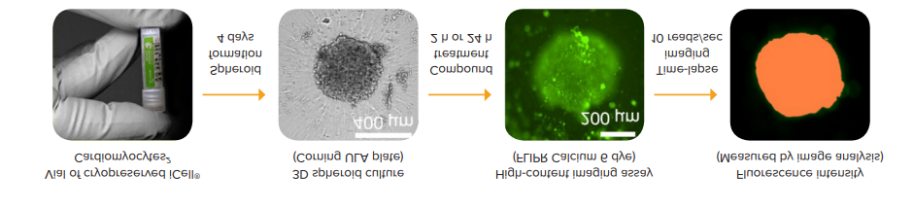
图 1:检测工作流程示意图。将 iCell 心肌细胞2 解冻并铺板至 U 形底部低附着板中以形成 3D 心脏细胞球。培养 4 天后,用化合物处理细胞球所需的时长,用 FLIPR 钙 6 染料染色,并使用 ImageXpress Micro Confocal 共聚焦系统采集延时图像。
使用高内涵成像随时间推移采集和分析心脏细胞球
成像方法可精确检测和可视化心脏细胞球,并包括在所需的时间周期和频率内采集延时图像。
本研究中使用的检测工作流程如图 1 所示。ImageXpress Micro Confocal 共聚焦系统使用自动延时采集获得细胞球图像。记录了整个细胞球的钙流模式,发现其与收缩同步(图 2)。记录频率设置为 10-20 次读取/秒,每孔 5-10 秒(或更长)的读取时间,使用 FITC 激发和发射滤光片,放大倍数为 20 倍或 10 倍。将细胞保存在环境控制下(37 °C,5% CO2)或密封。为实现更高的读数频率,激发时间为 10 ms 或更短。该成像方法对任何细胞球尺寸都有效。我们测试了从每孔 3,000-20,000 个平板细胞制备的细胞球。我们证明,跳动频率不依赖于细胞球大小(数据未显示)。使用标准推荐操作规程,使用 Hoechst 细胞核染色和 FLIPR®钙 6 染料 (Molecular Devices, LLC) 对细胞进行染色。
图 2. 加载 Ca2+ 敏感染料的iPSC 源性心肌细胞球收缩的延时图像系列。 每个图像均以 100 毫秒的间隔拍摄。黄色/红色(伪彩)表示高 Ca2+ 浓度和收缩状态。

图 3. 化合物处理的心脏细胞球的动态荧光强度。将图像数据导入 SoftMaxPro 7 软件,用于分析跳动率、振幅、峰宽和其他读数。此处显示的是延时强度图的板视图。
使用 MetaXpress Journal(可应要求提供)分析图像。Journal会自动查找细胞球,确定每个时间点的平均荧光强度,并以板格式保存每个时间点的强度数据。通过保存细胞球图像的延时堆栈,视频剪辑可保存在成像软件中。通过在Display模式下显示强度与时间的关系,可以查看跳动模式。每次延时拍摄的强度数据也可以导出为 Excel 格式。可使用SoftMax Pro 7 软件(图 3)对跳动模式进行进一步分析,软件可导入强度数据、分析跳动模式并定义主要参数,包括通量、跳动振幅、峰宽或衰减时间的变化1,2。使用几种测试化合物观察到的
钙流频率的浓度依赖性曲线如图 4 所示。表 1 显示了使用钙流频率作为读数,计算的选定化合物的 IC 值。
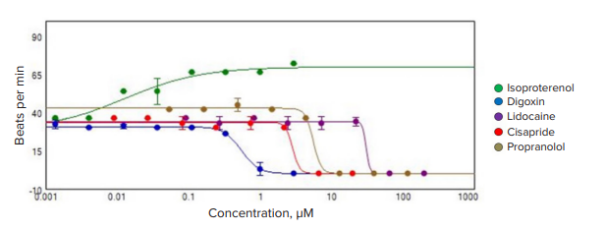
图 4. 由选定化合物引起的搏动频率的剂量依赖性变化图。
化合物 | IC.,MM |
异丙肾上腺素(绿色) | 0.013 ± 0.014 |
地高辛(蓝色) | 0.54 ± 0.038 |
利多卡因(紫色) | 30.3 ± 17.4 |
西沙必利(红色) | 2.82 ± 14.2 |
普萘洛尔(棕色) | 5.49 ± 5.43 |
维拉帕米(灰色) | 20.9 ± 17.5 |
索他洛尔 | 29.8 ± 16.1 |
Deltamethrin | 8.10 ± 10.5 |
阿司匹林 | 无影响 |
表 1 根据钙流频率的浓度依赖性变化计算的选定化合物的 IC50 值。
使用高内涵成像评估细胞球活性
这种高内涵成像方法也可用于定义不同化合物对细胞活性的影响。例如,我们证明,在化合物处理后,可通过性染料组合染色来评估心脏细胞球的
细胞活力:钙黄素 AM(取决于酯酶活性的活细胞染色)、Ethidium 同型二聚体(细胞不可渗透的死细胞指示剂)和 Hoechst(标记所有细胞的细胞渗透性核染色,包括活细胞和死细胞群),可在即用型 EarlyTox 活细胞/死细胞检测试剂盒中获得。
用染料孵育两小时后,使用 ImageXpress Micro Confocal 系统对染色的细胞球进行成像。
使用 10x 或 20x 放大倍率拍摄 Z 层图像,间隔 10 μm,范围约为 150 μm。
使用 MetaXpress 软件使用 2D 和 3D 分析模块分析细胞球内总活细胞和死细胞的图像。先前描述了用于分析细胞球以检测活性标记物的方法3。图 5 显示了对照和地高辛处理的细胞球的示例分析。可使用以下测量值进行化合物效应的多参数
评估:细胞数量、细胞球大小和细胞活性。
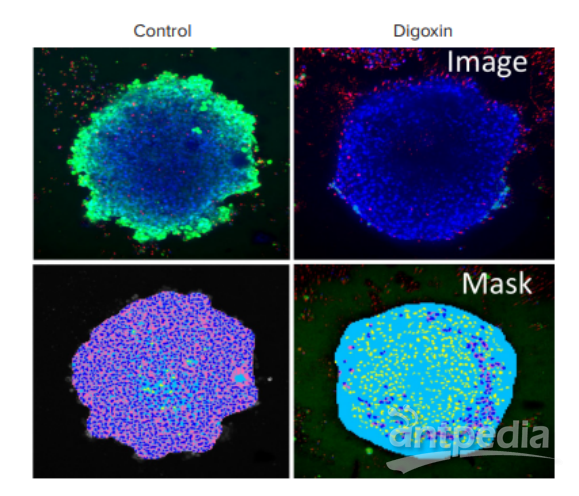
图 5. 使用 iPSC 源性心脏细胞球进行心脏毒性成像。(上图)对照和地高辛处理的细胞球用活性标记物染色:Calcein A(绿色)、Hoechst(蓝色)和EthD-1(红色)。(下图)图像分析mask显示蓝色细胞球、粉色活细胞的细胞质和黄色死细胞。
使用 FLIPR Tetra 系统监测搏动心肌细胞球中的 钙流,从而优化高通量筛选
相比,FLIPR Tetra 系统与一次仅对一个孔进行延时成像的高内涵成像方法相比,FLIPR Tetra系统可以同时读取整块板的荧光强度,因此可以对所有孔进行钙流的同步动力学读取。该系统还可以兼容自动化液体和平板处理。
ScreenWorks Peak Pro 软件模块可用于分析和表征跳动曲线,从而产生跳动速率、峰值频率和宽度或不规律波形等多参数输出。
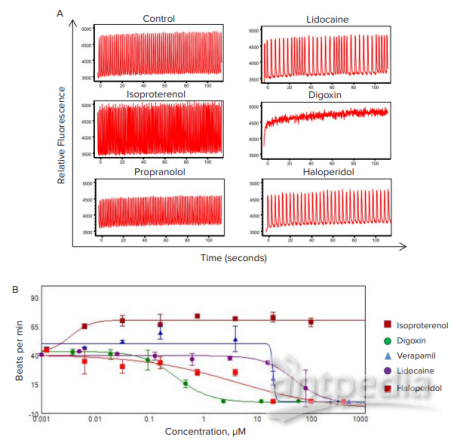
图 6. 对测试化合物的心脏细胞球反应进行快速动力学荧光分析。
(A) 比较经选定化合物处理并使用 FLIPR Tetra 仪器测量的心脏细胞球的 钙流曲线。频率、振幅、峰宽和其他参数ScreenWorks PeakPro 软件模块自动计算。(B) 测试化合物对心脏细胞球搏动率影响的剂量-反应图。
iPSC 源性心脏细胞球的钙流检测,使用 FLIPR Tetra系统的 96 孔或 384 孔板中进行了高通量筛选 (HTS)优化。如前所述,在低附着 U 底板中形成心脏细胞球。我们观察到,如果细胞球尺寸相对较大(300-500 μm,由 10,000-20,000 个铺板细胞形成),FLIPR Tetra 系统可更有效地检测细胞球。使用 FLIPR 钙 6 染料监测与细胞搏动同步的 钙流的变化。将试剂(2X 浓度)添加到板中,并在 37 °C、5% CO2 下孵育 2 小时。将细胞球暴露于化合物中 2 小时或 24 小时。使用 FLIPR Tetra系统以每秒约 8 帧的速度采集药物前读数,其中激发波长为 485 nm,发射波长为 530 nm。在不同化合物孵育时间后采集额外的读数,以了解不同化合物暴露时间之间的关系。钙流的记录通常持续约 2 分钟,以获得可靠的数据集。
为了说明 FLIPR Tetra 快速动力学荧光成像在测定3D 细胞模型方面的适用性,我们将心脏细胞球置于几种已知的心脏活性和心脏毒性化合物中,包括 α和 β-受体阻滞剂(异丙肾上腺素、普萘洛尔和维拉帕米)、已知影响 hERG 通道的化合物(卤吡多)和离子通道阻滞剂(利多卡因)。此外,还测试了几种环境毒素,包括杀虫剂(罗滕酮)、阻燃剂(磷酸三苯酯)和其他毒性化学物质。
治疗以剂量依赖性方式显著改变了跳动模式。对照和测试化合物处理的心脏细胞球的钙流(搏动)模式如图 6A 所示。毫不奇怪,化合物处理极大地改变了剂量依赖性分子的跳动模式(图 6B)。然而,将 3D 细胞球培养物测定的 IC50值与以传统 2D 形式铺板的细胞获得的细胞显示出测定灵敏度的显著差异,其中 3D 培养物在反应方面显示出一般的右移趋势(即 IC 值更高)(表 2)。与传统的 2D 培养形式相比,降低对这些测试化合物的心脏细胞球敏感性是否更具预测性,将需要额外的跟进。尽管如此,这些结果表明,将小型 iPSC 源性心脏 3D 细胞模型与快速动力学荧光成像相结合,以支持高通量心脏毒性筛选的潜在效用。
化合物 | 3D IC. (pM) | 2D IC. (pM) |
2 小时 | ||
异丙肾上腺素 | 0.003 ± 0.001 | 0.003 ± 0.003 |
地高辛 | 0.31 ± 0.042 | 0.027 ± 0.24 |
氟哌啶醇 | 4.24 ± 6.31 | 0.731 ± 0.155 |
维拉帕米 | 19.5 ± 3.6 | 0.744 ± 0.77 |
利多卡因 | 48.15 ± 9.76 | 4.5 ± 8.05 |
24 小时 | ||
异丙肾上腺素 | 0.0002 ± 0.0012 | 0.00082 ± 0.00088 |
地高辛 | 0.017 ± 0.0003 | 0.003 ± 0.005 |
维拉帕米 | 1.62 ± 3 | 0.71 |
氟哌啶醇 | 1.25 ± 3.5 | 1.045 ± 0.21 |
利多卡因 | 27.3 ± 10.8 | 4.52 ± 9.12 |
缬氨酸霉素 | 0.123 | 0.073 ± 0.00051 |
氯化小檗碱 | 2.61 ± 0.68 | 0.894 ± 0.257 |
氚酮 | 0.131 | 0.051 |
甲基汞 | 6.41 | 0.972 |
Deltamethrin | 33.4 ± 9.09 | 6.92 ± 1.54 |
磷酸三苯酯 | 15.3 ± 11.9 | 7.23 ± 9.32 |
磷酸三苯甲基酯 | 14.8 ± 10.8 | 12.4 ± 11.4 |
四辛基 | 33.5 | 14.98 |
沙利度胺 | 无毒物< | |