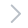诚信认证:
工商注册信息已核实! 扫一扫即可访问手机版展台
扫一扫即可访问手机版展台
IPSC衍生的3D神经共培养物中神经毒性和神经活性化合物效应的功能评估
| 领域: | 细胞生物学 | ||
| 资料类型: | 其他资料 | ||
| 资料文件名 | 下载 |
|---|---|
IPSC衍生的3D神经共培养物中神经毒性和神经活性化合物效应的功能评估 |
下载此篇资料 |
简介
人们对使用更复杂、更具生物相关性和预测性的细胞水平平台来开发检测和筛选化合物的兴趣日益增加。StemoniX® microBrain® 3D Assay Ready 板是一个高通量 3D 培养平台,更接近于天然的人类大脑皮层组织的发育和构成。每个细胞球均由活性皮质谷氨酸和 GABA 能神经元的混合物组成,这些神经元与来自单个供体来源的星形胶质细胞共同成熟。这种平衡的细胞混合物允许开发富含突触的神经网络,从而形成一个功能强大的神经元电路。microBrain 3D 细胞球中的神经细胞具有生理活性,自发性、同步神经元活性可作为钙振荡进行检测。
在 FLIPR® Tetra 高通量筛选系统上使用快速动力学荧光成像来测量神经球的钙振荡模式和频率,通过钙敏感染料监测细胞内钙水平的变化。测试了一组已知的神经调节剂,包括 NMDA、GABA 和 AMPA 受体的激动剂和拮抗剂,以及花生酸、镇痛药和抗癫痫药。随着振荡模式的抑制或激活,观察到变化,并与每种神经调节剂的预期效应相关。
我们还测试了一系列神经毒性化合物,包括选定的杀虫剂和阻燃剂,并证明了该检测对化合物效应的敏感性。该检测经过优化,可在 384 孔板中进行高通量筛选,并可通过使用 ScreenWorks Peak Pro软件进行多参数分析来表征神经细胞球中的振荡曲线。
自动测量的读数包括振荡速率、峰值频率、峰值宽度、振幅和波形不规则性。
使用 ImageXpress Micro Confocal 共聚焦高内涵成像系统,通过高内涵成像评估化合物处理对细胞活性和线粒体完整性的潜在影响。测定了不同化合物对 Ca2+ 振荡速率或细胞活性的影响的 EC50 值。在此,我们证明了使用人 iPSC 源性细胞形成的 3D 神经细胞球的功能和形态测定可用于评估候选药物,以及使用钙振荡和高内涵成像进行神经毒性评估。
优势
利用更接近体内环境的高通量 3D 培养平台
表征神经元功能和细胞毒性测定
使用功能、结构和末端终点评估候选药物并评估神经毒性
材料
• StemoniX microBrain 3D Assay Ready 384 孔板(StemoniX,cat. #BSARX-AA-0384)
• Sorvall 离心机
• FLIPR 钙 6 试剂盒(Molecular Devices,cat. #R8190)
• 活性染料 Calcein AM(Invitrogen,cat. #C3100MP)
• 线粒体电位染料 MitoTracker Orange(Invitrogen,cat. #M7510)
• Hoechst 核染料(Invitrogen,cat. #H3570)
• 配备 ScreenWorks Peak Pro 软件的 FLIPR Tetra 系统(Molecular Devices)
• ImageXpress Micro Confocal 共聚焦高内涵成像系统与 MetaXpress 高内涵图像采集和分析软件(Molecular Devices)
利用更复杂、更具生物相关性和预测性的细胞平台
StemoniX microBrain 3D Assay Ready 384孔板由 StemoniX, Inc. 提供。 高通量 3D 培养平台与天然人脑组织的发育和组成更相似。在该平台中,直径约 600 μM 的人 iPSC 源性神经细胞球由生理学上相关的功能活性皮质谷氨酸和 GABA 能神经元(通过 MAP2 识别;绿色)和星形胶质细胞(通过 GFAP 识别;红色)共同培养组成,如图 1 所示。这种平衡的细胞混合物允许开发富含突触的神经网络,从而形成一个功能强大的神经元电路。microBrain 3D 细胞球中的神经元细胞具有生理活性,具有自发的、同步的、易于检测的钙振荡。该高级神经平台已针对 384 孔板中的高通量筛选进行了优化,并在不同的孔和板中显示出高度一致的功能表现。
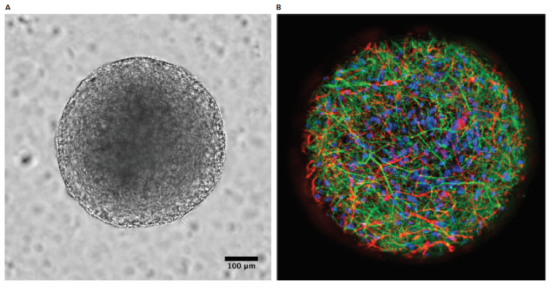
图 1:明场和免疫染色 StemoniX microBrain 3D 细胞球。A) 明场图像。B) 免疫染色细胞球显示活性皮质谷氨酸和 GABA 能神经元通过 MAP2 识别;绿色,星形胶质细胞通过 GFAP 识别;红色,细胞核通过 DAPI 识别;蓝色。使用 ImageXpress Micro Confocal共聚焦系统采集图像。
方法
设置 3D 神经培养物
StemoniX microBrain 板在常温条件下预装。每个孔包含单个大小统一的人 iPSC 源性皮质神经细胞球,成熟 8-12 周。在到达当天,将板以 200 x g 离心 5 分钟,用显微镜检查以确认细胞球沉降到板孔底部,用 70% 乙醇进行除污,不要密封。之后,更换培养基(1/2 体积,三次),将孔板置于 37°C、5% CO2 培养箱中 5-7 天。每两天进行一次培养基更换。
工作流程图如图 2 所示。首先使用透射光对孔进行成像,以验证是否存在细胞球。接下来,将细胞球与 FLIPR 钙 6 染料一起孵育,并在 FLIPR Tetra 系统上对钙振荡进行成像。然后,将细胞与化合物进一步孵育,并染色以测定活性,在 ImageXpress Micro Confocal 系统上进行分析。
使用钙流测定法评估对钙振荡的早期影响
如 Sirenko、Grimm 等人 在20171 年所描述的,使用FLIPR Calcium 6试剂评估神经元胞内Ca2+流。使用 FLIPR Tetra 系统,在 470-495 nm 激发 10 分钟后,以 8 Hz 的频率在 515-575 nm 处测定细胞内 Ca2+ 流动力学。每次读取的曝光时间为 0.05s,增益设置为 2000,激发强度设置为 30%。仪器温度保持在 37°C 恒定。 在初次接触化学品后 60 分钟测量对钙振荡的早期影响。对于早期时间点,在添加化合物之前,用 FLIPR 钙 6 染料预染细胞两小时。通常在添加化合物之前测量不含化合物的钙振荡的基线。对于 24 小时实验,在添加 FLIPR 钙 6 染料之前,将细胞暴露于适当浓度的化学品中 22 小时。再添加 FLIPR 钙 6 染料(4 倍浓度)两小时,添加额外体积的化合物以保持化合物浓度相同。定量数据评估,代表性的数据使用 ScreenWorks 软件可得出峰值计数(每 10 分钟)、平均峰值振幅、平均峰值宽度(振幅为 10%)、平均峰值间距(峰值之间的时间)、平均峰值上升时间(振幅为 10% 至 90%)和平均峰值衰减时间(振幅为 90% 至 10%)等描述。
对活细胞进行染色以评估表型变化
使用三种染料对活细胞进行染色:活性染料 Calcein AM (1 pM)、线粒体电位染料 MitoTracker Orange (0.2 pM) 和 Hoechst 核染料 (2 pM)。为了评估神经特异性标记物,用 4% 甲醛 (Sigma) 固定细胞,并用抗MAP2 和抗 GFAP 抗体 (BD Biosciences) 染色。
使用高通量 3D 成像和分析评估神经毒性
使用带有 10X Plan Fluor 物镜的 ImageXpress Micro Confocal 系统对细胞球进行成像。细胞球检测的方法和采集设置如前所述2。从孔底开始采集由 10-15 μm 分隔的 19 张图像的 z 堆栈,并向上移动以覆盖每个细胞球的光穿透部分(深度约 100-150 μm)。所有单个图像均被保存并用于 3D 分析和 2D 投影(最大投影)分析。使用 MetaXpress® 高内涵图像采集和分析软件中的自定义模块编辑器分析图像。分析方法之前已在 Sirenko, Mitlo 等人于20152 年进行过描述。使用在 MetaXpress 自定义模块编辑器中创建的程序生成针对其他多参数输出的自定义分析。首先,自定义模块分析识别出细胞球。其次,活细胞数量通过 Calcein AM 信号的存在来识别。第三,通过 MitoTracker Orange 染色检测具有完整线粒体的细胞数量。死细胞通过 Calcein AM 信号的缺失或降低来识别。类似方法可用于 3D 图像分析,以评估 3D 中的神经毒性和测量值推导,如 Sirenko、Hancock 等人 20163 年所描述的。

图 2. 利用 3D 培养平台进行动力学和细胞成像分析的多参数工作流程。1) StemoniX microBrain® 3D Assay Ready 384孔板经过培养,然后在 ImageXpress Micro 共聚焦系统上使用透射光观察。2) 将细胞球与钙敏感染料和神经毒性化合物一起孵育。药物处理时,在 FLIPR Tetra 系统上分析振荡速率的变化。3) 使用 ImageXpress Micro Confocal 共聚焦系统对染色的细胞进行功能和活性筛选。
结果
神经调节剂对钙振荡的影响
microBrain 3D 细胞球中的神经元细胞产生自发的、同步的钙振荡。我们在 FLIPR Tetra 系统上使用动态荧光成像来测量神经细胞球 Ca2+ 振荡的模式和频率,通过孵育两小时后 FLIPR 钙 6 染料的细胞内 Ca2+ 水平变化进行监测。测试了一组已知的神经调节剂,包括激动剂和拮抗剂NMDA、GABA 和kainate 受体。用化合物孵育一小时后,在 10 分钟内测定细胞球的钙振荡频率。来自其中六种化合物的振荡模式如图3A所示。注意与对照相比,振荡模式的差异。IC50 值和每种化合物的作用机制如图 3B 所示。
化合物 | 作用机制 | 对钙振荡的影响 (IC., mM) |
对照 | 不适用 | |
红藻氨酸 | 红藻氨酸受体激动剂 | 2.66 |
利多卡因 | Na+ 通道阻断剂 | 9.47 |
GABA | GABA 激动剂和内源性抑制性神经递质 | 5.93 |
CNQX | 红藻氨酸 受体拮抗剂 | 2.05 |
氟哌啶醇 | D2 拮抗剂和 NMDA 亚拮抗剂 | 0.13 |
图 3. 神经活性化合物的评估。A) 在 FLIPR Tetra 系统上评估 10 分钟内钙振荡的样本轨迹。用 FLIPR 钙 6 染料处理细胞球两小时,并用化合物处理一小时。B) 作用机制和 IC5o 值根据 10 分钟内峰值速率的浓度反应曲线确定,采用 4 参数曲线拟合。
神经毒性效应评估
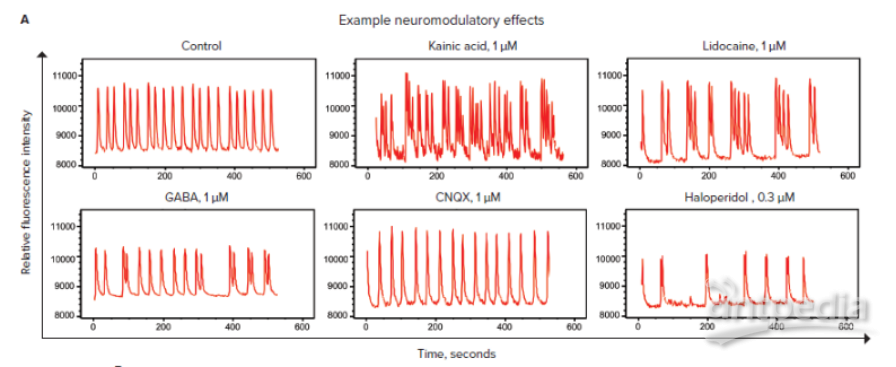
许多工业和环境化学品都报告了对人体的神经毒性作用。此处描述的方法可用于通过评估钙振荡模式和细胞活性的变化来筛选化合物的潜在神经毒性。为了评估神经毒性作用,将神经细胞球与几种已知的神经毒性化合物一起孵育 24 小时,然后加入 FLIPR 钙 6 染料两小时。
在 FLIPR Tetra 系统上测量钙振荡。数据子集如图 4 所示。与对照相比,神经毒性化合物引起钙振荡模式扰动。具体而言,对于用指定化合物处理的样品,观察到峰值频率降低或信号振幅明显更小。
化合物 | 作用机制 | 对钙振荡的影响 (IC50, mM) |
对照 | NA | |
甲基汞 | 生物累积环境毒素 | <0.1 |
鱼藤酮 | 杀虫剂 | <0.1 |
DDT | 杀虫剂 | 3.37 |
狄氏剂 | 杀虫剂 | 3.43 |
五溴联苯醚 | 阻燃、环境污染物 | 4.33 |
图 4. 评估杀虫剂、工业化合物和阻燃化合物的神经毒性作用。A) 由 FLIPR Tetra 系统评估的 10 分钟内的样品轨迹。将一组选定的神经毒性化合物与 iPSC 源性 microBrain 神经细胞球一起孵育 22 小时。FLIPR 钙 6 染料与细胞和化合物一起再孵育两小时。在 10 分钟内记录钙振荡。B) 该表列出了化学类别和 IC50 值,这些值根据 10 分钟内使用 4 参数曲线拟合的峰值速率的浓度反应曲线确定。
使用高内涵成像评估细胞活性和线粒体完整性
共聚焦成像和 3D 图像分析方法用于表征化合物对 3D 神经细胞球形态和活性的影响。为了评估细胞毒性作用,用多种化合物处理细胞 24 小时,然后用 Hoechst 核染料、Calcein AM 和 MitoTracker Orange 染料对活细胞进行染色。然后使用 ImageXpress Micro Confocal 共聚焦系统,通过 DAPI、FITC 和 TRITC 通道以及 10X 物镜对细胞球进行成像。对照细胞球和
用环境毒素甲基汞处理的细胞球如图 5 所示。使用 MetaXpress 软件中的自定义模块编辑器生成成像读数分析。首先,分析识别出细胞球。其次,活细胞数量通过 Calcein AM 信号的存在来识别。第三,通过 MitoTracker Orange 染色检测具有完整线粒体的细胞数量。通过Calcein AM 信号的缺失或减少来识别死细胞。
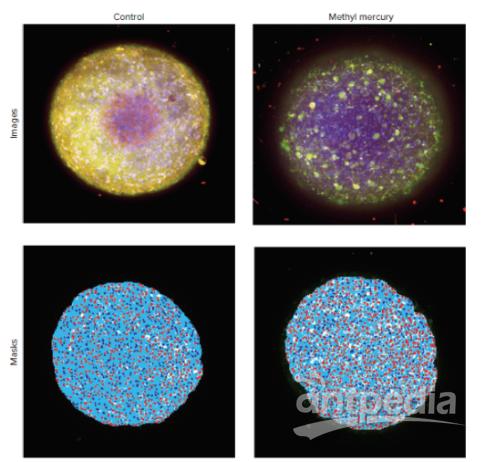
图 5. 对照细胞球和经 1 mM 甲基汞处理的细胞球的最大投影图像。 以蓝色显示的细胞核,以绿色显示的Calcein AM染色,以橙色显示的线粒体染色。下图所示的图像分析掩膜包括细胞球掩膜(白色)、完整线粒体染色阳性的细胞核(深蓝色)、线粒体染色阴性的细胞核(红色)和阳性细胞的细胞质(浅蓝色)。在上述示例中,未经处理的细胞球中有 608 个阳性细胞(具有完整的线粒体)。在用甲基汞处理的细胞球中,阳性细胞的数量降至 228个。
结论
总之,我们证明了神经细胞球对评估神经毒性作用有反应,并可用于评估各种化合物的神经毒性作用。我们还证明,该检测可作为高通量检测形式进行修改,并可用于化合物筛选。
多参数分析可提供信息丰富的读数,从而能够筛选测试化合物对神经元活性以及细胞形态和活力的影响。用于神经毒性评估的表型描述包括钙振荡峰计数、振幅、间距和峰宽,以及 Calcein AM 或 MitoTracker Orange 阳性的细胞数量。可针对不同的读数计算化合物的有效浓度,然后根据化合物的潜在神经毒性危险对其进行排序。该方法用于评估化合物库中的化合物的毒性作用,该库包含不同类别化学品的代表性实例,包括药物、杀虫剂、阻燃剂和多芳香烃。
参考文献:
1. Sirenko, O., Grimm, F. A., Ryan, K. R., Iwata, Y., Chiu, W. A., Parham, F., Wignall, J. A., Anson, B., Cromwell, E. F., Behl, M.,et al. (2017). In vitro cardiotoxicity assessment of environmental chemicals using an organotypic human induced pluripotent stem cell-derived model. Toxicol. Appl. Pharmacol. 322, 60–74.
2. Sirenko, O., Mitlo, T., Hesley, J., Luke, S., Owens, W., and Cromwell, E. F. (2015). High-content assays for characterizing the viability and morphology of 3D cancer spheroid cultures. Assay Drug Dev. Technol. 13, 402–414.
3. Sirenko, O., Hancock, M. K., Hesley, J., Dihui, H., Avrum, C., Jason, G., Carlson, C. B., and Mann, D. (2016). Phenotypic characterization of toxic compound effects on liver spheroids derived from iPSC using confocal imaging and three-dimensional image analysis. Assay Drug Dev. Technol. 14, 381–394.
For additional information, please refer to the following papers
· Sirenko, O., Parham, F., Dea, S., Carromeu, C., et.al (2018). Functional and Mechanistic Neurotoxicity Profiling Using Human iPSC-Derived Neural 3D Cultures. Toxicological Sciences 167(1).
· Anson, B. D., Kolaja, K. L., and Kamp, T. J. (2011). Opportunities for use of human iPS cells in predictive toxicology. Clin. Pharmacol. Ther. 89, 754–758.