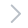诚信认证:
工商注册信息已核实! 扫一扫即可访问手机版展台
扫一扫即可访问手机版展台

解析蛋白酶体与去泛素化酶动态调控机制
| 领域: | 细胞生物学,结构生物学,发育生物学,生物成像,合成生物学,生物安全 | ||
| 样品: | 蛋白酶体26S,去泛素化酶USP14 | 项目: | 大分子与超大复合物互作 |
| 方案文件名 | 下载 |
|---|---|
解析蛋白酶体与去泛素化酶动态调控机制 |
下载此篇方案 |
方案标题:解析蛋白酶体与去泛素化酶动态调控机制
检测样品:蛋白酶体26S与去泛素化酶USP14
检测项目:大分子与超大复合物互作
应用领域: 生物
方案摘要:
北京大学毛有东教授团队通过时间分辨冷冻电镜技术,揭示了与去泛素化酶动态调控人源蛋白酶体(proteasome)的机制,并利用Monolith分子互作仪检测了在有底物和无底物的条件下,蛋白酶体26S与USP14的相互作用。
方案详情:
去泛素化酶USP14是最主要的蛋白酶体调控分子,因此被认为是一个潜力巨大的癌症和神经退行性疾病的靶标。USP14通过可逆结合蛋白酶体26S被激活,剪切底物上的泛素链,然而这一过程速度极快,时间尺度在毫秒到秒之间。因此USP14被蛋白酶体激活并调控蛋白酶体功能的机制,一直是个世界级的科研目标。
为了阐明USP14与蛋白酶体26S之间的调控机制,毛有东研究团队通过大量的条件摸索,优化出一套时间分辨冷冻电镜技术的实验方案。最终获得了含时的45,193张USP14-26S复合体降解泛素底物过程中的冷冻电镜透射图样,挑取了超过300万个USP14-26S-泛素底物复合体的颗粒图像。
接下来,研究团队利用自主开发的人工智能高精度三维分类四维重建技术,捕获了USP14-26S复合体降解多泛素化底物过程的13种不同功能中间状态的高分辨率(3.0~3.6埃)非平衡构象,通过时间分辨冷冻电镜分析,重建了受控蛋白酶体的完整动力学工作周期。
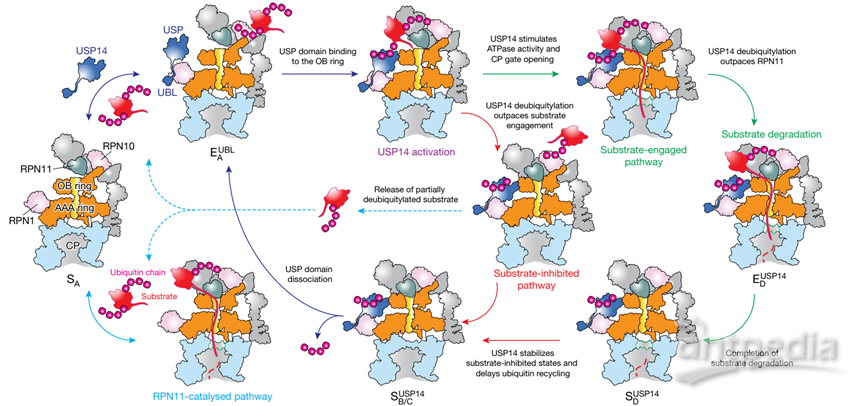
图1 通过时间分辨冷冻电镜分析获取的USP14介导的蛋白酶体功能调控模型
在阐述USP14被蛋白酶体26S激活的机制的过程中,研究团队利用Monolith分子互作仪检测了有底物和无底物的条件下,蛋白酶体26S与USP14的相互作用。结果表明,蛋白酶体与全长USP14在底物Ubn-Sic1PY存在下时,解离常数为43.9 nM(图2 o),是无底物存在时(图2 l)的一半。蛋白酶体与UBL结构域 (图2 m)或 USP结构域(图2 n)的亲和力更低,解离常数分别为137 nM和 135 nM。由此验证了蛋白酶体与USP14及其UBL和USP结构域的相互作用,并且在底物存在时,亲和力增强。
图2 Monolith检测USP14与蛋白酶体结合
Monolith分子互作仪能够检测大分子与超大复合物的互作,并在溶液体系中轻松检测三元互作,仪器操作简单,无需繁琐的清洗维护,可以满足您的互作检测需求!