
诚信认证:
工商注册信息已核实! 扫一扫即可访问手机版展台
扫一扫即可访问手机版展台
最通俗的质谱成像科普 一篇足矣
前言
利用质谱实现分子成像最早是由范德堡大学(Vanderbilt University)的Richard Caprioli等在1997年提出的。作为质谱年轻的应用之一,质谱成像技术在医学研究、生物学研究、药物研究等诸多领域有着很大的价值,已经成为质谱研究的一大热点。基于MALDI、AP-MALDI、DESI、SIMS等离子源的质谱成像技术飞速发展。但是,对于科研工作者而言,如此多的质谱成像技术,究竟哪一种更适合自己的研究方向,很难搞清楚。
选择质谱成像仪器,不能只看它们的理论极限,而是要了解仪器能够体现出来的性能。成像质谱要想发挥最高性能,并不仅仅是一个离子源能决定的,而是从离子源到质量分析器,再到数据采集和处理,达到整体性能的提升,最终才能得到高质量的质谱成像结果。
之前,小融跟大家分享了质谱成像的一些关键问题,时隔半年,我们来重新温习一下,不忘初心,方得始终。
2018年6月,融智生物宣布达成了500像素/秒的MALDI-TOF MS成像速率,一个普通的切片样本,一般只需几十分钟即可完成扫描,使得质谱成像走向临床应用真正成为可能。
在开发成像质谱的过程中,融智生物亦得到了诸多国内质谱成像应用团队的支持和帮助,并且达成了多种合作。到目前为止,包括临床、环境、食品安全、制药等诸多领域的专业团队都已体验了融智生物新一代宽谱定量飞行时间质谱QuanTOF在成像方面的强大性能。而且一些横向比对的结果也显示,QuanTOF在质谱成像的全图像重现能力、成像速率、灵敏度等方面获得了友商无法复制的结果。

融智生物新一代宽谱定量飞行时间质谱QuanTOF
(一)质谱成像,为什么成本那么重要?
在临床病理分析中,已经大量使用了染色或荧光免疫标记的光学成像方法。与光学成像相比,质谱成像是一种无标记的成像方法,可以获得组织切片中多重的分子信息,同时成像成本也具有优势。
但这只是理论上的,比如,一些研究机构使用了低端的50赫兹氮气激光器用于成像,氮气激光器的寿命较短,用于成像,消耗极高,往往做几十张切片就要更换,而更换成本动辄数十万元!因此,即使是“不差钱”的科研领域,也要三思而后切片。
融智生物QuanTOF成像质谱使用了最先进的5,000赫兹半导体激光器,在提高成像速度的基础上也大大降低了耗材成本。理论上,激光器发射功率不会衰减,可以终身使用,因而真正意义上实现了质谱成像的“低成本”。
(二)质谱成像,速率为什么那么重要?
相比目前临床主要的荧光免疫标记成像手段,质谱成像有诸多优势,比如无须染色标记、可一次实现数十至数百种分子的原位分布信息、成像成本低等,但同时,上一代MALDI-TOF MS本身的一些缺陷也导致其难以与荧光免疫成像形成竞争,其中比较主要的因素就是成像速率。
目前,上一代MALDI-TOF MS的成像速率最高为50像素/秒,即每小时大约可获得50×60×60=150,000张质谱图,而一般的高分辨质谱成像动辄需要上百万张质谱图的拼合,这意味着一张切片的成像时间往往在6小时以上。即使有自动进样装置,上一代MALDI-TOF MS每天也只能处理1-2张切片,这样的成像效率,也就只能发发科研论文,至于临床实际应用,几乎没有价值。
这还不是最严重的。我们知道,MALDI-TOF MS是对真空要求最高的质谱仪,样品是进入真空仓后开始离子化的。在真空状态下,几小时过去,样品切片上的分子会不会挥发,会不会代谢降解,切片的前半部分和后半部分如何保持一致性?
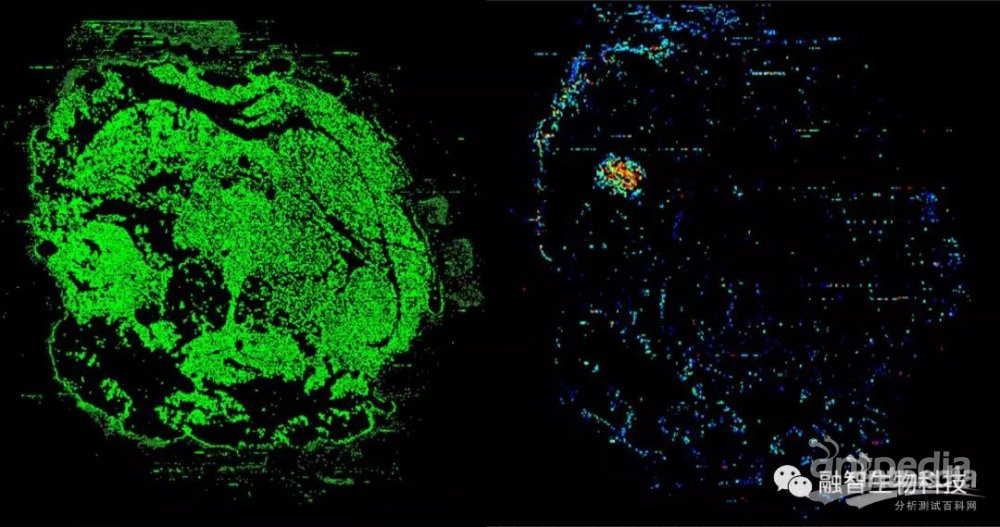
小鼠后脑成像(空间分辨率10微米,500像素/秒, <60分钟)
把成像速率提升到500像素/秒后,QuanTOF每小时可生成1,500,000张质谱图,大多数临床样本都可以在一小时以内获得结果。一位客户使用友商成像质谱制作了四张切片,花费了近4天时间,而在融智生物,早晨送来切片,当天下午,四张质谱图已制作完成。
(三)质谱成像,重现性为什么那么重要?
众所周知,上一代MALDI-TOF MS的重现性不佳(RSD>30%)。影响MALDI-TOF MS重现性的因素非常多,追根究底,是上一代MALDI-TOF MS在设计时,就留下了诸多性能遗憾。这些因素的叠加,导致传统观点认为MALDI-TOF MS不是可以定量的质谱仪,因而目前MALDI-TOF MS的主要应用集中于定性测试,比如微生物鉴定、核酸分型分析等。
上一代MALDI-TOF MS较差的重现性会对质谱成像有哪些影响?
首先,影响MALDI-TOF MS重现性不佳的原因之一是靶板的边缘电场效应。上一代MALDI-TOF MS的靶板带有几万伏的高压,因而会形成靶板不同位置的电势差异。一些友商会通过软件校正等方式,意图弥补这些差异,提升重现性,但显然作用不大,上一代MALDI-TOF MS要想实现定量能力,仍然得需要同位素标记等方法。但这些方法操作繁琐,成本高,根本无法完成普通场景的应用。而对于靶板的电场不均一性问题,表现出来就是同一切片的不同部位(相当于靶板的不同靶点)获得的结果无法保证均一。那么,这张切片的成像质量,从何说起?
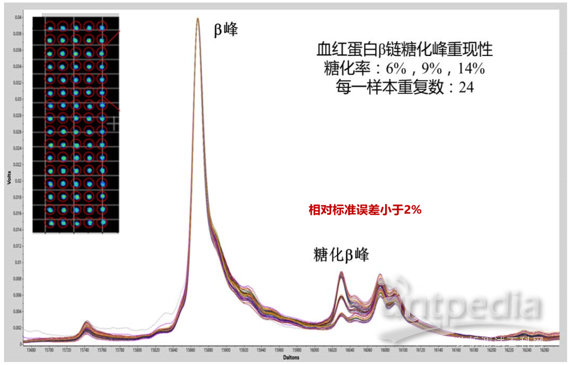
QuanTOF的靶板接地技术去除了靶板的边缘电场效应,72个不同靶点质谱图叠加RSD<2%
其次,影响MALDI-TOF MS定量能力的因素是上一代MALDI-TOF MS一系列的设计遗憾造成的,这些遗憾的叠加形成了人们对MALDI-TOF MS只能定性的判断。因而在质谱成像分析时,只能获得定性结果。但在临床应用中,定性分析远远不够,主流需求仍然要解决定量问题,尤其是在成像的同时完成定量分析。
(四)质谱成像,为什么宽谱能力那么重要?
质谱成像的优势之一是一次可以观察数十、数百甚至更多分子的二维空间分布信息。而上一代MALDI-TOF MS为了实现较高的质量分辨率和灵敏度,采用了“聚焦质量”的技术,即其在一个指定的质量数范围内,才能获得高性能的质量分辨率和灵敏度,在该质量数范围之外,质谱仪的分辨率和灵敏度会呈指数下降。虽然MALDI-TOF MS被称为生物质谱,但其在测试抗体蛋白等大分子时也无能为力。
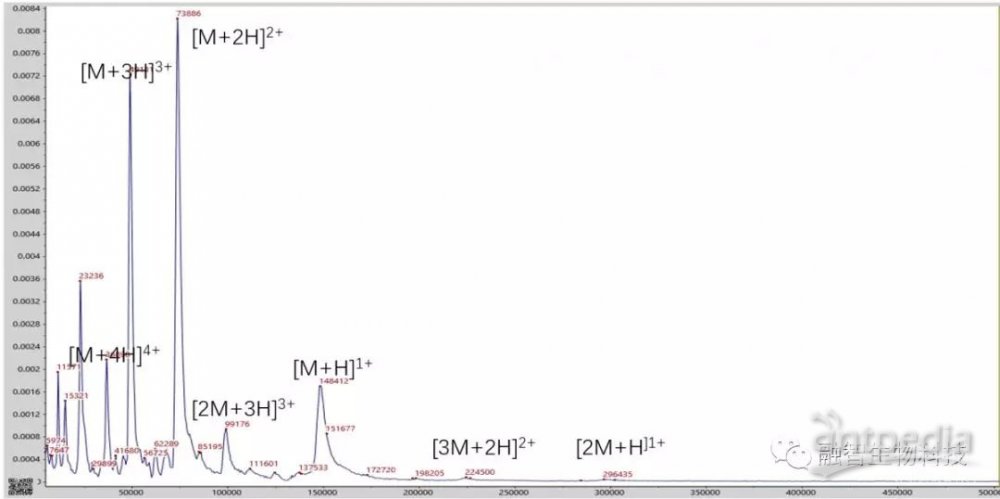
即使是超过20万道尔顿的分子,仍然保持高灵敏度
QuanTOF通过一系列技术改进,使其真正实现了在宽质量数范围也能达到较高的灵敏度,从而保证了在宽质量数范围同样能够完成测试,能更好地表达切片的信息。
空间分辨率和质量分辨率
质谱在成像时,有两个“分辨率”概念,一是“质量分辨率”,另一是“空间分辨率”。前者是所有质谱仪都具备的重要性能参数,质量分辨率决定了质谱仪区分出两个质量相近离子的质量最小差。而后者则是质谱成像中使用的概念,指成像最小像素的直径大小。
空间分辨率为什么这么重要
在质谱成像中,空间分辨率是很关键的仪器性能,就像显微镜的放大倍数,它决定了我们能看到的最小空间。在分子成像中,会越来越多地研究基于细胞,甚至细胞不同部位的分子分布情况,因而突破质谱成像的空间分辨率极限尤为重要。
空间分辨率的极限
各种成像技术中,SIMS(二次离子质谱)能够达到最高的空间分辨率(100nm),但这种成像方式电离能量大,产生的离子容易断裂产生碎片,只适合进行小分子成像,而生命科学研究的主体是大分子成像,因此SIMS使用并不普及。
基于DESI(解吸电喷雾电离)的质谱成像,难以控制喷雾面积,因此这种技术的空间分辨率较低,一般多在几十微米以上。
不同质谱成像技术对比
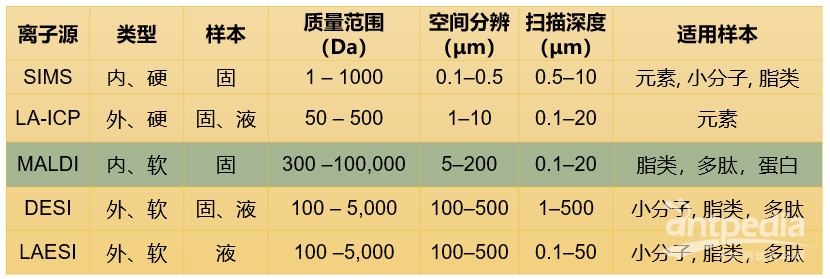
理论上,基于激光扫描电离的质谱成像(如AP-MALDI 、MALDI)空间分辨率的物理极限大约为激光波长的一半。以355nm的氮气激光器为例,其理论空间分辨率最小可达175nm左右。但这只是理论水平,要想把激光斑点缩到这么小,不仅要对激光的光路系统进行复杂的工程改造,还要保证在如此小的激光斑点下实现样品离子化,这是极其困难的事。所以,目前已经商品化的仪器中,一般只能做到5微米的激光光斑直径。融智生物基于新一代宽谱定量飞行时间质谱技术,目前已经实现了商品化仪器最高5微米的空间分辨率,并已经在原理装置中实现了1微米的空间分辨率。
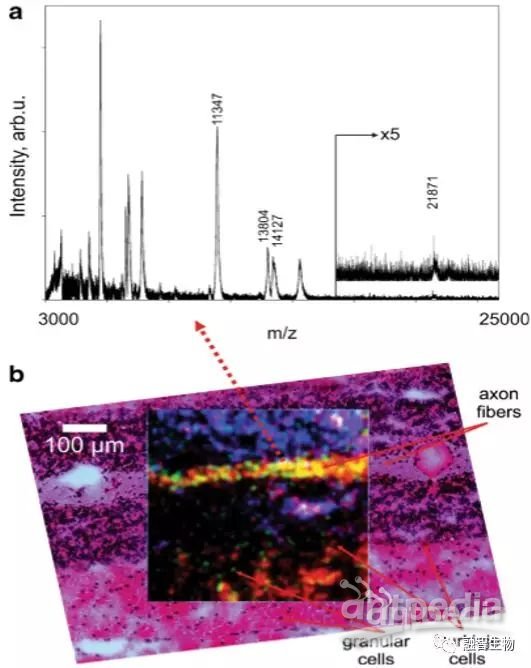
基于1微米空间分辨率的MALDI-TOF MS质谱成像结果(步长:2.5微米)
激光扫描电离空间分辨率的限制因素有哪些?
质谱成像的应用主体集中于生命科学领域,生命科学领域主要进行生物分子成像研究,因此,基于激光扫描电离的软电离方式更适用于质谱成像,这也是当前主流的质谱成像技术。在此,我们着重讨论限制激光扫描电离的空间分辨率因素。考虑到质谱成像软件往往可以通用化,因此本文不讨论质谱成像软件对空间分辨率的影响。
(1)扫描光斑大小
激光扫描光斑是决定质谱成像空间分辨率的基础。基于激光扫描电离的质谱成像技术主要有MALDI和AP-MALDI两种,这两种技术理论上都可以使激光光斑大小调至更小,比如,在工程化方面,都可以做到1微米激光光斑。
(2)灵敏度
当激光光斑变小之后,激光每次照射的样本面积也变小,对质谱仪整体的灵敏度就提出了严苛的要求。因此,即使实现了激光光斑面积足够小,如此小的激光光斑面积是否能够使足够的样本离子化,是否能够被离子探测器识别,都是限制实质空间分辨率的重要因素。
AP-MALDI与MALDI离子源的主要区别是在于离子源所处的位置。AP-MALDI是外接离子源,它可以任意连接在各种质量分析器上,实现质谱成像,足够灵活,但这种常压外接离子源在离子向高真空传输过程中会丢失大量离子,即使使用了离子漏斗技术,也只有不到1%的离子能够进入质量分析器,因而大大影响了其灵敏度。当激光光斑变小时,灵敏度问题会更加突出。因此,要想使用这种常压离子源实现高空间分辨率的成像,在实际上非常困难。
(3)二维移动平台
基于激光扫描电离的质谱成像,需要二维移动平台的配合。在质谱仪中,激光路径一般是固定不动的,移动的是二维移动平台。在质谱成像中,高速率、高精准的二维移动平台控制才可能形成机械上的高空间分辨率的成像效果。举个例子:假如我们用5微米的激光光斑,但二维移动平台的移动步长(每移动一次的精度)只有10微米,则最终的质谱成像结果也只能达到10微米,甚至更低。
(4)离子探测器和数据采集效率
离子源解决的是质谱成像的原位离子化问题,而要想完成成像,这些离子必须被精准、快速识别,这就涉及到离子探测器探测能力和数据采集效率的问题,及所谓的占空比。不同的质量分析器原理不同,数据采集效率也不一样,占空比也就不同,外源性离子源,比如AP-MALDI输出的离子是否能够达到离子源所标称的空间分辨率,还需要与其对接的质量分析器的数据采集相配合。在与各种质量分析器的组合中,仅仅一个离子源的扫描速度与空间分辨能力并不能解决全部问题。
综上所述,在质谱成像的空间分辨率方面,由于受到机械分辨率、激光斑点大小、扫描速度、数据采集速度等多方面的因素制约,理论值与实际成像结果往往是有差异的。就目前而言,适用性强、效果好的质谱成像,仍然以MALDI离子源为主,特别是对低丰度的生物组织成像,则以MALDI-TOF MS最为适用。
灵敏度是决定质谱仪检测极限的关键性能指标,它意味着质谱仪最少能发现多少离子(通俗地说,就是探测到多少个离子之后能够形成质谱图出峰)。对于质谱成像而言,我们不仅要研究高丰度分子成像,在很多应用中,比如癌症细胞分型研究中,我们还要研究低丰度生物标志物,这就对质谱仪的灵敏度提出了要求。
决定灵敏度的因素有很多,这里只谈谈比较关键的因素:
离子化效率
质谱仪的两大核心结构,一是离子源,作用是将样本气化和电离;一是质量分析器,把质荷比不同的离子分开,并检测到。
所谓离子化效率就是能够将样本离子化到什么程度。只有将足够多的样本分子离子化,才能更方便地被离子探测器检测到。
离子源发展至今少说也有上百种,最后被市场认可的离子源,离子化效率都比较高。但不同的离子源针对的范围不同。比如MALDI,在有合适基质时,其能保证无论大分子还是小分子,都能实现非常高的离子化效率,这也是MALDI拥有高灵敏度的原因之一。因为原理相似,AP-MALDI的离子化效率也能得到很好的保证,并且在小分子离子化方面尤其出色。而DESI、SIMS等离子源,则在小分子离子化方面优势明显,在大分子方面,离子化能力较MALDI差。
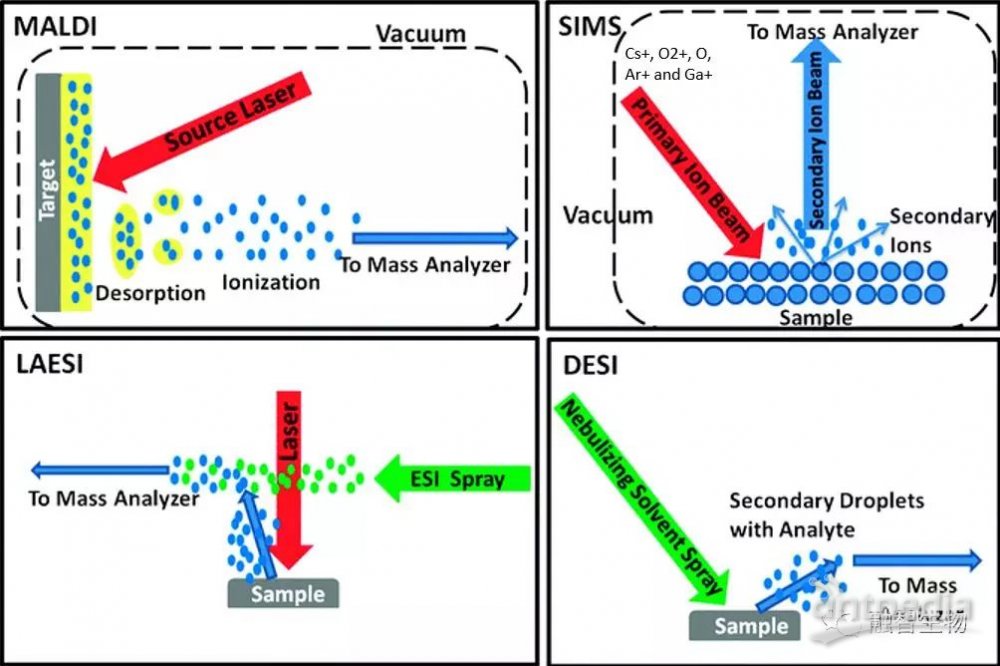
常见的质谱成像离子源
离子传输效率
离子源把样本气化和离子化之后,这些离子要想办法导入到质量分析器中。作为内源(真空中)MALDI所生产的离子由于是在质谱仪内真空环境下产生,离子传输效率较高,而外源性离子源,如AP-MALDI、DESI等,在大气环境下生成的离子需要传输入真空环境,往往只有1%以下的离子被传输到质量分析器中,对质谱成像技术的灵敏度产生很大的影响,只能依靠与其相配合的质量分析器的能力弥补。比如,我们常见AP-MALDI连接离子阱质谱仪,能够实现较高的质量分辨率,并且通过较长检测时间实现较高的灵敏度,但会在质谱成像的速率上大打折扣。
基质(杂质)干扰
质谱仪是高精密的仪器,它是分离物质的极限,这种极限是基于样品足够干净的基础上的,所以我们常见到色谱-质谱联用等技术,就是先期对样品中的基质去除,然后对相对纯净的目标物进行分离。
质谱成像中,基质干扰同样会困扰质谱仪本身。质谱成像是对生物组织样本进行原位分析的技术,其样本的净化、提纯等前处理过程较少,意即没有了色谱分离的帮助,因而基质干扰会对质谱成像的灵敏度有较大的影响。一些抗基质干扰能力较弱的质谱仪,比如离子阱质谱,在质谱成像时表现出的抗基质干扰能力会比较差。
离子探测器
如果把质谱仪的工作流程看作流水线,离子探测器相当于流水线的最后一道关口:质检。只有前面的各个环节做得足够好,质检环节才能轻松些,否则,离子探测器也会无能为力。
不同类型的质谱仪使用了各自的离子探测器技术,以适配质谱仪流水线。这些离子探测器的工作方式和探测能力,将极大地限制质谱成像的灵敏度。一般而言,普通质谱仪的离子探测器主要为常规分析服务,并没有考虑到质谱成像的特殊需求,如果连接了外接离子源,往往无法达成高性能成像(通俗地说,就是理论上标称的内容,实际上根本看不到)。而内置离子源的质谱仪,如果是专为成像而制作,其会充分考虑质谱成像的需求,匹配适合的离子探测器和数据采集器,从而达到高灵敏探测的效果。比如融智生物的QuanTOF质谱成像系统,使用了光电混合离子探测器和瞬态数字转换器,从而大幅提升了离子探测器检测离子的灵敏度。
综上,对于科研工作者而言,找到一台适合自己的质谱成像仪器,不能光看它们的理论极限,而要看仪器能够体现出来的性能。成像质谱要想发挥高性能,并不是一个离子源能决定的,而是质谱仪从离子源到质量分析器,再到数据采集和处理,达到整体性能的提升,最终才能得到高质量的质谱成像结果。目前,质谱成像发展时间尚短,一些质谱成像部件因为价格便宜、装配灵活,从而适合科研人员快速装备和开展研究。但在将来,质谱成像一定会向高性能整机、成套解决方案的方向发展。
目前的质谱成像技术都是把样本上的一个个像素点陆续离子化形成质谱峰图,再通过软件重构图像形成质谱成像结果。这种点扫描的成像方式,如果成像速率过低,完成一张切片的成像过程需要十数个小时。无论是科研研究还是临床病理分析等实际应用,这么慢的成像速率都是无法忍受的。更重要的是如果一张切片成像需要近一天时间,生物组织及基质分子的挥发、变质等问题都会影响整体成像结果。因此,成像速率是质谱成像重要的瓶颈,尤其制约了质谱成像展开临床应用。
那么,影响质谱成像速率的因素有哪些呢?
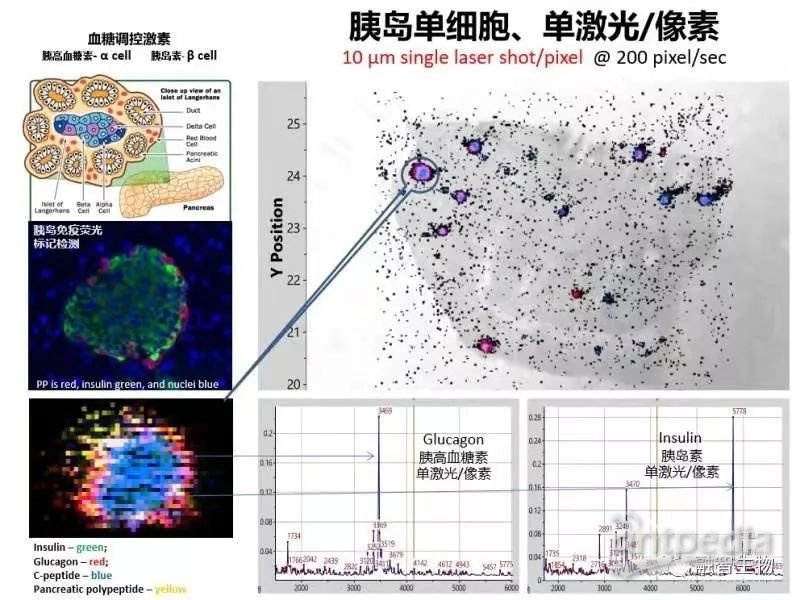
胰岛单细胞成像结果,成像速率:200像素/秒
关键之一:扫描速率
对于质谱成像而言的扫描速率,通俗地说,是获得一张质谱图的速率。它一般取决于以下三个因素。
(1)激光频率
如前所述,质谱成像是点扫描方式成像。因此,对于激光解吸(LD)离子源来说,激光频率是质谱成像速率提升的前提。以MALDI成像为例,早期的质谱成像采用了50Hz的氮气激光器,且不说氮气激光器做质谱成像是很奢侈的事(氮气激光器扫描寿命短,而质谱成像需要高密集扫描,更换激光器成本昂贵),50Hz意味着每秒钟只能完成50次离子化过程,最高可形成50个扫描点。一般一张质谱图需要上百万个扫描点,用氮气激光器扫描一张切片,至少需要6小时以上。
随着高性能激光器的出现,MALDI离子源的激光频率首先有了质的飞跃。目前商品化的成像质谱中,往往采用了2,000Hz甚至更高频率的激光器。融智生物的QuanTOF成像质谱则配备了5,000Hz的激光器,以保证有更高的激光频率。
(2)二维移动平台
高速成像还需要能高速移动、步长精准的二维移动平台的支持。目前,很多普通质谱仪并未考虑到质谱成像的需求,使用了普通的二维移动平台,步长往往在微米级甚至更高,也无法高速移动,因而会阻碍高速成像。融智生物QuanTOF采用的高速二维移动平台可达到步长50nm,在如此小的步长下,实现高速移动,有力地支持了高速率质谱成像的需求。
(3)数据采集
在解决了激光频率和高速、高精准二维移动平台的问题之后,还要解决高激光频率带来的海量数据采集问题。再高的激光频率、再快的移动平台,没有足够速率的信号采集及储存能力,都无法提高最终质谱成像速率,这需要高速数据采集部件以及数据采集软件的相互配合。另外,现有的第三方成像软件往往只能满足较低速率采集的成像数据处理工作,对于高速扫描带来的海量数据就无能为力了。
关键之二:灵敏度
仅仅提升扫描速率,只是提升质谱成像速率的开始。高速、高空间分辨率扫描时,能够电离的离子将大幅减少,如果在其后的离子传输、离子探测过程中不加以弥补,则质谱仪的灵敏度将大幅下降,尤其影响低丰度目标物的成像结果。传统的化学分析中,质谱仪的扫描速率已经够用,因此后端的配合流程不会为高速成像专门设计,所以一些科研人员在采购外接离子源做质谱成像时,会发现对低丰度目标物无法采集到信号。
灵敏度问题不仅体现于外接离子源中,对于内接离子源质谱仪,在高速扫描时,也面临灵敏度不足的问题。提升扫描速率,使用10,000Hz的激光器,在工程化方面不是难题,但如此高频率扫描所带来的离子采集量下降影响到灵敏度不足的问题,却难以克服。因此,只能牺牲成像速率,以保证成像质量。这也就是为什么一些内接离子源的成像质谱虽然采用了10,000Hz激光器,但成像速率最高仍然只有50像素/秒。
综上所述,高速质谱成像的实现是一项系统性工程,要从扫描速率、仪器灵敏度以及方法学等方面入手,软硬件之间相互配合,相互支持。仅仅提高激光频率或二维移动平台移动速度或数据采集速度,抑或是提升仪器灵敏度等,都无法实现高速质谱成像。
2018年6月,融智生物宣布实现了成像速率达到500像素/秒。通过对系统的进一步优化、调整,以及软件配合,截至目前,融智生物已达成1,000像素/秒的成像速率。采集100万张质谱图,只需要十多分钟。
质谱成像应用目前集中于科学研究。随着质谱成像速率的提升,应用研究的开展,包括富集技术的进步、基质技术进步,以及与荧光光学成像结合进行分析的融合技术的出现,质谱成像在临床病理分析、生物标志物发现等诸多领域的应用都会加速。
对于MALDI-TOF质谱成像技术来说,样本制备过程是影响质谱成像结果真实性和准确性的关键环节。样本处理方法和技术与待测物自身的性质、所处的样本类型和状态密切相关。
首先来看一看切片制备流程。不同样本的切片制备流程会稍有不同,详细过程在这里就不赘述了,直接上图。
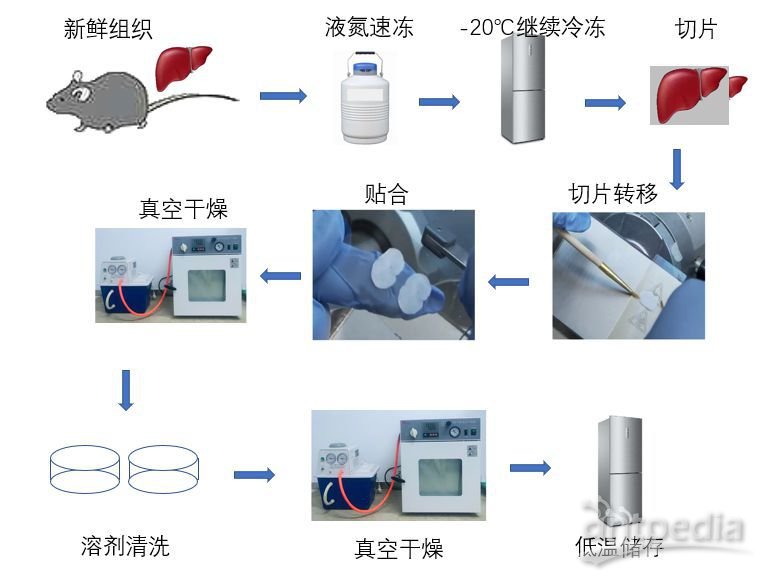
MALDI-TOF质谱成像切片制备流程示意图
组织切片的制备关系到MALDI-TOF质谱成像结果的真实性和准确性,所以切片制备过程一定要认真仔细,要注意以下事项:
➢ 为了很好地维持细胞的形态和细胞内可扩散离子的空间分布,避免待测物的移位和降解,样本一经收集应迅速固定。最常用的固定方法是快速冷冻,通常采用液氮进行。人体皮肤直接接触液氮超过2秒会冻伤且不可逆转,做实验的小伙伴们一定要注意安全哦!
➢ 经液氮冷冻的组织过于脆硬,不宜直接切片。需将液氮冷冻后的组织样品放在-20ºC 冰箱或-80℃低温冰箱冷冻1小时以上。

➢ 组织样本不能用OCT(optimal cutting temperature compound,是一种聚乙二醇和聚乙烯醇的水溶性混合物)等包埋试剂包埋,会产生杂峰,影响质谱结果。
➢ 切片之前,要先用乙醇擦洗冷冻切片机的刀片,除去先前实验可能残存在刀片上的OCT等杂质,这个就不用多说了吧。
➢冷冻切片机切片,温度控制在-16℃~-26 ℃,一般组织密度越大,切片温度越高。切片的厚薄要适当,切片过薄,容易在转移过程中撕裂;切片过厚,则不利于清洗除去一些对离子信号有干扰的物质,且导电性差。
➢ 组织切片须放置在ITO载玻片涂有导电材料的一面,千万不要放错啊!因为MALDI-TOF是靠电场作用将离子送入飞行管的。ITO(Indium-Tin Oxide,氧化铟锡)载玻片,一面镀有导电的ITO膜,是这样婶儿的:

ITO载玻片
➢ 样本转移至载玻片后,需立即进行干燥处理以保持样本稳定。常用的干燥方法有冷冻干燥、真空干燥、溶剂脱水干燥和氮气吹干等。
➢ 干燥后的样本一般可直接进行质谱分析,复杂样本中特定待测物的检测常需采用溶剂清洗、表面酶解和化学衍生化等对分析表面进行适当处理,既能起到脱水固定作用,还能显著改善质谱测定结果。溶剂清洗后,需要再次进行干燥处理。
➢ 将每个制备好的样品玻片分别放入一个载玻片盒或是50mL离心管中低温保存。如需长期保存,需置于-80℃环境。
此处省略一万字……
总之,样品前处理是质谱成像的基础,前处理做好了,才会有比较好的质谱成像结果。切片制备虽然简单,但还是需要实验人员细心、耐心,另外还得有一颗热爱科研的心。

在过去几十年中,基质辅助激光解析电离(MALDI)质谱成像技术已被广泛应用在生物标志物发现和药物研发等多个领域。然而,在MALDI质谱成像的技术操作中,要想获得质量高、重复性好的质谱结果,并没有那么容易。目前,仍然有诸多因素制约着这一技术的应用和发展,其中基质喷涂便是“瓶颈”之一,要尽可能的满足组织切片上的待测物无扩散或移位现象,基质能与组织表面分子形成良好的共结晶,协助目标分子的高效电离。
基质喷涂技术是利用喷涂装置将具有特殊物理化学性质的化合物喷涂在组织切片上,该类化合物喷涂后应均匀的分布在组织切片表面,且其颗粒大小越小越好。有研究表明基质在组织切片上分布的均匀度、结晶度和晶体颗粒的大小等因素是决定质谱成像质量的关键因素。
目前,MALDI质谱成像研究中主要采用的基质附着装置有手动喷枪,基质升华仪器,全自动喷涂仪等。

手动基质喷枪
空气喷枪是最早使用的基质喷涂方法,其原理是当基质流入枪膛后,利用压缩空气携带其喷涂至组织表面或被分析物的表面。这种装置结构简单,维护容易并且喷涂速度快。缺点是,由于该方法主要采用人工手动操作,每次喷涂的均匀度、厚度不一,基质结晶颗粒较大,重复性差。

基质升华仪器
真空升华装置是一种无需溶剂的喷涂基质方法,可以将基质均匀地覆盖在组织表面。其原理是利用固体物质在高真空条件下升华点降低的特性,在高真空密闭容器内加热这些物质,使其快速升华,附着至被测组织表面,从而形成均匀的基质层。真空升华装置结构简单,形成的基质结晶颗粒较小且均匀,避免了被测分子在喷涂基质及结晶过程中的移位。但是,由于该装置是基于物质分子升华的原理,因此,具有高升华点的基质分子难以利用该装置进行喷涂,且基质喷涂的量难以控制。

全自动基质喷雾仪
全自动基质喷雾仪是将基质液滴均匀喷涂在组织切片表面,液滴干燥后形成均匀的固体结晶膜。基质喷雾仪通过喷嘴可以产生细腻的溶液喷雾,得到的液滴更小,形成的基质结晶直径小,具有高空间分辨率和高重现性的特点。缺点是,雾化喷头易堵,且喷涂基质所用的时间相对较长。
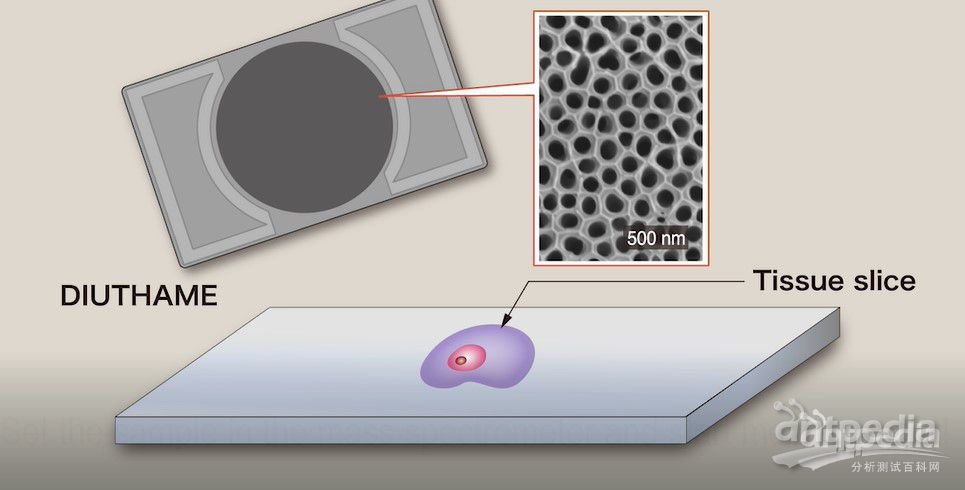
离子化辅助基板
虽然,基质附着装置技术越来越先进,基质喷涂所耗时间越来越短,但是在MALDI质谱成像前处理阶段,基质的调和、涂布、干燥等流程共耗时约30分钟,且要求基质在待测样品上涂布均匀。
为了减少样品前处理时间,提高MALDI质谱成像的分辨率和重现性,很多研究人员将精力集中在研究免基质质谱成像方面。通过纳米技术,将低丰度生物小分子、蛋白等进行选择性富集,建立免基质的MALDI-MS检测方法。还有人研究出了新型的离子化辅助基板,该基板使用多孔纳米材料开发,原理是利用毛细作用使待测样品的分子上升到表面,通过激光照射使其离子化而不破坏分子结构,实现质谱成像分析。离子化辅助基板能够大幅缩减质谱成像分析样品前处理时间,且操作简单。但是,目前离子化辅助基板只适用于小分子分析物。
总之,不论是切片还是基质喷涂,样品前处理对MALDI质谱成像来说都非常关键,省时、省力,能大幅提高MALDI质谱成像分辨率和重现性的样品前处理方法,还有待各位有志之士去开发!
(完)
| 标签: | 质谱成像 MALDI-IMS MALDI-MSI |





