
上海中科新生命生物科技有限公司
诚信认证:
工商注册信息已核实! 扫一扫即可访问手机版展台
扫一扫即可访问手机版展台
抽丝剥茧!Cancer Cell: 激酶组+磷酸化蛋白组揭示小细胞肺癌治疗的潜在靶点

每年全球有20万人死于小细胞肺癌(SCLC)。SCLC肿瘤具有独特的生物学特性,增殖和转移潜力很高且预后差。SCLC肿瘤的DNA和RNA测序鉴定出的可治疗的靶标很少,因此寻找SCLC治疗靶点变得尤为重要。
2020年7月,美国斯坦福大学Julien Sage团队在《Cancer Cell》(IF=26.6)上发表了题为"Unbiased Proteomic Profiling Uncovers a Targetable GNAS/PKA/PP2A Axis in Small Cell Lung Cancer Stem Cells"的研究论文,利用激酶组、RNA-seq、互作组、磷酸化蛋白质组等方法确定蛋白激酶A(PKA)和PKA信号通路中的分子是小细胞肺癌起始和进展的关键调节剂,可作为SCLC潜在治疗靶点。

1. 激酶组:3种SCLC患者来源的异种移植模型(PDXs)、8种同种异体移植模型(从自体小鼠模型中分离出来)、非小细胞肺癌(NSCLC)样品(2种肺腺癌PDXs、1种鳞状肺癌PDX和4种单肿瘤来源的同种异体移植模型)、正常鼠肺组织;
2. RNA-seq:临床样本:81例SCLC肿瘤;PDX模型:NJH29-GFP+Dox组和NJH29-aPKA+Dox组
3. 互作组:NCI-H446细胞,PKA-Cα、PKA-Cβ和PKA-R1A分别拉下来的蛋白复合物;
4. 磷酸化蛋白质组:NCI-H526细胞和NCI-H69细胞;cAMP的长效类似物(8-Br-cAMP)处理组和对照组。
激酶组,RNA-seq,互作组、磷酸化蛋白质组
实验路线图

1. 激酶组:筛选活性激酶,锁定目标PKA
使用多重抑制剂珠(MIB)柱来富集SCLC中的活性激酶,将3种SCLC患者来源的异种移植模型(PDXs)和8种同种异体移植模型(从自体小鼠模型中分离出来)与非小细胞肺癌(NSCLC)样品(2种肺腺癌PDXs、1种鳞状肺癌PDX和4种单肿瘤来源的同种异体移植模型)进行了比较,正常鼠肺用作对照。确定了20种在SCLC中比在正常肺或NSCLC中更有活性的激酶,其中,PRKACA编码PKA-Cα(PKA催化亚基α)。结合激酶的功能和已有的研究报道,作者将目标聚焦到PKA。进一步利用RNA-seq、组织芯片和免疫印迹等技术证实PKA在人类SCLC中表达并活跃。
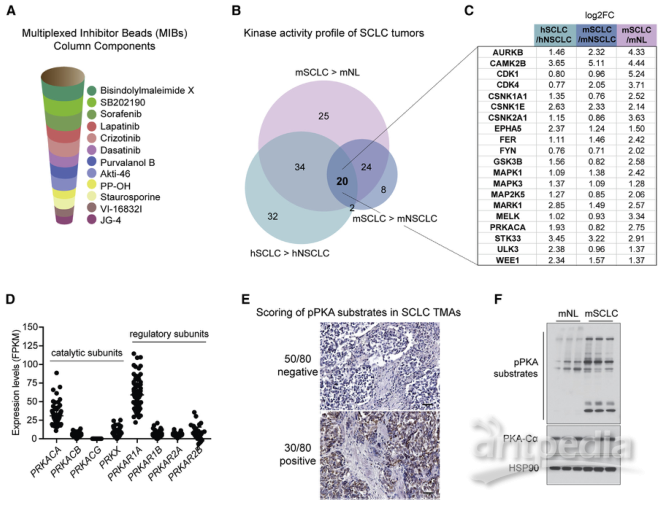
MIB 激酶组分析可识别SCLC中的PKA和其他活性激酶
2. PKA功能研究:SCLC的增长需要PKA
将TKO小鼠与Prkaca条件等位基因敲除小鼠杂交,获得PrkacaM120A小鼠,与对照TKO小鼠相比,PrkacaM120A小鼠显著抑制了SCLC的发展。在两个模型中,PKA-Cα的表达相似,但在PrkacaM120A小鼠中,PKA活性降低了约50%。因此,在此小鼠模型中,PKA-Cα活性降低一半足以有效抑制SCLC的发育。敲低PKA-Cα可导致25种人类SCLC细胞系生长下降,NCI-H526细胞中PKA-Cα的敲低导致小鼠细胞凋亡的增加和肿瘤生长的显著抑制。
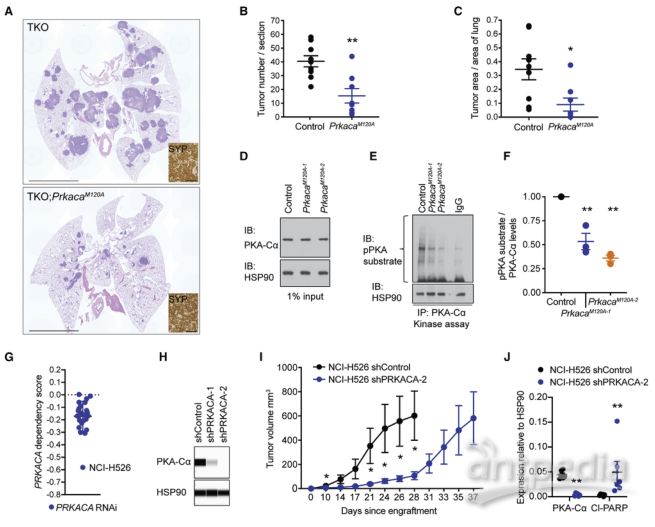
SCLC的增长需要PKA
3. 通路研究
(1)PP2A抵消了PKA在SCLC中的致瘤作用
先前的研究表明,PKA和PP2A(蛋白磷酸酶2A)之间可能存在功能相互作用。作者使用PP2A抑制剂(PP2Ai)处理可抑制PP2A活性,并增强SCLC细胞中PKA底物的磷酸化,而PKA抑制剂(PKAi)预处理可逆转这一过程;使用PP2A激活剂(SMAP)处理可抑制PKA底物的磷酸化,并诱导SCLC细胞凋亡。该结果说明PP2A抵消了PKA在SCLC中的致瘤作用。因此,抑制PKA本身或操纵PKA信号网络中的其他酶可能在SCLC中具有抗癌作用。

PP2A使PKA底物去磷酸化并抑制SCLC的生长
(2)GNAS在人类SCLC中被激活,并在小鼠模型中促进PKA活性和SCLC生长
作者发现,由GNAS编码的Gαs是人类SCLC中表达最高的G蛋白α亚基(GNAS)。Gαs通过激活腺苷酸环化酶(AC)介导G蛋白偶联受体(GPCR)信号传导,导致PKA的下游激活。进一步实验表明,发生在SCLC患者中的GNAS的扩增和激活突变可以显著增强小鼠模型中的SCLC进展,从而将Gαs定义为SCLC中的致癌基因。
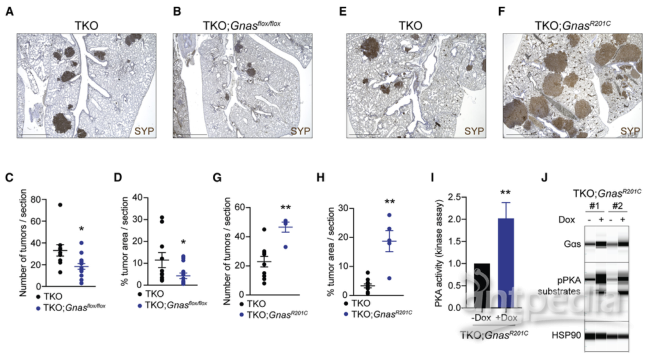
Gαs是SCLC生长的充要条件
4. 互作组:构建SCLC细胞中PKA信号网络
利用质谱分析构建了SCLC细胞中的PKA互作组,确定了128个候选相互作用因子,编辑了一个高可信度的蛋白质-蛋白质互作网络,进一步将PKA置于SCLC细胞中GPCR/Gαs信号网络的下游,并将PKA信号与原发性人SCLC肿瘤中的其他遗传改变联系起来。

SCLC细胞中的PKA相互作用信号网络图
5. 磷酸化蛋白组:确定下游信号网络和PKA直接底物
为了进一步了解SCLC细胞中PKA激活的下游后果,在NCI-H526细胞(高度依赖于PKA活性)和NCI-H69细胞(具有相对较高的PKA)中进行了磷酸化蛋白质组分析。用cAMP的长效类似物(8-Br-cAMP)激活PKA后,鉴定到上千个磷酸化位点发生了变化,GO分析显示,与细胞增殖和癌症有关的多种途径富集。使用磷酸化蛋白质组学方法鉴定了54种PKA底物,敲低其中一些高可信度靶标(包括核糖体亚基RPL34、RPS3A、RPS6)会降低DepMap数据集中人SCLC细胞系的生长。该方法确定了PKA的大量底物,表明PKA激活通过调节多个信号网络来促进SCLC的生长。

PKA控制SCLC细胞中的大量下游过程
6. 磷酸化蛋白组:确定下游信号网络和PKA直接底物
在PKA活性较低的NJH29细胞中过表达aPKA(活性PKA)后构建PDX模型,发现aPKA显著促进肿瘤的生长。进一步对这些PDX模型肿瘤进行了RNA-seq,对表达aPKA的肿瘤中上调基因的分析揭示了与神经元和神经内分泌特征相关的途径,许多SCLC干细胞的标志物显著上调。将稀释的NJH29-GFP和NJH29-aPKA细胞移植到NSG小鼠中进行了极限稀释分析,结果发现PKA的激活足以增强SCLC干细胞的频率。相反,依赖于PKA活性的NCI-H526细胞中PKA-Cα的敲低降低了癌症干细胞标志物的表达和肿瘤干细胞的频率。因此,SCLC细胞中PKA活性的改变导致信号网络的变化,该信号网络调控着控制癌症干细胞状态的基因表达程序。
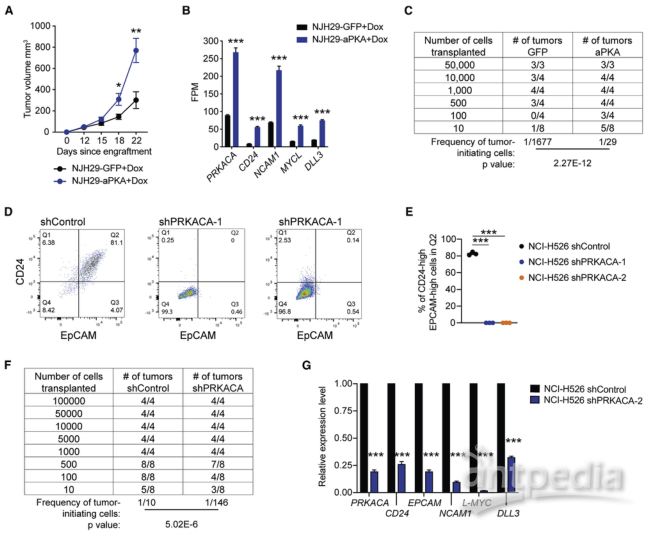
PKA活性促进SCLC干细胞的扩增
小编小结
本研究利用激酶组分析确定PKA为SCLC中的活性激酶,利用磷酸化蛋白质组学分析确定了许多PKA底物和作用机理,绘制磷酸化蛋白质组如何响应PKA激活而变化的图谱,并确定PKA激活如何改变SCLC的生物学特性。这些数据提供了探索PKA信号的最大、种类最全的蛋白质组学数据之一,对于深入研究SCLC驱动进程以及其他PKA依赖性和GPCR激活的神经内分泌癌的机制具有重要意义。
中科新生命修饰蛋白质组学产品线


| 标签: | 蛋白组 代谢组 多组学 中科新生命 磷酸化蛋白质组学 |


