
诚信认证:
工商注册信息已核实! 扫一扫即可访问手机版展台
扫一扫即可访问手机版展台
专家点评Cell“帽子戏法” | 肺腺癌研究重大进展:多组学整合精准医学研究时代来临

BioArt | 原文 中科新生命 | 转载
肺癌是我国也是世界上发病率和死亡率最高的恶性肿瘤【1】,五年存活率不足20%【2】。肺腺癌(Lung Adenocarcinoma, LUAD)是非小细胞肺癌中最普遍存在的分型,大约占所有恶性肺肿瘤的一半【3】。LUAD最普遍的风险因素是吸烟,其他的风险还包括暴露在致癌物以及户外空气污染等等【4,5】。近年来,诊断出肺腺癌的非吸烟病人人数逐渐增加,这说明找出LUAD发展过程中的非吸烟风险因素是非常关键的【6】。
在过去的十几年中,西方国家的一些研究中为了揭示出LUAD的驱动基因进行了大规模的基因组研究,发现LUAD中最常见的体细胞突变是TP53、KRAS、KEAP1、STK11、EGFR等【7-9】。在中国和其他的亚洲国家,女性非吸烟者罹患肺腺癌的人中约有40-50%是由EGFR突变引起的【10】。
目前关于肺腺癌治疗方面可供选择的治疗方式包括外科手术、放疗、化疗、靶向治疗、免疫疗法或者是这些治疗方式的组合。尽管肺腺癌治疗方面有一定的进展,但是仍有大量的LUAD还没有适合的治疗方式,因为缺少对其中遗传突变的了解或者是很难建立靶向基因突变的药物。因此,针对肺腺癌人群蛋白质分子图谱的全景绘制,对于生物标志物与药物靶点的发现、肺腺癌分子分型和精准治疗方案的制定有重大科学意义。
2020年7月9日,中国科学院上海药物研究所谭敏佳研究员团队联合军事科学院军事医学研究院、国家蛋白质科学中心(北京)贺福初院士团队、汪宜研究员团队,国家癌症中心/中国医学科学院肿瘤医院程书钧院士、肖汀研究员团队,上海交通大学李婧教授等团队合作在Cell发文题为Integrative Proteomic Characterization of Human Lung Adenocarcinoma,在国际上首次对肺腺癌开展了大规模、高通量、系统性的全景蛋白质组学研究。研究工作对103例临床病人的肺腺癌和癌旁组织进行了蛋白质表达谱和磷酸化翻译后修饰谱的深度解析,最终共鉴定到11,119个蛋白产物和22,564个磷酸化修饰位点,同时整合临床信息和基因组特征数据分析,深度构建了基于蛋白质组的肺腺癌分子图谱全景。该研究首次从蛋白质水平系统描绘了肺腺癌的分子图谱,并发现了与病人预后密切相关的分子特征,特别是发现了中国人群肺腺癌两个主要基因(TP53和EGFR)突变人群的蛋白质分子特征。
为了对中国人肺腺癌的基因组进行研究,作者们收集了103个肺腺癌病人的样品以及相匹配的非癌相邻组织。该工作从蛋白质组、磷酸化蛋白质组、全外显子组(Whole-exome sequencing, WES)、RNA-seq多组学水平对肺腺癌进行全方位的研究(图1)。

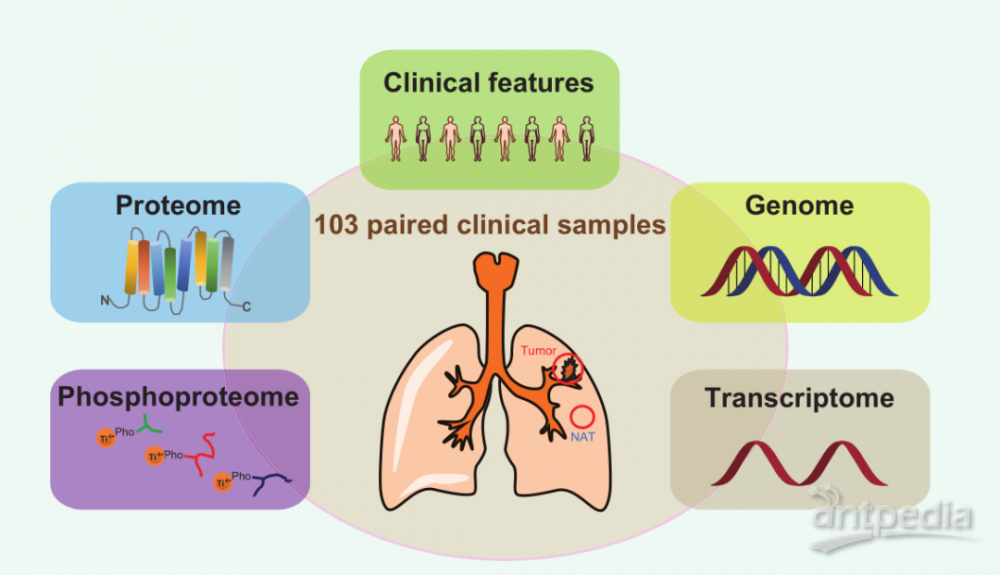
图1. 肺腺癌分子全景
随后,作者们对LUAD的转录组学和蛋白质组学的结果进行了分析。蛋白质组的数据给出了一些从其他基因组学数据无法获得的独特的致癌数据特征。为了对DNA/RNA变体以及蛋白质产物进行检测,作者们对包含体细胞突变的病人来源的全外显子数据库、RNA-seq数据来源的新颖可变剪切以及融合蛋白数据库分析,希望能够建立起这些新的基因事件变化背后对蛋白水平的影响。通过对大量非同义单核苷酸变异(Single-nuleotide variants, SNVs)和小的插入缺失突变的整合分析,作者们发现其中只有1.2%引发了蛋白质水平的变化(图2)。这些分析结果都表明转录组、蛋白质组以及磷酸化蛋白质组各自拥有非常独特的特征,当对这些多水平组学的数据进行整合后将会为功能重要的基因产物在肺腺癌中作用的解析提供新的见解。

图2 DNA、mRNA以及蛋白质水平SNVs的变化
随后,作者们对肿瘤组织与邻近非肿瘤组织的蛋白质组学特征进行了对比。通过主成分分析对比,作者们发现肿瘤组织与邻近非肿瘤与组织之间存在明显的边界,说明肺腺癌发生和发展过程中存在异常的蛋白质组学景观。基因集合富集分析(Gene set enrichment analysis, GSEA)证明肿瘤中富集的蛋白主要参与的信号通路包括蛋白酶体、糖酵解/糖异生途径、核糖体、泛素化介导的蛋白水解作用、核酸切除损伤以及细胞周期相关信号通路等,而邻近非肿瘤区域主要富集的相关信号通路是参与肺部生理功能的基因,包括细胞外基质受体相互作用、紧密连接、ABC转运蛋白等。
为了对单个肺腺癌驱动基因突变是如何影响蛋白质组和相关信号通路的,作者们对包含和不包含LUAD驱动基因突变的病人中蛋白质组学区别进行检测。作者们发现有四个驱动基因突变与245个蛋白质表达存在显著的正相关性或者负相关性。其中大多数蛋白的变化都与TP53和EGFR突变相关,同时前人的研究也集中在TP53与EGFR在LUAD预后预测方面【11】。为了进一步建立遗传改变与下游信号通路之间的关系,作者们对病人中具有或不具有TP53和EGFR突变的蛋白质组学谱进行分析。通过分析发现,同时具有两种突变的病人预后结果不佳,并且出现包括氧化磷酸化、脂肪酸代谢在内的多种代谢相关的信号途径下调以及致瘤信号通路上调。
为了对肺腺癌的患者进行进一步分类以及对各分型临床治疗效果进行评估,作者们通过分子以及临床特征将这些肺腺癌患者分为I型、II型和III型(图3)。其中,I型与代谢和细胞微环境密切相关(Environment and metabolism high, EM-H),主要为临床早期人群,预后良好;III型(Proliferation and proteasome, PP)与细胞稳态及增殖密切相关,其主要为临床中后期人群,呈现出肿瘤分化程度较低,且预后最差;II型则是I型和III型的过渡状态,其人群预后程度介于I型和III型之间。基因组信息显示,II型肺腺癌病人具有最高频率的EGFR突变而III型的肿瘤突变负荷最大。蛋白质组学的特征确认HSP 90β可以作为LUAD的预后预测标记物,同时也鉴定出了一系列蛋白质作为潜在的药物靶点,其中的很多均已知与癌症的发展过程相关。

图3 肺腺癌患者分型与多种变量之间的相互关系
总的来说,该工作通过多组学整合分析为临床方面理解肺腺癌的发生发展过程提供了重要的工具,同时也为未来在肺腺癌的精准医学发展以及临床治疗方面铺设了转化基础。
据悉,中国科学院上海药物研究所谭敏佳研究员、国家癌症中心/中国医学科学院肿瘤医院肖汀研究员、军事科学院军事医学研究院、国家蛋白质科学中心(北京)贺福初院士、上海交通大学李婧教授以及军事医学研究院、国家蛋白质科学中心(北京)汪宜研究员为该论文的共同通讯作者;中国科学院上海药物研究所博士后徐骏宇、军事科学院军事医学研究院、国家蛋白质科学中心(北京)博士后张春潮、国家癌症中心/中国医学科学院肿瘤医院博士生王想、中国科学院上海药物研究所助理研究员翟琳辉以及上海交通大学博士生马一鸣为该论文共同第一作者。军事科学院军事医学研究院、国家蛋白质科学中心(北京)钱小红研究员、秦钧研究员、国家癌症中心/中国医学科学院肿瘤医院程书钧院士和毛友生主任、首都医科大学宣武医院张毅主任、天津宝坻医院王广舜主任、复旦大学王飞教授等团队也参与了该研究工作。
值得一提的是同期Cell上由“国立”台湾大学附属医院Yu-Ju Chen研究组牵头发表了另外一篇文章题为Proteogenomics of Non-smoking Lung Cancer in East Asia Delineates Molecular Signatures of Pathogenesis and Progression,通过一组非吸烟早期肺腺癌患者的蛋白质组与基因组的分析,揭开了早期肺腺癌中独特的驱动因素和生物标记以及性别相关的差异。

该文章首次展现了东亚人群中非吸烟肺腺癌患者的蛋白质基因组学景观,鉴定出与肺腺癌发生发展过程中相关的年龄、性别以及环境致癌物风险因素,并通过蛋白质组特征对肺腺癌早期阶段进行临床分类,同时通过蛋白质网络鉴定出肿瘤发生特点、肿瘤细胞标记物以及药物靶点等。总的来说,这项研究揭示了肺腺癌早期肿瘤进展的分子结构和特征,并可能为东亚地区控制非吸烟肺癌的精准医疗开辟道路。
除此之外,临床蛋白质组肿瘤分析联盟(Clinical Proteomic Tumor Analysis Consortium)牵头在同期发表了也发表文章题为Proteogenomic Characterization Reveals Therapeutic Vulnerabilities in Lung Adenocarcinoma,通过多组学的方式对肺腺癌蛋白质基因组学方面进行了解析,并通过其不同免疫特征建立了不同的肺腺癌分型。
另外,该文章通过磷酸化蛋白质组学方式鉴定出ALK-fusion作为诊断标记物和靶点的潜力。除此之外,作者们还鉴定得到了多个药物靶点。肺腺癌肿瘤标记物蛋白磷酸化和乙酰化修饰也可能参与其中。
总的来说,三篇Cell文章齐发,通过基因组学、蛋白质组学、磷酸化蛋白质组学、全外显子组学等多组学方式对肺腺癌的特征进行总结和描述,建立更精细的肺腺癌分型,为肺腺癌在临床方面的治疗、药物开发以及精准医学的发展提供强大的生物信息学资源助力。
专家点评
季红斌、高大明(中国科学院生物化学与细胞生物学研究所)
2020年7月9日于Cell在线发表的题为Integrative Proteomic Characterization of Human Lung Adenocarcinoma的论文中,报道了中科院药物研究所谭敏佳研究员、军事科学院军事医学研究院、国家蛋白质科学中心(北京)贺福初院士等领衔的肺腺癌整合组学研究成果。
肺癌的发病率和致死率长年位居各大恶性肿瘤前列。按照病理类型,肺癌可以简单地分为小细胞肺癌和非小细胞肺癌,其中非小细胞肺癌占绝大多数,又可以细分为腺癌、鳞癌和大细胞癌。肺腺癌是所有肺癌类型中最大的一个亚型,发病人数近年来呈现显著上升的趋势。随着过去十余年来的癌症基因组学和分子靶向治疗的不断进展,包括EGFR、KRAS、MET、ALK等在内的驱动基因突变在肺腺癌发病中的关键作用得到证实,临床治疗实践也证实了靶向驱动基因药物的临床应用价值。但是,基因突变型并不能够完全预测肿瘤细胞的特性。即使携带有同样驱动基因突变的肺腺癌患者也可能对同样的治疗方案产生不同的响应。因此,非常有必要从生物学功能的执行者蛋白质的层面进行全景式的深入解析。通过对大样本肺腺癌进行蛋白质-磷酸化蛋白质组学的分析,并整合基因型等遗传信息分析,探究临床肺腺癌中发生特异变化的信号分子,深入揭示肺腺癌发病的分子机制。
该研究通过对差异蛋白质组进行分析,做出了一系列具有临床意义的发现。例如同为I期患者,脂代谢、氧化磷酸化代谢活跃提示较好的预后,而上皮间质转化、TNFα、MYC、mTOR 等通路的相对活跃则提示恶性进展的发生。该研究还通过对差异蛋白质进行聚类分析,发现肺腺癌患者可以分为三个亚型,而且不同亚型肺腺癌的生存期显著不同,为基于蛋白组学数据的疾病预测奠定了坚实的理论基础。有意思的是,预后最好的I型肺癌中,细胞外基质、氧化磷酸化、抗原递呈等功能相关蛋白表达较高,而预后最差的III型肺癌中,关于蛋白酶体、泛素信号、DNA复制等相关蛋白质表达较高。相应的,三个亚型中蛋白质激酶谱的活化程度各不相同,提示驱动三种亚型的信号通路也存在差异。
该研究除了揭示蛋白质表达与预后的关系,还发现HSP90b、IMPDH2、GAPDH三个功能蛋白质的高表达与不良预后显著相关,并提示这三个蛋白质是肺腺癌的潜在治疗靶点。综上所述,该研究通过对肺腺癌样本基因组、转录组、蛋白组、磷酸化蛋白组大数据的整合研究,结合临床生存信息,在分子分型、预后分子标志物、信号通路网络、潜在药物靶点等方面揭示了中国人群肺腺癌样本在分子层面的诸多特征,为研发肺腺癌精准诊疗的新策略奠定了理论基础。特别值得指出的是,同期Cell还登载了由美国哈佛大学和台湾“中研院”各自领衔完成的两个肺腺癌多组学研究工作。这两篇文章分别聚焦美国吸烟患者人群和东亚不吸烟患者人群来源的肺腺癌,并从肺癌治疗靶标以及肿瘤恶性进展机制两个不同角度来开展工作。毫无疑问,这三项大规模的多组学研究将为后续深入揭示肺腺癌的分子特征以及新型诊疗策略的开发奠定坚实的理论基础。
原文链接:
https://doi.org/10.1016/j.cell.2020.05.043
https://doi.org/10.1016/j.cell.2020.06.012
https://doi.org/10.1016/j.cell.2020.06.013
参考文献
1. Bray, F. et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA: a cancer journal for clinicians 68, 394-424, doi:10.3322/caac.21492 (2018).
2. Herbst, R. S., Morgensztern, D. & Boshoff, C. The biology and management of non-small cell lung cancer. Nature 553, 446-454, doi:10.1038/nature25183 (2018).
3. Chen, Z., Fillmore, C. M., Hammerman, P. S., Kim, C. F. & Wong, K. K. Non-small-cell lung cancers: a heterogeneous set of diseases. Nature reviews. Cancer 14, 535-546, doi:10.1038/nrc3775 (2014).
4. Gould, M. K. et al. Evaluation of individuals with pulmonary nodules: when is it lung cancer? Diagnosis and management of lung cancer, 3rd ed: American College of Chest Physicians evidence-based clinical practice guidelines. Chest 143, e93S-e120S, doi:10.1378/chest.12-2351 (2013).
5. Vineis, P. et al. Environmental tobacco smoke and risk of respiratory cancer and chronic obstructive pulmonary disease in former smokers and never smokers in the EPIC prospective study. BMJ (Clinical research ed.) 330, 277, doi:10.1136/bmj.38327.648472.82 (2005).
6. Molina, J. R., Yang, P., Cassivi, S. D., Schild, S. E. & Adjei, A. A. Non-small cell lung cancer: epidemiology, risk factors, treatment, and survivorship. Mayo Clinic proceedings 83, 584-594, doi:10.4065/83.5.584 (2008).
7. Campbell, J. D. et al. Distinct patterns of somatic genome alterations in lung adenocarcinomas and squamous cell carcinomas. Nature genetics 48, 607-616, doi:10.1038/ng.3564 (2016).
8. Comprehensive molecular profiling of lung adenocarcinoma. Nature 511, 543-550, doi:10.1038/nature13385 (2014).
9. Devarakonda, S., Morgensztern, D. & Govindan, R. Genomic alterations in lung adenocarcinoma. The Lancet. Oncology 16, e342-351, doi:10.1016/s1470-2045(15)00077-7 (2015).
10. Chen, J. et al. Genomic landscape of lung adenocarcinoma in East Asians. Nature genetics 52, 177-186, doi:10.1038/s41588-019-0569-6 (2020).
11. Jiao, X. D., Qin, B. D., You, P., Cai, J. & Zang, Y. S. The prognostic value of TP53 and its correlation with EGFR mutation in advanced non-small cell lung cancer, an analysis based on cBioPortal data base. Lung cancer (Amsterdam, Netherlands) 123, 70-75, doi:10.1016/j.lungcan.2018.07.003 (2018).

| 标签: | 蛋白组 代谢组 多组学 中科新生命 cell |


