
诚信认证:
工商注册信息已核实! 扫一扫即可访问手机版展台
扫一扫即可访问手机版展台
中科项目文章 | Autophagy :蛋白质组学+PRM助力三甲基氯化锡(TMT) 的神经毒理机制研究

氯化三甲基锡(TMT)在工业和农业领域中广泛用作杀菌剂,塑料稳定剂的组成部分,并且有文献证明,在食品,饮料和日用品中可检测到TMT。在过去的几十年中,不断中毒的案例报道。TMT被普遍认为具有有效的神经毒性作用,尤其是在海马中。然而,TMT诱导神经毒性的机制仍然不清楚。
2020年3月,第三军医大学研究团队在Autophagy(IF=11.059)杂志上在线发表了题为KIF5A-dependent axonal transport deficiency disrupts autophagic flux in trimethyltin chloride-induced neurotoxicity的研究论文,利用蛋白组学技术揭示了巨自噬/自噬溶酶体机制在TMT诱导的神经毒性中的重要作用,并找出了关键蛋白质Kif5a,为今后的TMT毒性治疗提供了方向。
研究材料: Neuro-2a 细胞系,原代海马神经元, C57BL/6J小鼠
技术方法:TMT蛋白质组学+PRM
研究路线:

研究结果:
1.利用蛋白质组学发现自噬通路重要性
本文首先通过CCK-8分析确定TMT在Neuro-2a细胞中的神经毒性。用2、4和8μM TMT处理细胞24小时分别导致细胞活力降低约15%,31%和44%。然后,8μM TMT处理24小时的细胞进行了TMT标记定量蛋白质组学分析。与对照组相比,TMT组中共有340种差异表达的蛋白质,其中204种蛋白质发生上调(>1.2倍以上),而136种蛋白质发生了下调(<0.8倍以下)。通过对差异蛋白质进行KEGG与IPA分析发现,自噬在TMT诱导的神经毒性中应当起到重要作用。

图1蛋白质组学联合生信分析揭示自噬通路在TMT诱导神经毒性中的重要性
2.对TMT诱导的自噬通量受损进行验证
为进一步评估自噬对TMT诱导的神经元细胞死亡的影响,作者研究了TMT影响Neuro-2a细胞自噬通量的机制。TMT以剂量依赖的方式增加了LC3B-II:LC3B-I表达的比例,使SQSTM1水平升高。这表明TMT损害了自噬体的清除,导致它们在细胞质中的积累。这一结论支持TMT在Neuro-2a细胞中是一种有效的自噬抑制剂。

图2 TMT处理扰乱了神经细胞的自噬通量
3. TMT抑制Neuro-2a细胞中的自噬通量的机制探究
由于自噬是一个多步过程,作者进一步探究TMT对自噬的哪一阶段产生影响。结果表明,TMT不干扰自噬体的形成和成熟,不影响自噬体与溶酶体的融合,而是通过影响溶酶体的pH值以及造成组织蛋白酶的酶活缺陷影响溶酶体功能,进而造成了自噬通量的缺陷。

图3 TMT不会抑制Neuro-2a细胞中的自噬诱导或自噬成熟

图4 TMT不会抑制Neuro-2a细胞中的自噬体与溶酶体的融合

图5 TMT影响Neuro-2a细胞中的溶酶体pH及蛋白酶水解功能
4. KIF5A是TMT处理细胞过程中神经毒性相关的关键蛋白
通过进一步对蛋白质组学结果进行IPA分析,发现与自噬相关的关键蛋白KIF5A,利用western blot验证了TMT处理对KIF5A的显著下调。进一步的自噬通量表型研究发现在Neuro-2a细胞中过表达KIF5A可以逆转TMT诱导的神经细胞毒性,PRM分析发现TMT诱导的蛋白表达趋势同样可以得到逆转。

图6 IPA显示KIF5A与自噬途径变化蛋白的紧密关联
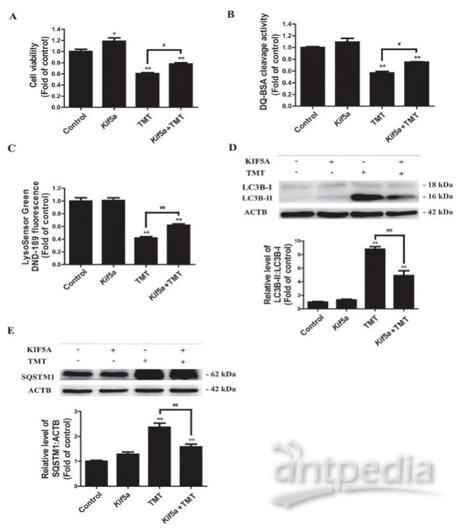
图7 Kif5a的过表达可逆转TMT诱导的神经细胞毒性

图8 PRM分析证实Kif5a的过表达可逆转TMT诱导对重要蛋白质的调控趋势
5. KIF5A在海马神经元中可以挽救TMT造成的溶酶体顺行运输缺陷
从小鼠体内分离得到原代海马神经元,接种在微流体腔上生长,并利用红色荧光标记溶酶体,使用运动记录仪记录溶酶体沿轴突运动的轨迹,发现TMT处理会造成溶酶体顺行运输缺陷,而这一缺陷可以被KIF5A的过表达挽救。

图9 Kif5a的过表达可挽救TMT诱导的溶酶体顺行运输缺陷
6. KIF5A在小鼠体内可以挽救TMT造成的癫痫和自噬通量缺陷引起的海马损伤
对小鼠进行TMT单次腹腔注射,进行TMT体内神经毒性的研究,发现注射24h后,小鼠出现癫痫以及海马神经元损伤,在分子层面上则表现为KIF5A表达下调、自噬体CTSB活性下调以及自噬通量缺陷。在小鼠体内过表达Kif5a可以在体内拮抗TMT诱导的神经毒性和自噬通量损伤。

图10 TMT对小鼠海马神经毒性的表现与Neuro-2a细胞类似

图11 Kif5a的过表达可以拮抗TMT诱导的体内神经毒性和自噬通量受损
研究亮点总结
本研究通过蛋白质组学结合生物信息学,对TMT的神经毒理机制进行了深入的研究:机制探索上,从重要通路到具体机制再到关键蛋白逐级深入,从自噬通路的锁定到对自噬通路的多个阶段进行细致的验证,将TMT对自噬通量的干扰锁定到对溶酶体功能的影响上,然后还寻找到了关键下调蛋白Kif5a,并且通过对Kif5a过表达对TMT诱导的神经毒性的逆转证实了Kif5a的重要作用;在机制验证上,从Neuro-2a细胞到原代海马神经元,再到小鼠体内实验,层层递进,对TMT的毒理机制以及过表达Kif5a对该神经毒性的逆转进行了从体外到体内的验证,为机制的未来应用提供了扎实的方向指引。
备注:获得本篇软文的详细视频解读,请在中科新生命微信公众号后台回复“3.31讲座回放”。


