硬核综述 | 贾伟/郑晓皎教授团队揭秘胆汁酸在全身代谢和免疫稳态中的调控作用
胆汁酸(Bile acids, BAs)是由胆固醇经肝脏合成的类固醇物质,能与血浆蛋白结合并进入体循环,进而分布到全身各器官(如肠道、大脑、心脏等)。早在2008年贾伟教授即在Nature Reviews Drug Discovery上发表前瞻性的综述【1】,提出肠道菌群是肥胖、糖尿病、消化道肿瘤及神经退行性疾病的干预靶点。2017年,贾伟教授研究团队在国际学术期刊Nature Reviews Gastroenterology & Hepatology上发表综述【2】,系统介绍了胆汁酸和肠道菌之间的相互作用以及对消化道肿瘤发生的影响,提出消化道的炎症和癌症发生可以通过调节肠道菌、调节胆汁酸的合成及转运从而达到肠肝循环中胆汁酸的平衡以及修复FXR信号因子等机制来有效的控制。2019年,贾伟教授与上海中医药大学李后开研究员,美国杜克大学脑科学研究院的Rima KaddurahDaouk教授联合在Medicinal Research Reviews对阿尔茨海默病与肝性脑病发病中的肠道菌群紊乱、外周与中枢胆汁酸、胆固醇代谢异常等共性机制进行了阐述【3】,提出了“肠道菌群-胆汁酸-脑”关系轴可能是AD/肝性脑病发病及干预靶标的假说。2020年,贾伟教授研究团队在Protein&Cell综述深度总结了BAs合成途径(尤其是替代途径)的最新研究进展【4】,替代合成通路中产生的非-12-OH BAs和羟化固醇将激活各组织中多个核和膜受体介导的信号通路,指出非12-OH BAs将最终调节肥胖、T2DM、NAFLD、NASH、肝癌等疾病进展,同时探讨了BA替代合成途径在治疗代谢性疾病中的前景。综上,贾伟教授研究团队针对胆汁酸对肥胖、糖尿病、消化道肿瘤及阿兹海默等神经退行性疾病等多个领域进行了深度的重磅研究与综述总结。
2023年8月,贾伟/郑晓皎教授团队在SCIENCE CHINA Life Sciences上发表了题为“Bile acid signaling in the regulation of whole body metabolic and immunological homeostasis”的综述文章,系统总结了胆汁酸在全身各个器官的代谢和免疫稳态调控中的作用,为基于胆汁酸的疾病靶向治疗指明了未来的研究方向【5】。

胆汁酸在营养吸收中起着至关重要的作用,并作为脂质、葡萄糖代谢和免疫稳态的关键调节剂。BAs通过肠肝循环被合成、代谢、再吸收,一部分进入血管循环并全身分布。在肠肝循环中,胆汁酸浓度较高,其在营养吸收、代谢调节和能量稳态维持方面发挥重要作用。除肝肠外的其他器官中,虽然胆汁酸浓度极低,但在代谢和免疫稳态调控方面扮演关键的信号分子角色。本文综述BAs介导的代谢和免疫调节的全身效应,包括大脑、心脏、肝脏、肠道、眼睛、皮肤、脂肪组织和肌肉。

在大多数组织中,BAs作为具有自分泌、旁分泌或内分泌功能的信号分子,在全身范围内发挥代谢和免疫调节作用。BAs直接通过BA转运体运输并与核BA受体相互作用,或与细胞表面受体G蛋白偶联受体(GPCR)结合,触发各种第二信使的产生。BAs还通过其诱导的肠肝激素、成纤维细胞生长因子或细胞因子间接与细胞相互作用。

图1. 胆汁酸作为具有旁分泌和内分泌功能的信号分子调节全身代谢和免疫
胆汁酸的肝外合成
据报道,肝脏是主要表达初级BA合成酶的器官,如细胞色素P450 7A1 (CYP7A1)、CYP8B1、CYP27A1、CYP7B1等至少17种肝酶。此外,肠道细菌还通过解偶联和7α-去羟基化等化学修饰,将初级BAs转化为次级BAs。尚不清晰肝肠外的其他器官能否从头合成胆汁酸,但有证据表明大脑、肾上腺、巨噬细胞等可能参与胆汁酸的替代合成途径。例如,胆固醇可通过肾上腺和巨噬细胞中的CYP27A1或大脑中的CYP46A1和CYP39A1生成羟固醇。羟固醇不仅可以作为肝脏内合成初级胆汁酸的底物,而且如同胆汁酸在胆固醇代谢中扮演重要的信号分子角色。因此,充分理解胆汁酸在不同组织器官中的合成、代谢和信号传导,对于实现临床转化具有关键意义。

图2. 肠肝系统、大脑和肾上腺都参与BAs合成
胆汁酸调节糖脂、能量代谢
在肠肝及肝外组织中,胆汁酸通过FXR、TGR5、PXR、VDR、SP1PR2、RORγt等受体调节代谢和免疫并维持全身稳态。如BAs通过FXR或表皮生长因子受体(EGFR)传递信号,激活糖原合成酶的主要调节因子糖原合成酶激酶3 (GSK3),增加肝糖原的生成和储存,从而降低血糖水平。贾伟教授团队此前研究表明,回肠中猪胆酸类(HCAs)可以同时激活TGR5和抑制FXR,促进肠道GLP-1的合成和分泌,降低血糖【6】。
BAs在调节甘油三酯(TG)和胆固醇代谢中起关键作用。它们以FXR小异二聚体伴侣(SHP)依赖的方式,通过抑制脂肪酸和TG合成的主要调节因子来抑制脂肪生成。FXR激活还通过调节载脂蛋白CII (ApoCII)、ApoCIII和极低密度脂蛋白(VLDL)受体的表达,促进TG水解并帮助TG从血清中清除。BAs还调节脂质代谢的其他关键调节因子如过氧化物酶体增殖物激活受体α (PPARα)和丙酮酸脱氢酶激酶4(PDK4)。贾伟教授团队也发现抑制肠道FXR导致肝脏合成和粪便排泄BAs增加,从而有效降低血液和肝脏中的胆固醇水平【7】。另外,BAs还可以激活TGR5 -cAMP-蛋白激酶A (PKA)通路,调节能量消耗。
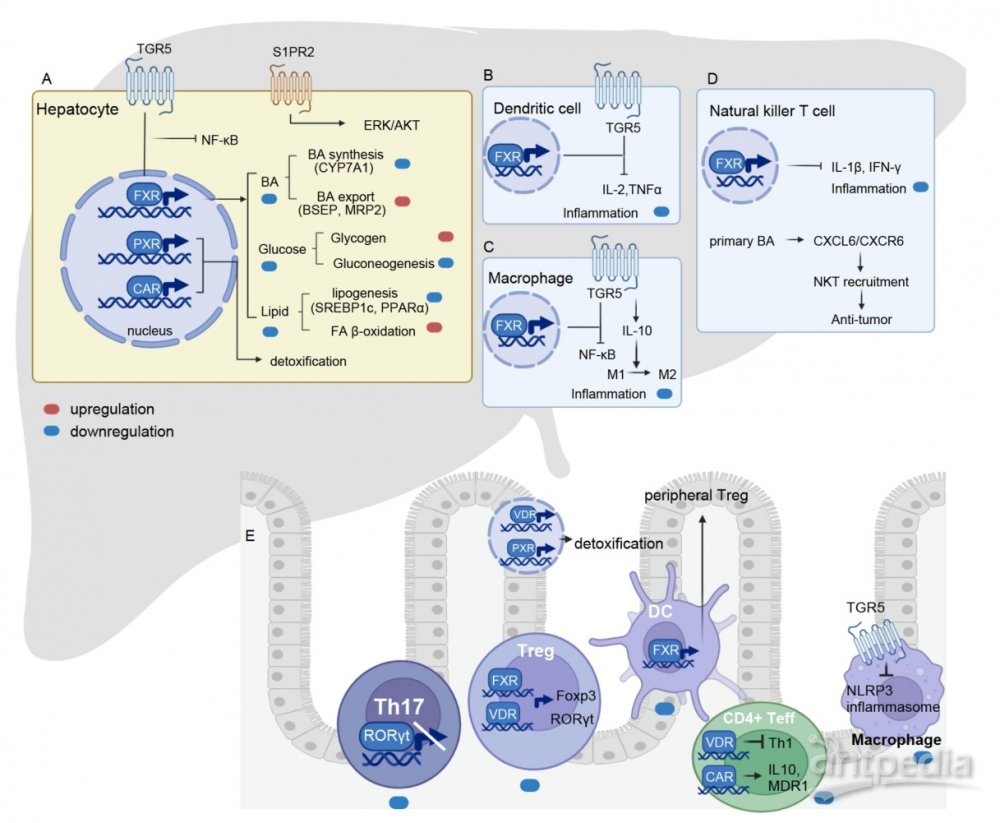
图3. 胆汁酸信号通路对肝肠代谢-免疫的调控作用
胆汁酸调节先天和适应性免疫
BAs通过与各种免疫细胞的相互作用和调节细胞因子产生影响免疫系统。先天免疫细胞表达BA受体促进细胞因子产生或影响原代适应性免疫细胞的分化,适应性免疫细胞中BA受体的激活会产生促炎或抗炎反应。BAs与免疫系统的相互作用在越来越受到全身BAs信号研究的关注。
FXR在单核细胞、巨噬细胞、树突状细胞(DCs)和自然杀伤T细胞(NKT) 等多种免疫细胞中表达。单核细胞和巨噬细胞中FXR的激活可以抑制toll样受体9 (TLR9)依赖性的促炎反应;此外,FXR可调节肠道DCs从分化簇单核细胞到成熟DCs的分化;NKT细胞中FXR的激活可抑制骨桥蛋白、白细胞介素-1β(IL-1β)和干扰素-γ(IFN-γ)的产生。
另外,免疫细胞中TGR5受体通过信号转导和转录激活因子1(STAT1)依赖机制抑制促炎NF-κB信号通路,减少促炎细胞因子IL-6, IL-8, TNF-α的产生。TGR5还通过降低M1巨噬细胞中TNF、IFN-γ、IL-6和IL-1β的分泌,促进M2巨噬细胞分化,从而调节经典活化M1巨噬细胞和交替活化M2巨噬细胞的分化。
次级BAs如石胆酸(LCA)及衍生物3-oxoLCA、isoalloLCA和isoDCA在调节CD4+T细胞分化,特别是Th17和Treg分化中起关键作用。
BAs的免疫调节作用也可进行肝脏肿瘤生长的监测,初级和次级BAs的比例失调与肝癌的发生有关。据报道,次级BAs抑制Cys-X-Cys趋化因子配体16(CXCL16)的表达,导致肝脏NKT细胞的积累减少,而肝脏NKT细胞中的CXCR6在抗原刺激下增加IFN-γ的产生可抑制肿瘤生长。因此,通过去羟基化活性调节肠道菌群维持BAs的平衡是有前景的癌症治疗策略。
胆汁酸和肠肝轴
肝脏和肠道是BA作用的主要部位。FXR受体通过抑制肝细胞中CYP7A1和CYP8B1的转录来调节BA的合成,控制BAs和磷脂进入胆汁,还通过ASBT、有机溶质转运蛋白α(OSTα)和OSTβ调节肝脏和肠细胞对BAs的摄取。此外,肠细胞中FXR的激活促进FGF15/19激素的释放,进而通过ERK信号通路抑制肝脏中BAs的产生。肝脏中BAs-FXR信号通路调节脂肪生成、糖异生、糖原合成和胰岛素敏感性等各种代谢过程。BA-肝脏代谢相互作用的失调与非酒精性脂肪性肝病(NAFLD)和肝癌(HCC)进展有关,激活肝脏FXR是治疗非酒精性脂肪性肝炎(NASH)的潜在手段。
在小肠中,肠道菌群产生的胆盐水解酶(BSH)可将结合型BAs代谢为非结合型BAs。当肠道BSH活性受到抑制,结合型BAs水平升高,抑制肠道FXR和下游FGF15/19成纤维细胞生长因子受体4 (FGFR4)信号传导,导致经典和替代BAs合成途径的关键肝脏基因上调。同时,肝脏中CDCA生成增加,促进肝脏FXR-SHP信号通路,抑制经典途径的BAs合成酶CYP8B1。最终,肠道FXR-FGF15信号和肝脏FXR-SHP信号的共同作用导致肝脏CYP7B1表达增加,胆固醇水平降低,粪便BAs排泄增加,从而改善NAFLD病理生理。
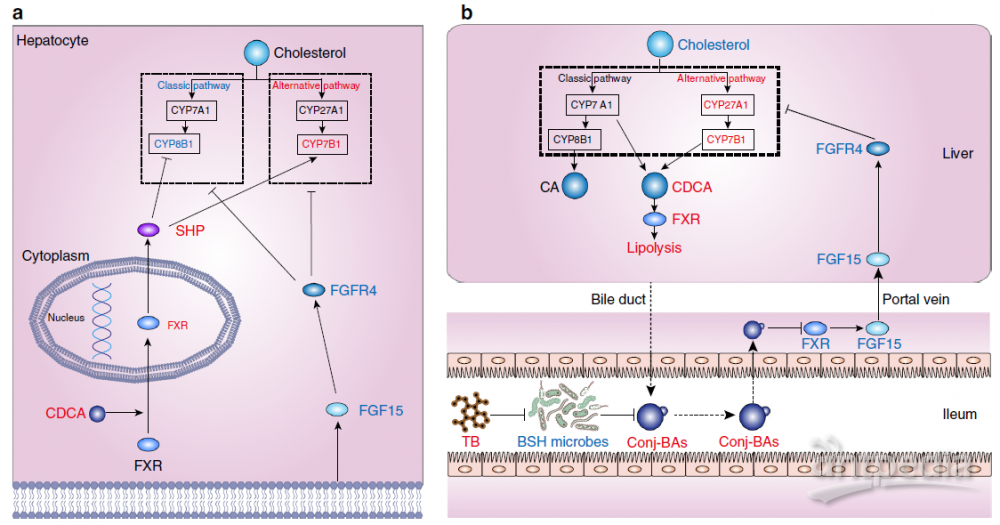
图4. 茶褐素通过BA-肝脏代谢降低胆固醇水平(图源:Huang et al., 2019).)
胆汁酸与大脑
研究显示,血液、脑脊液(CSF)和大脑中BAs的水平和组成在神经系和脑部疾病(如阿尔茨海默病、帕金森病、抑郁、肝性脑病)中发生改变。
几乎所有的BA受体如TGR5、FXR、LXR、PXR、VDR和S1PR2都在大脑中表达,主要在大脑皮层、海马和下丘脑区域。TGR5属于神经类固醇受体,TGR5内源性激动剂TUDCA或UDCA和半合成BA INT777通过与TGR5结合,导致小胶质细胞内cAMP水平升高,从而表现出神经保护和抗炎作用。FXR具有更强的促炎作用,而作为TGR5激动剂的TUDCA和UDCA也是FXR拮抗剂。因此,这些BAs在大脑中的有益作用或因其同时调控TGR5和FXR,深入理解不同BA受体之间复杂相互作用,有助于通过特异性激活或抑制某些受体靶向治疗神经系统疾病。
另外,BAs可以促进肠L细胞和胰腺α细胞中GLP-1和肽YY (PYY)等激素的释放从而影响大脑,通过体循环或迷走神经信号传导与大脑信号相互作用。本研究团队此前发现,肠L细胞中HCA通过TGR5-cAMP信号传导促进GLP-1分泌,或通过FXR调节胰高血糖素原基因转录诱导GLP-1产生;FGF15/19也到达大脑并控制中枢代谢活动如减少食物消耗和调节葡萄糖稳态。综上,通过BA-TGR5/FXR轴激活肠道、肝脏和神经元激素的信号通路网络,形成了全身代谢的系统性调节机制。

图5. 胆汁酸信号通路对全身器官的代谢-免疫的调控作用
胆汁酸调节心脏功能
心血管组织中可表达如TGR5、FXR和PXR等BAs受体,空腹血清总BAs水平与冠心病(CHD)严重程度密切相关。临床研究表明冠状动脉粥样硬化疾病患者BA的产生和循环减少,导致血清胆固醇水平升高,加速动脉粥样硬化病变的发展,CHD患者比健康人的BA粪便排泄水平较高。通过释放BA到结肠促进BA的产生或激活FXR,可加速胆固醇代谢和清除,并抑制动脉粥样硬化,BAs还可通过TGR5调节心脏的传导和收缩功能。
胆汁酸影响胰岛素分泌
在胰腺中,BAs直接或间接地促进胰岛素释放。TGR5和FXR均由胰腺细胞表达,胰腺β细胞中的BA-TGR5和BA-FXR信号通路促进葡萄糖刺激的胰岛素分泌,胰腺α细胞可通过胆汁酸-TGR5-GLP-1促进β细胞的旁分泌作用以刺激胰岛素分泌。此外,肠道内分泌细胞表达的FXR和TGR5促进肠促激素分泌,通过作用于胰腺β细胞调节胰岛素分泌。
胆汁酸影响脂肪组织和肌肉能量消耗
脂肪组织表达FXR和TGR5两种BAs受体,有助于维持健康的脂质和葡萄糖水平。FXR通过增加PPAR活性和阻断Wnt/b-catenin通路,促进脂肪细胞分化,在控制成骨细胞/脂肪细胞平衡中起作用。BA通过FXR调节白色脂肪组织和骨骼肌的外周胰岛素敏感性。褐色脂肪组织(BAT)和肌肉中的TGR5可能影响白色脂肪功能,CCAAT/增强子结合蛋白β (C/EBPβ)依赖性抑制巨噬细胞浸润到白色脂肪组织和增加能量消耗。因此,TGR5被认为是一个治疗肥胖的潜在靶点。
胆汁酸与皮肤炎症
血脂异常是脂蛋白代谢异常的表现,西方饮食导致皮肤中产生IL-17A的T细胞积累,导致C-C趋化因子受体6 (CCR6)依赖的牛皮癣样炎症。BA通过促使皮肤中IL-23的表达诱发银屑病。
TGR5在背根神经节外周神经元中表达,其激活诱导瘙痒神经肽递质的释放,导致急性瘙痒反应。FXR激动剂如奥贝胆酸(OCA),也可引发瘙痒。尽管深入机制尚有待探索,这些研究显示了BA代谢、微生物和免疫之间的相互作用及潜在的治疗价值。
次级胆汁酸调节自身免疫性葡萄膜炎
肠道微生态失调在自身免疫性葡萄膜炎的免疫稳态中起重要作用。肠道BA池的恢复可通过减少DC中促炎细胞因子的产生、抑制Th1和Th17细胞增殖及IL-17和IFN-γ的分泌来缓解自身免疫性葡萄膜炎。肠道微生物群产生的次级BAs可激活TGR5来抑制人单核细胞源性DC的激活获得有效治疗。

胆汁酸代谢调节临床治疗
胆汁酸在不同疾病的多种组织调节代谢平衡和免疫,操纵胆汁酸池及其受体h活性可能是一种全新的治疗选择。
BA通过反馈机制影响胆汁酸组成和浓度促进胆汁酸肠肝循环。抑制肠道BA重吸收减少循环BA池,导致FGF19水平降低,胆固醇转化为BA增加,血清胆固醇水平降低。UDCA和TUDCA能够促进胆汁分泌,并已经用于临床治疗。本综述总结了胆汁酸的膜受体和核受体在组织和细胞分布,梳理了相关天然或合成配体。关于FXR在肝脏和肠道中激活仍存在争议,或受机体微环境影响。另外,通过粪菌移植、共生菌群传递、基因工程菌等方式可调节肠道菌群从而影响胆汁酸结构及代谢,为BAs临床治疗提供新思路。
小结
本综述总结了起源于肠肝循环并扩展到外周器官的BAs调节的代谢和免疫稳态过程,强调了胆汁酸作为外周组织信号分子的重要性,并提出肠-肝轴作为潜在药物靶点的观点,但基于胆汁酸的肝-肠轴有效安全的治疗仍值得进一步研究。BAs的研究重点将继续探索BAs在稳态和疾病状态下与其他器官之间复杂的相互作用,开发基于代谢性、神经精神性、免疫性等众多疾病的新型药物治疗方法具有重大前景。
参考文献
【1】Jia W., Li H., Zhao L. et al. Gut microbiota: a potential new territory for drug targeting. Nat Rev Drug Discov 7, 123–129 (2008).
【2】Jia W, Xie G and Jia W. Bile acid–microbiota crosstalk in gastrointestinal inflammation and carcinogenesis. Nat Rev Gastroenterol Hepatol 15, 111–128 (2018).
【3】Jia W, Rajani C, Kaddurah-Daouk R, et al. Expert insights: The potential role of the gut microbiome-bile acid-brain axis in the development and progression of Alzheimer’s disease and hepatic encephalopathy. Med Res Rev. 2020 Jul;40(4):1496-1507.
【4】Jia W, Wei M, Rajani C. et al. Targeting the alternative bile acid synthetic pathway for metabolic diseases. Protein Cell 2021, 12(5):411–425
【5】Jia W, Li Y, Cheung K.C.P. et al. Bile acid signaling in the regulation of whole body metabolic and immunological homeostasis. Sci China Life Sci (2023).
【6】Zheng X, Chen T, Jiang R, et al. Hyocholic acid species improve glucose homeostasis through a distinct TGR5 and FXR signaling mechanism. Cell Metab 2021, 33, 791–803.
【7】Huang F, Zheng X, Ma X, et al. Theabrownin from Pu-erh tea attenuates hypercholesterolemia via modulation of gut microbiota and bile acid metabolism. Nat Commun 2019, 10, 4971.
绘谱帮你测
针对胆汁酸谱,麦特绘谱基于外标+同位素内标可靶向定量检测65+种胆汁酸及其衍生物。目前,胆汁酸检测技术已协助发表客户文章50余篇,包含Cell Metabolism, Nature Communications, Nature Aging, Advanced Science, Microbiome, Science Advances, Diabetes Care等期刊;成果涵盖肝病、肠病、心血管疾病、糖尿病、肥胖、衰老、肿瘤/癌症、畜牧动物、中药药效等研究领域。
往期回顾
1. Cell Metabolism | 猪胆酸类再显神通!贾伟/郑晓皎/贾伟平等揭示猪去氧胆酸通过调控肠肝轴治疗NAFLD的新机制
2. Advanced Science | 胃胆汁酸-微生物促进胆汁反流性胃癌发生新机制
3. Nature Communications | 肠道菌-胆汁酸代谢作用有效减轻节食后体重反弹
4. Protein&Cell | 胆汁酸替代合成途径与代谢性疾病

| 标签: | 胆汁酸,代谢,免疫 |