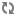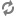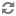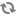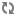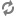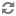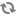PHYTO‑PAM 全球第一款可自动对浮游植物分类的荧光仪
有害藻华(HABs)监测/预警的强大工具 主要功能 
1)对自然水体中的蓝藻、绿藻和硅/甲藻自动分类(定性)
2)自动测量水样中蓝藻、绿藻和硅/甲藻的叶绿素a含量(定量)和总叶绿素a含量
3)一杯自然水样,同时获得蓝藻、绿藻和硅/甲藻的光合活性:
* 光合效率和光合速率(相对电子传递速率)
* 快速光曲线并进行拟合
* 藻类的潜在zei大光合效率(“
生长潜能”)
* 藻类的
光保护能力 * 藻类
耐受强光的能力 4)用户可做自己的参考光谱
应用领域 主要用于水生生物学、水域生态学、海洋学、湖沼学、水质预警、微藻生理学、微藻抗逆性等领域,对于了解自然水体中藻类种群的动态变化、水华预警、野外水体中光合作用的时空变化、校正初级生产力的计算等有较大帮助。
特别适于浮游植物动力学研究和有害藻华(HABs)的早期预警。 测量参数 Fo, Fm, F, Fm', Fv/Fm, Y(II)=ΔF/Fm', ETR, a, Ik, Pm, PAR、蓝藻Chla含量、绿藻Chla含量、硅/甲藻Chla含量、总Chla含量等
特点 1)
全世界第一台可对浮游植物自动分类的调制叶绿素荧光仪
2) 4波长光源:470、520、645和665 nm
3) 对蓝藻、绿藻和硅/甲藻进行分类
4) 可选配室内系统(I)、野外系统(II)和测附着藻类/大型藻类的系统(III)
5) 灵敏度高,检测限为0.1 μg L
-1 Chl
6) 专业PhytoWin操作软件,数据收集、分析和存贮功能强大
7)
用户可利用培养的微藻做参考光谱,非“黑匣子” 8)
可在野外测量后根据水体藻类组成利用优势种(一种或多种)的参考光谱校对实验结果 利用PHYTO-PAM进行水华预警的原理 藻类的生长靠光合作用,藻华的爆发是在特定的环境条件下(富营养、高光、高温)由藻类短期快速暴增造成的,这其间藻类必须具备极强的光合作用才能快速生长。
监测叶绿素a含量可以了解目前水体中的藻类生物量,但这只代表历史(如果营养盐很低,即使当前藻类生物量高,也不具备发生藻华的可能);而监测藻类的光合作用活性可以了解藻类的“生长潜能”,结合其它环境条件可以预测未来(富营养条件且高光高温下,即使当前藻类生物量不高,但只要光合作用活性强,就具有极大的发生藻华的可能)。 由于PHYTO-PAM可以测量自然水样中蓝藻、绿藻和硅/甲藻各自的光合作用,就可以对藻华发生时不同藻类类群进行分析。利用PHYTO-PAM测量不同藻类叶绿素a含量和光合作用活性的功能,可以长期监测自然水体中
浮游植物种群生物量的动力学变化和
不同类群光合作用潜力的变化趋势,这对于藻华的预警具有重要参考价值。
推荐阅读:
有害藻华(HABs)监测/预警的新解决方案 PHYTO-PAMzei常用的光合作用参数
Fv/Fm,浮游植物的潜在zei大光合效率(“
生长潜能”)
Y,给定光强下浮游植物的实际光合效率
NPQ,浮游植物将过剩光能耗散为热的能力,即
光保护能力
ETR,给定光强下浮游植物的实际光合速率
ETRmax,浮游植物的潜在zei大光合速率
a,浮游植物对光强的利用能力
Ik,浮游植物
耐受强光的能力
快速光曲线,结合水体光场可用于计算水体初级生产力
利用PHYTO-PAM对水体长期监测的方法 设计为大时间尺度,采样频率为每月一次,频率越高越好。采样时可设计多个样点,每个样点都分层采样测量。这样就可测量蓝藻Chla、绿藻Chla、硅/甲藻Chla、总Chla、Fv/Fm、Ik、NPQ等的时间和空间动态变化,获知三大类群的浮游植物
生物量、“生长潜能”、耐受强光的能力、光保护能力等的时空动态变化,提前预判其变化趋势,结合其它水质气象指标,进行早期的藻华预警。
应用实例一:
太湖蓝藻水华成因分析 2007年,太湖发生了严重的蓝藻水华,在国内外引起广泛关注。蓝藻水华爆发的一个重要原因是周边地区往太湖中排污过多,造成湖泊严重富营养化,在适宜的光照和温度条件下藻类疯长形成水华。但是太湖中的藻类不仅仅包括蓝藻,也有绿藻、硅藻、甲藻等,为什么总是爆发蓝藻水华,其它藻并不形成水华呢?
中国科学院南京地理与湖泊研究所湖泊与环境国家重点实验室科研人员利用可对自然水体中的藻类定性、定量并测量光合作用活性的
浮游植物荧光仪PHYTO-PAM,探讨了蓝藻在太湖中爆发水华的原因。主要研究结果如下:光作为藻类生长的重要能量来源,浮游藻类光利用效率的不同对水体中浮游藻类初级生产力、群落组成以及种群演替具有重要影响。本研究发现蓝藻、绿藻、硅/甲藻三种具有不同的对光照和垂直混合的响应策略,蓝藻的强光耐受能力以及对过剩光能的耗散能力均超过其他两种藻;同时蓝藻主要聚集在表层到0.3 m的深度,而在此深度藻类具有更高的生长速率,绿藻和硅/甲藻则由于垂直混合和自身调节等作用的作用下,不具备蓝藻这一优势,这可能是富营养化水体中蓝藻占据优势的原因之一。(Zhang M, Kong FX, Wu X, Xing P.
Different photochemical responses of phytoplankters from the large shallow Taihu Lake of subtropical China in relation to light and mixing. Hydrobiologia 2008,
603:267-278.)
应用实例二:
微囊藻低温弱光环境下过冬机理 经常发生水华的微囊藻在冬天会沉降到底泥中进行越冬。底泥属于低温弱光环境,在这么苛刻的环境下微囊藻是怎么越冬的,目前了解的不多。
中国科学院水生生物研究所淡水生态与生物技术国家重点实验室科研人员利用人工培养的单细胞铜绿微囊藻、群体铜绿微囊藻和斯尾栅藻进行了低温弱光环境下的耐受力和复壮实验,其中光合作用活性的测量利用
浮游植物荧光仪PHYTO-PAM进行。结果发现经过30天的低温弱光环境处理后,栅藻的光合活力受到显著抑制,而微囊藻仅受到轻微影响,且群体微囊藻细胞比单细胞微囊藻的耐受力更强。复壮培养后,栅藻的回复速度和生长潜力明显低于微囊藻。这对于分析微囊藻的越冬机理和水华机理具有重要参考意义。(Wu Z, Song L, Li R.
Different tolerances and responses to low temperature and darkness between waterbloom forming cyanobacterium Microcystis and a green alga Scenedesmus Hydrobiologia 2008,
596:47-55.)
选购指南 ● 基础配置
○ 可选配置 | 系统I
(实验室版)
| 系统II
(野外版)
| 系统III
(光纤版)
|
| 主机PHYTO-C | ● | ● | ● |
| 测量光LED阵列PHYTO-ML | ● | | |
| 光化光LED阵列PHYTO-AL | ● | | |
| 光电倍增管PM-101P | ● | | |
| 光学单元ED-101US/MP | ● | | |
| 工作台ST-101 | ● | | |
| 激发-检测单元PHYTO-ED | | ● | |
| 光纤型激发-检测单元PHYTO-EDF | | | ● |
| 微型磁力搅拌器PHYTO-MS |  ○ ○ | | |
| 球状微型光量子探头US-SQS |  ○ ○ |  ○ ○ |  ○ ○ |
| 温度控制器US-T |  ○ ○ | | |
| 搅拌器WATER-S | |  ○ ○ | |
主要技术参数 测量光:波长470、520、645和665 nm的测量光LED。
光化光:波长655 nm的LED;光化光强度0~2000 μmol m
-2 s
-1 PAR(系统I和II)或0~1300 μmol m
-2 s
-1 PAR(系统III)。
饱和脉冲:波长655 nm的LED;饱和脉冲强度4000 μmol m
-2 s
-1 PAR(系统I和II)或2600 μmol m
-2 s
-1 PAR(系统III)。
信号检测:光电倍增管,带短波截止滤光片(λ>710 nm);选择性锁相放大器。
测量参数:Ft, F(或Fo), Fm(或 Fm’), ΔF, Y(ΔF/ Fm’或Fv/Fm), ETR和Chl浓度等。
环境温度:-5~+45 ℃,已在极地成功应用。
部分文献 1.Guasch H, Atli G, Bonet B, Corcoll N, Leira M, Serra A: Discharge and the response of biofilms to metal exposure in Mediterranean rivers.
Hydrobiologia2010:in press.
[PHYTO-PAM] 2.Liu Y, Wang W, Zhang M, Xing P, Yang Z: PSII-efficiency, polysaccharide production, and phenotypic plasticity of
Scenedesmus obliquus in response to changes in metabolic carbon flux
Biochemical Systematics and Ecology2010:in press.
[PHYTO-PAM] 3.Pesce S, Margoum C, Montuelle B: In situ relationships between spatio-temporal variations in diuron concentrations and phototrophic biofilm tolerance in a contaminated river.
Water Research2010,
44:1941-1949.
[PHYTO-PAM] 4.Soares MCS, Lürling M, Huszar VLM: Responses of the rotifer Brachionus calyciflorus to two tropical toxic cyanobacteria (Cylindrospermopsis raciborskii and Microcystis aeruginosa) in pure and mixed diets with green algae.
Journal of Plankton Research2010:in press.
[PHYTO-PAM] 5.van Ruth PD, Ganf GG, Ward iM: The influence of mixing on primary productivity: A unique application of classical critical depth theory
Progress In Oceanography2010:in press.
[PHYTO-PAM] 6.Wang H, Liu L, Liu ZP, Qin S: Investigations of the characteristics and mode of action of an algalytic bacterium isolated from Tai Lake.
Journal of Applied Phycology2010:in press.
[PHYTO-PAM] 7.Zhu J, Liu B, Wang J, Gao Y, Wu Z: Study on the mechanism of allelopathic influence on cyanobacteria and chlorophytes by submerged macrophyte (
Myriophyllum spicatum) and its secretion
Aquatic Toxicology2010:in press.
[PHYTO-PAM] 8.任秋芳, 阿依巧丽, 智朱, 张义方, 波曾: 三峡库区季节及养分对铜绿微囊藻生长的影响——模拟乌江回水区水环境的研究.
重庆师范大学学报2010,
27(1):1-4.
[PHYTO-PAM] 9.Aikawa S, Hattori H, Gomi Y, Watanabe K, Kudoh S, Kashino Y, Satoh K: Diel tuning of photosynthetic systems in ice algae at Saroma-ko Lagoon, Hokkaido, Japan
Polar Science2009,
3(1):57-72.
[PHYTO-PAM] 10.Dimier C, Brunet C, Geider R, Raven J: Growth and photoregulation dynamics of the picoeukaryote
Pelagomonas calceolata in fluctuating light
Limnology and Oceanography2009,
59(3):823-836.
[PHYTO-PAM] 11.Franklin D, Choi CJ, Hughes C, Malin G, Berges JA: Effect of dead phytoplankton cells on the apparent efficiency of photosystem II.
Marine Ecology Progress Series2009,
382:35-40.
[PHYTO-PAM] 12.Hall SR, Becker CR, Simonis JL, Duffy MA, Tessier AJ, Cáceres CE: Friendly competition: evidence for a dilution effect among competitors in a planktonic host–parasite system.
Ecology2009,
90(6):1441-1448.
[PHYTO-PAM] 13.Izagirre O, Serra A, Guasch H, Elosegi A: Effects of sediment deposition on periphytic biomass, photosynthetic activity and algal community structure.
Science of The Total Environment2009,
407(21):5694-5700.
[PHYTO-PAM] 14.Lee Y, Kang C, Kwon K, Kim S: Organic and inorganic matter increase related to eutrophication in Gamak Bay, South Korea
Journal of Environmental Biology 2009,
30(3):373-380.
[PHYTO-PAM] 15.Lee YS, Kim JD, Lim WA, Lee SG: Survival and growth of Cochlodinium polykrikoides red tide after addition of yellow loess.
Journal of Environmental Biology2009,
30(6):929-932.
[PHYTO-PAM] 16.Marchetti A, Parker MS, Moccia LP, Lin EO, Arrieta AL, Ribalet F, Murphy MEP, Maldonado MT, Armbrust EV: Ferritin is used for iron storage in bloom-forming marine pennate diatoms.
Nature2009,
457:467-470.
[PHYTO-PAM] 17.Morin S, Pesce S, Tlili A, Coste M, Montuelle B: Recovery potential of periphytic communities in a river impacted by a vineyard watershed
Ecological Indicators2009,
10(2):419-426.
[PHYTO-PAM] 18.Nymark M, Valle KC, Brembu T, Hancke K, Winge P, Andresen K, Johnsen G, Bones AM: An Integrated Analysis of Molecular Acclimation to High Light in the Marine Diatom
Phaeodactylum tricornutum.
PLoS ONE2009,
4(11):e7743. doi:7710.1371/journal.pone.0007743.
[PHYTO-PAM] 19.Pesce S, Margoum C, Montuelle B: In situ relationships between spatio-temporal variations in diuron concentrations and phototrophic biofilm tolerance in a contaminated river.
Water Research2009,
44(6):1941-1949.
[PHYTO-PAM] 20.Serra A, Corcoll N, Guasch H: Copper accumulation and toxicity in fluvial periphyton: The influence of exposure history
Chemosphere2009,
74(5):633-641.
[PHYTO-PAM] 21.Serra A, Guasch H: Effects of chronic copper exposure on fluvial systems: Linking structural and physiological changes of fluvial biofilms with the in-stream copper retention.
Science of The Total Environment2009,
407(19):5274-5282.
[PHYTO-PAM] 22.Serra A, Guasch H, Martí E, Geiszinger A: Measuring in-stream retention of copper by means of constant-rate additions
Science of The Total Environment2009,
407(12):3847-3854.
[PHYTO-PAM] 23.Shi S, Tang D, Liu Y: Effects of an Algicidal Bacterium
Pseudomonas mendocina on the Growth and Antioxidant System of
Aphanizomenon flos-aquae Current Microbiology 2009,
59(2):107-112.
[PHYTO-PAM] 24.Wu Z, Shi J, Li R: Comparative studies on photosynthesis and phosphate metabolism of
Cylindrospermopsis raciborskii with
Microcystis aeruginosa and
Aphanizomenon flos-aquae Harmful Algae 2009,
8(6):910-915.
[PHYTO-PAM] 25.Yang Z, Kong F, Yang Z, Zhang M, Yu Y, Qian S: Benefits and costs of the grazer-induced colony formation in Microcystis aeruginosa.
Ann Limnol - Int J Lim2009,
45(3):203-208.
[PHYTO-PAM] 26.陈元, 赵洋甬, 潘双叶, 徐运, 蒋蕾蕾: PHYTO-PAM对浮游植物中叶绿素的分类测定.
现代科学仪器2009(4):100-104.
[PHYTO-PAM] 27.朱晓敏, 黄清辉, 李建华: 咸水藻水华期溶解有机质光谱特征变化的模拟.
中国环境科学2009,
29(1):68-72.
[PHYTO-PAM] 28.Brussaard CPD, Timmermans KR, Uitz J, Veldhuis MJW: Virioplankton dynamics and virally induced phytoplankton lysis versus microzooplankton grazing southeast of the Kerguelen (Southern Ocean)
Deep Sea Research2008,
55(5-7):752-765.
[PHYTO-PAM] 29.Howeth JG, Leibold MA: Planktonic dispersal dampens temporal trophic cascades in pond metacommunities.
Ecology Letters2008,
11(3):245-257.
[PHYTO-PAM] 30.Ingleton T, Kobayashi T, Sanderson B, Patra R, Macinnis-Ng CMO, Hindmarsh B, Bowling LC: Investigations of the temporal variation of cyanobacterial and other phytoplanktonic cells at the offtake of a large reservoir, and their survival following passage through it.
Hydrobiologia2008,
603(1):221-240.
[PHYTO-PAM] 31.Schmitt-Jansen M, Altenburger R: Community-level microalgal toxicity assessment by multiwavelength-excitation PAM fluorometry
Aquatic Toxicology2008,
86(1):49-58.
[PHYTO-PAM] 32.Timmermans KR, Veldhuis MJW, Laan P, Brussaard CPD: Probing natural iron fertilization near the Kerguelen (Southern Ocean) using natural phytoplankton assemblages and diatom cultures.
DeepSeaResearch2008,
55(5-7):693-705.
[PHYTO-PAM] 33.Wang G, Chen K, Chen L, Hu C, Zhang D, Liu Y: The involvement of the antioxidant system in protection of desert cyanobacterium
Nostoc sp. against UV-B radiation and the effects of exogenous antioxidants
Ecotoxicology and Environmental Safety2008,
69(1):150-157.
[PHYTO-PAM] 34.Wu Z, Song L, Li R: Different tolerances and responses to low temperature and darkness between waterbloom forming cyanobacterium
Microcystis and a green alga
Scenedesmus Hydrobiologia 2008,
596(1):47-55.
[PHYTO-PAM] 35.Wu Z-X, Song L-R: Physiological comparison between colonial and unicellular forms of
Microcystis aeruginosa Kutz. (Cyanobacteria).
Phycologia2008,
47(1):98-104.
[PHYTO-PAM] 36.Zhang M, Kong FX, Wu X, Xing P:
Different photochemical responses of phytoplankters from the large shallow Taihu Lake of subtropical China in relation to light and mixing. In:
Hydrobiologia. vol. 603; 2008: 267-278.
37.胡智泉, 刘永定, 肖波: 微囊藻毒素对几种淡水微藻的生长和光合活性的影响.
生态环境2008,
17(3):885-890.
[PHYTO-PAM] 38.康丽娟, 潘晓洁, 常锋毅, 李敦, 沈银武, 刘永定: HCO
3-碱度增加对铜绿微囊藻光合活性和超微结构的影响.
武汉植物学研究2008,
26(1):70-75.
[PHYTO-PAM] 39.康丽娟, 潘晓洁, 常锋毅, 李敦海, 沈银武, 刘永定: 碱度增加对蛋白核小球藻光合活性与胞外多糖的影响.
湖泊科学2008,
20(2):251-256.
[PHYTO-PAM] 40.林
浮游植物分类荧光仪Phyto-PAM信息由上海泽泉科技有限公司为您提供,如您想了解更多关于浮游植物分类荧光仪Phyto-PAM报价、型号、参数等信息,欢迎来电或留言咨询。
注:该产品未在中华人民共和国食品药品监督管理部门申请医疗器械注册和备案,不可用于临床诊断或治疗等相关用途



 扫一扫即可访问手机版展台
扫一扫即可访问手机版展台