400-6699-117转1000
咨询列表
南京集思慧远生物科技有限公司
您好,欢迎您查看分析测试百科网,请问有什么帮助您的?



| 参考报价: | 面议 | 型号: | 蛋白修饰 |
| 品牌: | 集思慧远 | 产地: | 南京 |
| 关注度: | 11 | 信息完整度: | |
| 样本: | 典型用户: | 暂无 |
400-6699-117转1000
产品简介
随着蛋白质组研究的发展,我们越来越深刻地意识到,对于生物体生命活动的管理和调控过程,与之密切相关的不仅是蛋白质表达水平的不同状态,更加是蛋白质在翻译后修饰水平上的活动。结合高质、专业的蛋白质翻译后修饰富集技术和丰富的、准确的定量手段,实现不同生理病理状态下生物样本在翻译后修饰水平上的定量比较,深入地揭示翻译后修饰水平的波动与生物生命活动的密切联系。
蛋白质翻译后修饰具有重要的生物学意义。通过翻译后修饰蛋白质的结构更为复杂,功能更为丰富。磷酸化涉及到细胞信号转导,细胞的增殖,发育和分化过程;糖基化在细胞的免疫保护等 生物过程中起重要作用;组蛋白的甲基化和乙酰化与转录调节有关。
磷酸化
磷酸化修饰是生物体内重要的共价修饰方式之一,与信号转导、细胞周期、生长发育以及癌症机理等诸多生物学问题密切相关。鉴定蛋白质磷酸化位点有助于阐明蛋白质磷酸化的机制与生物学功能。目前,质谱是进行蛋白质磷酸化分析有力的方法之一。
技术原理:
蛋白样品中,发生磷酸化的蛋白质和肽段含量极低,且存在各种非磷酸化肽段和无机盐的干扰,致使检测磷酸化蛋白和磷肽段非常困难。
TiO2是常用、发展成熟的富集磷酸化蛋白/肽段的一种方法。在酸性条件下,TiO2表面带正电,可以与磷酸化肽发生静电作用而达到吸附的目的。样品经酶解后,用TiO2微球对磷酸化肽段进行富集,富集后的产物由高精度质谱分析,并通过专业软件完成数据检索。另外,TiO2富集结合iTRAQ标记,二甲基标记等蛋白质定量方法,还可以进行定量磷酸化蛋白质组分析。
技术优势:
TiO2富集效率高达95%,可提高修饰肽段检测效率;
基于高精度的质谱分析,准确鉴定修饰位点;
应用领域:
疾病机理研究
个性化医疗
农业品种改良
糖基化
蛋白质的N-糖基化位点修饰是重要的蛋白质翻译后修饰之一,主要在复杂的多细胞或组织形成过程中起关键作用。蛋白质的N-糖基化修饰位点具有保守的氨基酸序列NX(S/T),其中X为除脯氨酸以外的其它氨基酸。
技术原理:
凝素亲和法是目前糖蛋白质组学中应用广泛的分离富集方法。凝集素(lectin)是一类糖结合蛋白质,能专一识别某一特殊结构的单糖或聚糖中特定的糖基序列而与之结合,它们与糖链可逆非共价结合,糖蛋白或糖肽被凝集素捕获之后,通常用特定的单糖通过竞争结合凝集素将糖蛋白或糖肽洗脱下来。
蛋白质经过酶解后利用凝集素(lectin)富集N-糖基化肽段,然后用N-糖酰胺酶(PNGase)在H218O中切除连接在天冬酰胺残基(Asn)上的糖链。该处理致使Asn分子量增加2.9890Da。最后用高精度LC-MS质谱仪检测脱糖后的肽段,并通过MASCOT软件检索数据库,确认脱糖后分子量与其理论分子量的变化以及糖基化修饰肽段的序列,从而确定该蛋白质的N-糖基化位点。
N-糖基化位点确定之后,再利用label-free的原理对其进行定量分析。
优势及应用领域:
大规模的蛋白质组N-糖基化位点的鉴定与分析
应用于疾病机理研究 、信号传导途径分析等
技术路线:
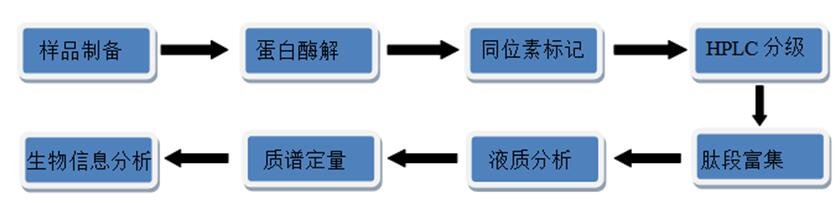
内容分析
磷酸化等位点鉴定;
Unique肽段数分布;
肽段长度分布;
肽段质量误差分布;
蛋白覆盖度分布;
磷酸化蛋白质等定量信息统计;
磷酸化等蛋白质丰度比(FC)分布;
差异磷酸化等蛋白质的功能注释(两个或以上样品);
差异磷酸化等蛋白质的GO和KEGG富集分析(两个或以上样品);
差异蛋白质互作网络。
样品要求:
1.样品类型:总蛋白;
2.样品总量:>500mg(新鲜组织样); >300ug-500ug(提取蛋白量)。
3.样品重复:三个生物重复或技术重复
案例分析
MAPK途径的磷酸化蛋白质组分析揭示了新的反馈机制
本研究通过不同处理的HCT116细胞;不同TCGA癌症类型的肿瘤和健康组织,进行磷酸化蛋白组鉴定以及差异分析 。
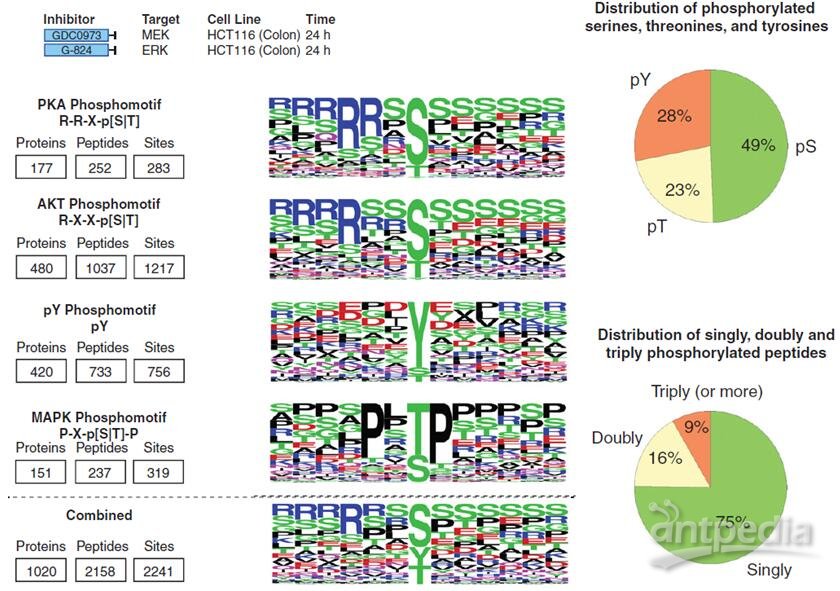
MAPK信号调节的磷酸化蛋白质的鉴定
参考文献:
1. Gnad F, Doll S, Song K, et al. Phosphoproteome analysis of the MAPK pathway reveals previously undetected feedback mechanisms[J]. Proteomics, 2016, 16(14): 1998-2004.
蛋白修饰分析信息由南京集思慧远生物科技有限公司为您提供,如您想了解更多关于蛋白修饰分析报价、型号、参数等信息,欢迎来电或留言咨询。
注:该产品未在中华人民共和国食品药品监督管理部门申请医疗器械注册和备案,不可用于临床诊断或治疗等相关用途