
诚信认证:
工商注册信息已核实! 扫一扫即可访问手机版展台
扫一扫即可访问手机版展台
数字PCR的数学原理及系统间相互比较
数字PCR的数学原理及系统间相互比较
摘要:
数字PCR是将PCR反应分成许多单元,每个单元中都包含离散数量的靶基因拷贝(0,1,2,3 ,……)。数字PCR这项强大的技术,使得核酸定量,基因型检测等应用的检测限更低,检测结果更加准确。本文的从分区的优点和泊松统计开始,包括误差的来源方面,探讨一下数字PCR的数学原理。我们讨论比较五种商品化的数字PCR仪器,主要分为芯片型(cdPCR)和液滴型(ddPCR)的两种,对市面上主流的数字PCR参数进行了比较。
1. 数字分析检测和模拟分析检测

图1. 模拟分析检测(实时荧光定量PCR)和数字分析检测(数字PCR)的比较
模拟分析检测是在反应体系中检测与总体核酸样品浓度C成正比的读出信号A。通常使用荧光方法进行检测,例如使用标记的探针,检测荧光信号,从而定量靶基因的核酸拷贝数。数字分析检测是首先将样品分到多个单元中,每个单元的都包含离散数量的靶基因拷贝(0,1,2,3 ,……),每个单元都被独立检测,检测结果为0(阴性)或1(阳性),标示独立单元中是否存在靶基因拷贝。利用泊松分布统计,检测阴性单元的比例,就能够计算出原始样品中靶基因的拷贝数。
数字PCR的概念来源于计算机系统,计算机中的数字回路提供二进制输出。数字信号在计算和通信领域被广泛应用,信息被编码为一系列0和1。数字信号的优点是降低了检测元素的负担,每个元素只需要区分两种信号:阴性和阳性。在数字PCR中,仪器只需要分辨阴阳性的区别就可以了,然后通过泊松分布的统计方式,可以得知阴性单元的比例与样品中的靶基因拷贝数相关。
2. 分区的优点

图2. 数字PCR进行分区的好处:A. 增加靶基因的有效浓度,B. 富集效果,降低背景干扰。
随着分区后,单元数量的增加和单元体积的减少,能够体现出三个明显的好处。
第一个好处是:显著降低检测限(LOD: Limit of detection)。因为分区单元的体积越小,每个单元中靶基因拷贝的浓度越高。这种特性使得数字PCR能够进行微量的核酸检测,或者检测分泌到细胞外环境的核酸。
第二个好处是:分区后,每个单元的富集作用能够有效改善复杂混合物检测结果。具体的说数字PCR方法提升了感兴趣靶点的信号,拉开了与背景信号的比值。以图2B为例,在数字PCR反应体系中,一个分区单元中实现了8倍纯化,另一个分区单元中实现了完全纯化。数字PCR的富积效应有效实现了低丰度核酸对野生型背景的扩增效率,对于癌症诊断等应用非常有用。分区数量的越多,数字PCR的富集作用越强。
第三个好处是:数字PCR在计算靶基因拷贝数时,相比实时荧光定量PCR能够提供更加出色检测精度和线性。因为数字PCR检测的是PCR体系中的单个靶基因分子,而不是靶基因在反应体系中的整体浓度。数字PCR检测精度随着分区数量提高而提高;分区数量的增加也会扩展动态范围,提升被检测样品的浓度范围。
3. 分区的方法:物理隔室和微滴
目前主流的数字PCR系统主要使用两种方式实现PCR反应体系的分区:1)使用物理的腔室或小孔阵列,2) 使用微滴乳液方式,在连续的油相中分隔水相(PCR反应体系)。通过这两种方式,实现不同的分区单元的体积。
腔室阵列也称为芯片式数字PCR,通过使用光刻工艺和微细加工工艺实现腔室小型化。例如,光刻和硅蚀刻工艺已被用于制造50,000个用于数字酶联免疫吸附测定(ELISA)的孔,每个孔的体积为50fL。用于执行数字酶分析的类似平台,孔设计为可容纳1.4 fL也可以通过在1μm的硅结构上微成型柔性弹性体(PDMS)来制造。腔室阵列也可以使用微成型或压印光刻技术在塑料中制备,以及使用软光刻的变体在其他材料中制成。生产过程的再溶解决定了体积的可变性。使用光刻技术,公差可以小至数百纳米,而使用纳米级压印光刻技术,公差可以小于25 nm。分区单元的体积可变性会导致数字计数分析的不确定性,这个我们下一节再说。
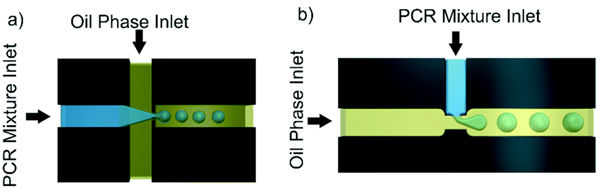
图3. 微滴式数字PCR微流控示意图,a)液流与油流十字交叉结构,b)液流与油流T型接头结构。
第二种分配方法是利用油中的液滴乳液(微滴式数字PCR)。通过使用微流控T型接头制备单分散液滴,其中水流与油流结合,或者通过液流聚焦交叉几何结构将水流与两条正交油流结合。更先进的方式是通过约束梯度来生成微滴,通过将液流通过一个固定角度的斜坡,不依赖流体流动的生成液滴,液滴的大小更加稳定。微滴式数字PCR中的油相是非反应性的,对水相成分溶解度很低,防止PCR反应物在微滴单元之间扩散;通常选择碳氟化合物油。稳定的液滴生成需要添加表面活性剂来稳定水油界面并防止液滴聚结。必须对表面活性剂进行优化,使其不干扰检测,并防止小生物分子扩散到油中。

图3. 基于约束梯度生成微滴的结构草图,水相(蓝色)通过路口通道进入装满油相(橙色)的储液器中,储液器的顶部倾斜了一个角度α。水相进入油相后,通过固定角度的斜坡,不需要流动的油相,形成大小均一的微滴。
通常来说,芯片式数字PCR的物理腔室的体积差异的分散度<3%,微滴式数字PCR的微滴体积差异分散度<5%,但是基于约束梯度生成微滴的方式生成的微滴,微滴的体积差异小于芯片式数字PCR,体积差异分散度可低至0.1%,是目前最均一的微滴生成方式。芯片式数字PCR在物理腔室的内壁上需要涂抹封闭剂(例如,牛血清白蛋白),防止生物分子被腔室壁吸附和防止PCR反应酶失活。微滴式数字PCR需要使用两性亲和表面活性剂(例如,聚乙二醇)来稳定水油界面。
4. 分区的统计学原理
在数字PCR系统中,分区统计能够确定样品中靶基因拷贝浓度和置信区间。分区操作类似我们在实验室中分装样品,但是实验室中分装样品时,由于每个分装数量较少,每个单元中包含有大量样品,体现不出样品的统计学差异。在数字PCR系统中,需要将PCR体系分区为数以万计的单元;这时就无法忽视统计学差异了。在数字PCR系统中,反应体系中总的靶基因拷贝数(m),m的数量级总是小于分区单元的总数量(n)的数量级,单个分区单元中平均包含(λ)个靶基因拷贝,通过λ的数值可计算样品中靶基因拷贝的浓度。

公式1. λ是每个分区单元中的平均靶基因拷贝数,m是反应体系中总的靶基因拷贝数,n是分区单元的总数,C是靶基因拷贝在PCR反应体系的浓度,Vd是分区单元的体积。
每个分区的单元中实际包含的靶基因拷贝数量是离散的(例如,0,1,2,3,……),那么分区中包含k个靶基因拷贝数的概率服从泊松分布(Poisson Distribution)。

公式2. 泊松分布的公式
泊松分布的均值和反差均等于λ,μ = σ2 = λ,阴性分区的单元的概率为p(0)= e-λ,因此,靶基因拷贝数(m)和样品浓度C可以很容易地从阴性分区单元的百分比(E)推导出来。



公式3. 样品浓度C和靶基因拷贝数m推导过程

图4. 泊松分布统计信息。 (A)对于各种样本浓度λ,一个分区单元包含k个拷贝的概率。 (B)对于各种样品浓度λ,每个分区单元分别为0,1,2和3个拷贝的概率。 A和B均使用泊松分布进行计算。
5. 数字PCR的误差来源
在常规的模拟分析检测(realtime-PCR)中,测量不确定度通常受检测仪器的分辨率限制,例如,荧光检测器能够分辨发射荧光的微小差异。 在像数字PCR这样的数字化检测中,检测系统仅需识别一个分区单元是0还是> 1(阴性还是阳性),这使得数字PCR对检测器或检测过程化学性质的依赖性降低,对于PCR反应的抑制剂不敏感。数字PCR有两个误差来源:采样误差和分配误差。采样误差设定了低浓度下检测限的下限,与仪器无关,而分配误差在高浓度下占主导地位,取决于仪器的采样与分区性能。
采样误差是任何生物检测都会出现的子样本误差,由于采样并不能分析所有的样品体积,只能分析其中的一个子样品,从而倒置重复测试之间的统计差异。例如,像血清这样的诊断样品可能有5ml,但是我们只能取其中20μl样品进行检测。这个采样的过程引入一个不可避免的误差,特别是当原始样品中需要被检测的靶基因拷贝数很少时。当对于较大样品的一部分进行采样时,每个样本中靶基因拷贝数标准偏差为 ,m是分区单元中预期的靶基因拷贝数,基于标准化测量的不确定度计算如下:对于95%置信区间(CI),Zc为1.96。
,m是分区单元中预期的靶基因拷贝数,基于标准化测量的不确定度计算如下:对于95%置信区间(CI),Zc为1.96。

分配误差,这个是只有数字PCR系统才有的误差,因为同一个实验中靶基因的拷贝分布可能每次都不同。阴性分区单元的百分比(E)的标准误差为 ,基于标准化测量的不确定度计算如下:
,基于标准化测量的不确定度计算如下:

分配误差在靶基因拷贝浓度特别高(λ数值大)的时候和靶基因拷贝浓度特别低(λ数值小)的时候非常显著,靶基因浓度高的时候,几乎没有阴性分区单元(E趋近于0);靶基因浓度特别低的时候,则几乎全部都是阴性分区单元(E趋近于1)。在低浓度下,分配误差包含采样误差,因为两个误差都基于二项式分布和泊松分布的相同概念。在实践中,我们可以通过重复实验,降低实验带来的不确定度。

假设A系统产生2万个微滴和B系统产生100万个微滴,则数字PCR检测中的采样误差和分区误差在不同浓度中的数值曲线。
图5比较了在2万个微滴和100万个微滴的情况下,采样误差和分配误差带来的影响。在λ数值很大的情况下,分配误差限制了可以检测的最大浓度;在λ数值很小的情况下,两种误差都会增加。可以看到,在微滴数量越多,在相同λ数值下,误差越小,说明了分区数量越多,仪器误差越小的数学基础。
泊松分布的数学基础是假设所有的分区单元体积和PCR反应条件都保持完全一致,没有考虑分配体积变化产生的影响,微滴体积的不一致会扭曲靶基因拷贝的分布。因此实际误差会包含微滴体积的不确定度影响。将体积不确定度定义为 ,结合分配误差,可以得到
,结合分配误差,可以得到

实际上微滴体积的不一致性还是挺重要的,实验的重复性产生的误差条主要受到体积不确定性的影响,基于约束梯度生成微滴原理的数字PCR仪器,能够获得优异的重复性。
6. 数字PCR系统的介绍

图6. 数字PCR中的扩增和检测化学(与实时荧光定量PCR相同)。 (A)水解探针(例如Taqman)。 (B)DNA结合探针(例如Evagreen)
数字PCR的检测原理与荧光定量PCR相同,只是在定量方式上有所不同。数字PCR反应体系中包含目标DNA,PCR试剂和荧光标记物,在热循环仪上进行PCR反应,在循环结束后,终点检测每个分区单元中的荧光信号。荧光标记物为水解探针(探针法如,Taqman)或嵌入DNA的结合燃料(染料法如,Evagreen)。使用终点法检测,PCR循环数通常>30,即使微滴中只含有1个靶基因拷贝也能被检测到,与扩增效率无关。通过检测荧光信号为阴性的微滴比例,可以通过泊松分布求出靶基因拷贝的绝对浓度,不需要依赖参考曲线。对于高浓度的样品,需要事先进行稀释,将λ数值置入适合置信区间的泊松分布定量范围(0.0001-6),这样才能获得可靠的实验结果。
7. 数字PCR之间的比较

图7. 商业dPCR系统。 (A,B)芯片式数字PCR系统。 (A)Fluidigm BioMark系统,包括(A左)芯片,(A右上)BioMark HD循环仪,(A右下)EP1阅读器和(未示出)IFC控制器。(A中):来自基因表达研究的荧光图像。 (B)Thermo Fisher Quantstudio 3D,包括(B左)带有20,000个腔室的开放式芯片,(B右)检测系统和(未显示)热循环仪。 (C-E)微滴式数字PCR系统。 (C)Bio-Rad QX100 / 200,包括(C左)液滴生成芯片,(C中)液滴检测系统以及相应的仪器。(C右):拷贝数变异研究中的两通道散点图。(D)RainDrop系统,包括源芯片和传感芯片以及它们各自的仪器。(D左下):突变检测中扩增后的两个彩色荧光液滴。D右:来自突变检测的典型两通道散点图。(E)Stilla Naica系统,包括(E左)Sapphire芯片和(E中)Naica Geode液滴发生器/热循环仪,以及(E右上)Naica Prism3检测系统。(E右下):扩增后的三色荧光滴。
目前的商品化数字PCR系统主要分为两大类:1.芯片式数字PCR(cdPCR),2.微滴式数字PCR(ddPCR)。芯片式数字PCR代表型号包括:Fluidigm公式的BioMark系统,Thermo Fisher公式的Quantstudio 3D系统。微滴式数字PCR代表型号包括:RainDance公司的RainDrop系统(2017年被收购,目前已经推出市场),Bio-red公司的QX100 / 200系统,以及Stilla公司的Naica系统。相关参数的对比见下表:
| 项目 | 荧光定量PCR | 芯片式PCR | 微滴式PCR | ||
| 仪器型号 | —— | Quantstudio 3D | BioMark qdPCR 37K | Bio-Rad QX200 | Stilla Naica |
| 分区数量 | —— | 2万 | 48x770 | 1.5万-2万 | 3万 |
| 分区体积 | —— | 0.72nL | 0.85nL | 0.837nL | 0.59nL |
| 线性范围 | 9 log | 5 log | 2 log | 5 log | 5 log |
| 样品体积 | 0.03-200μL | 14.4μL | 4μL | 20μL | 25μL |
| 检测灵敏度 | 1-2 copies | 7-8 copies | 4-5 copies | 5-6 copies | 1 copy |
| 检测分辨率 | 1.5-2-fold | 1.2-fold | 1.2-fold | 1.2-fold | 1.2-fold |
| 多重检测 | 2-6 colors | 2 colors | 2-5 colors | 2 colors | 3 colors |
| 精确度(95% CI) | 可变参数 | ±10% | NA | ±10% | ±10% |
| 单样品支出 | $2/sample | $10/sample | $400/ship | $6/sample | $7/sample |
表1. 主流商品化数字PCR系统参数比较
很显然,微滴式数字PCR系统可以更加经济高效的在单一样品产生更多的分区单元,增加的分区数量的好处如将所述:第一,显著降低检测限,样品浓度非常低的时候依然能进行有效检测;第二,产生富集效应,在相似的核酸背景中检测稀有靶标能力,这有助于检测野生型群体中的单核苷酸多态性(SNP)和其他稀有等位基因,例如循环肿瘤DNA(ctDNA);第三,增加动态范围,因此无需稀释即可容纳更大范围的样品。Stilla公司的Naica系统是目前主流商品化数字PCR系统中有效微滴数量最多的系统,检测范围更宽,分辨率更高,数据更为精准。
荧光通道的数量决定数字PCR系统在同一个样品中检测复数靶标的能力,只有Stilla公司的Naica系统能够提供3色荧光通道。目前荧光定量检测试剂盒多为3色试剂盒(例如新型冠状病毒ORF1ab、N、E三个基因靶标试剂盒),数字PCR的检测也会朝着这个方向进行发展。

可以看出Stilla公司的Naica系统在多个系统的比较中,是微滴生成数量最多的系统,也是仅有具有3重荧光通道的数字PCR,能够在同一个样品中同时进行3个基因靶标的检测。除此以外,Naica系统操作简单,反应快速,2.5小时内即可获得检测结果,也是市面上独有的具备微滴回溯和质控功能的数字PCR系统,完全区别于同类产品。Naica数字PCR系统支持广泛的基因检测和分子生物学分析,包括用于癌症诊断的液体活检研究、病毒载量检测、产前筛查和转基因成分检测等,是精准治疗中用药组合和疗效监测的先进技术。

