
诚信认证:
工商注册信息已核实! 扫一扫即可访问手机版展台
扫一扫即可访问手机版展台

纪念钱永健先生,我们来讲讲GFP的前世今生
一年前的今天
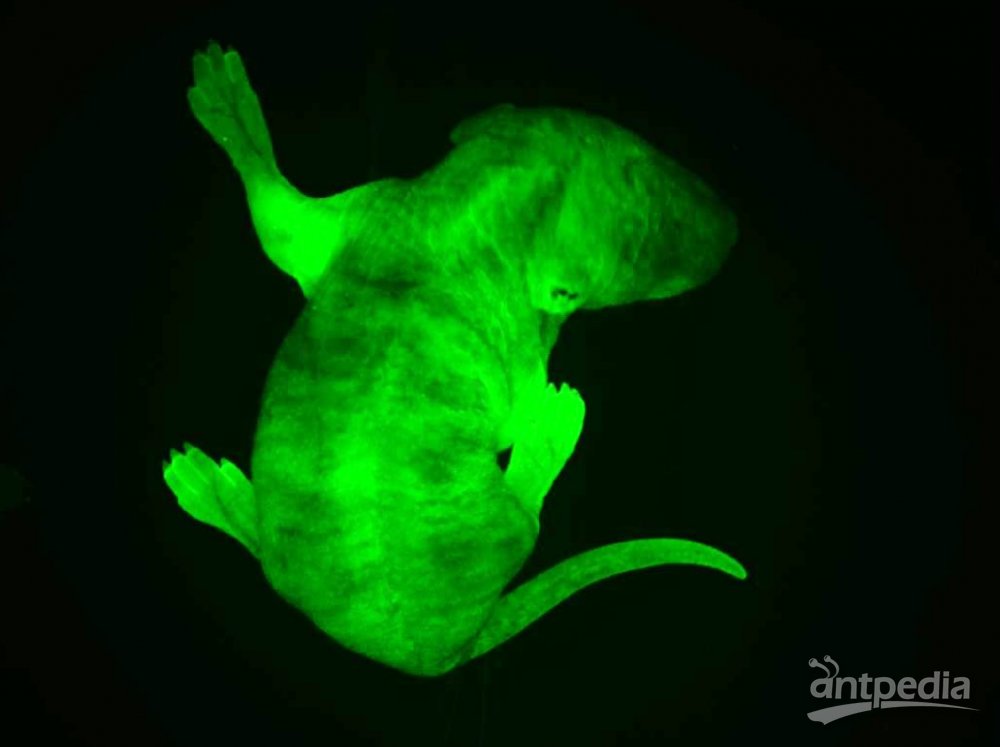
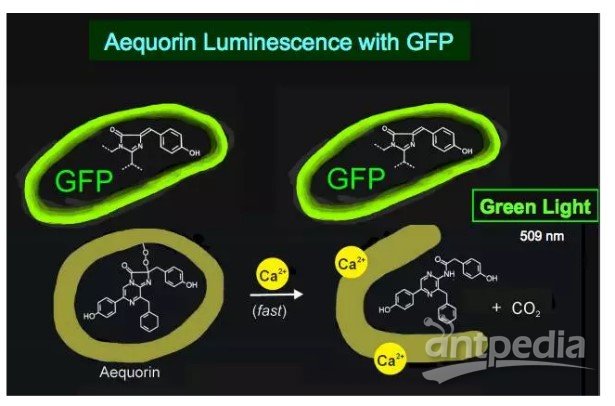
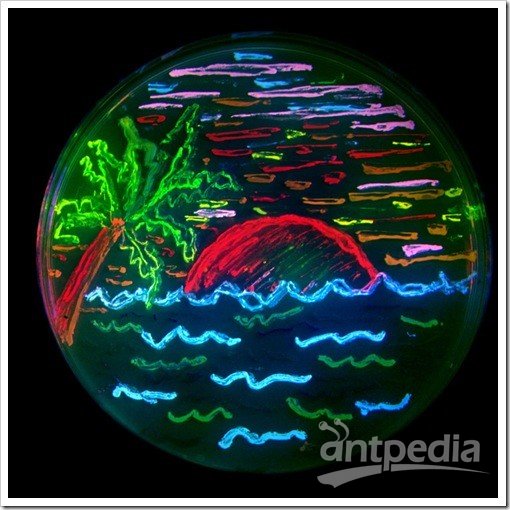
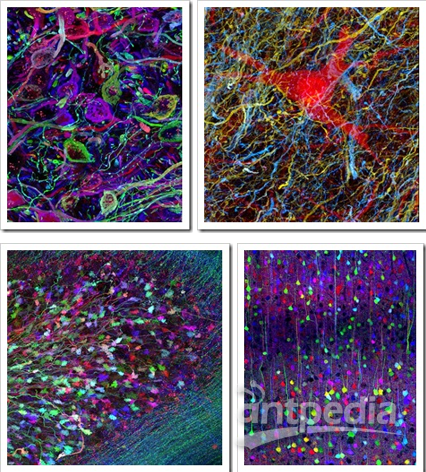
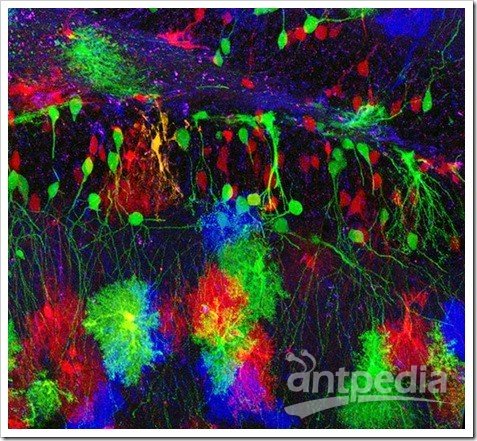
华人科学界的各个圈子都在为一条消息而惊愕和惋惜。 钱永健(1952-2016)来源:wiki 2008年诺贝尔化学奖得主、美籍华裔科学家钱永健(Roger Tsien),于2016年8月24日在美国俄勒冈州尤金县去世,享年64岁。加州大学圣迭戈分校的讣告上写道:“钱永健教授的工作照亮了科学”。的确,在绿色荧光蛋白的发展史上,钱永健占了浓墨重彩的一笔,他成功改造了绿色荧光蛋白,并拓展了绿色以外的其他颜色荧光蛋白,使荧光蛋白的应用得到了极大的普及,为同时追踪多种生物细胞变化的研究奠定了基础。如今发表的生物医药领域科研成果有一半以上都用了这一技术。 纪念钱永健:天才学霸的人生 钱永健1952年出生于美国纽约,在新泽西州利文斯顿长大。钱永健的家族可谓是“科学世家”,出了多位科学家和工程师。他是中国著名科学家钱学森的堂侄。 钱永健小时候患有哮喘,只能经常待在家里。他对化学实验感兴趣,常常在家中地下室里做化学实验,一做就是几个小时。他8岁时的实验记录本如今被收藏在瑞典斯德哥尔摩的诺贝尔博物馆中。 16岁时,钱永健获得生平第一个重要奖项,也是美国授予高中生完成科研项目的最高奖:西屋科学天才奖,当时他研究的是金属如何与硫氰酸盐结合。 上图:时任美国总统尼克松祝贺获得西屋天才奖一等奖的钱永健 钱永健后来获得美国国家优等生奖学金进入哈佛大学学习,20岁获得化学物理学士学位并前往剑桥大学深造,后获生理学博士学位。他于1989年起在加州大学圣迭戈分校工作,至今已有27年。 钱永健去年8月24日单独骑车后没有回家,被找到时已经去世。世人猜测钱永健是在骑自行车时去世的。 钱永健生前乐衷自行车运动 他的工作“点亮了科学” 钱永健一生获奖无数,几乎囊括所有生命科学领域大奖,也是唯一一位华人沃尔夫奖和诺贝尔奖“双得主”。是美国国家科学院院士、美国国家医学院院士、美国艺术与科学院院士。而其年少成名,更是当之无愧的少年天才。 著名生物学家饶毅曾写道:“钱永健的工作,从上世纪八十年代一开始就引人瞩目。他可能是世界上被邀请作学术报告最多的科学家,因为化学和生物界都爱听他的报告,既有技术应用,也有一些很有趣的现象……很多人认为钱永健会得诺贝尔奖,可以是化学奖,也可以是生理学与医学奖。” 得益于严谨的家教,人们印象中的钱永健总是谦逊、低调、诚恳。看问题的眼光独到、犀利,对科学研究充满热情和专注,对学生和同事慷慨无私。 会发光的蛋白GFP 20世纪后期,以绿色荧光蛋白(green fluorescent protein,GFP)为代表的一系列生物荧光标记蛋白的发现与应用,为生物学的大发展提供了一种全新的工具。自此之后,科学家们能够很方便地观察到活细胞的细微结构和生理过程,之前难以观察及研究的例如胚胎的发育过程、癌细胞的扩散方式等,如今变得轻而易举。 绿色荧光蛋白(GFP)的形状就像一个圆柱体 来源:圣迭戈大学钱永健实验室 绿色荧光蛋白不仅无毒,而且不需要借助其他辅酶,自身就能发光,可以让科学家在分子水平上研究活细胞的动态过程。当绿色荧光蛋白的基因和我们感兴趣的有机体内所拟研究的蛋白质基因相融合时,蛋白质既能保持其原有的活性,绿色荧光蛋白的发光能力也不受影响。通过显微镜观察这种发光的“标签”,科学家就能做到对蛋白质的位置、运动、活性以及相互作用等一目了然。在一个活体中有数万种不同的蛋白质,这些蛋白质精细地控制着重要的化学进程。如果蛋白机制发生故障,通常就会发生疾病。绿色荧光蛋白可帮助研究这类机制,这就是为什么绿色荧光蛋白成为生物科学极其重要的工具。在它的帮助下,科学家还能对各种细胞的命运了如指掌,比如,脑神经细胞是如何发育起来的,或者癌症细胞是如何扩散的…… 徕卡双光子四维成像的斑马鱼胚胎的Expression of cytoplasmic GFP in the notochord and prechordal plate, 980nm. Nuclei stain through RNA injection H2B-mCherry @1030 nm. Courtesy of BioEmergences USR3695 (IBiSA FBI), Gif sur Yvettes, France. 连续33h的小鼠胚胎异染色质的形成需要关键的组蛋白变体H3.3,表达的EGFP。摄自Leica活细胞工作站DMi8。 通体表达GFP发出绿色荧光的小鼠,摄自Leica体视镜M205FA。 由于使用传统荧光染料有深层组织标记困难、难以用于活体标记、长时间成像易淬灭等瓶颈,所以在荧光蛋白家族出现之前,以上这些活体深层成像,长时间活细胞成像的实验效果,都是使用传统荧光染料所无法想象的。使用荧光蛋白对活体标本进行示踪,为传统生物学研究带来了崭新的实验方法,使多个生物领域一跃进入了活体动态过程的定量研究阶段。 荧光蛋白现在广泛应用于生物学研究。可以通过常规的基因操纵手段,将荧光蛋白用来标记其他目标蛋白,这样可以观察、跟踪目标蛋白的时间、空间变化。提供了以前不能达到的时间和空间分辨率,而且可以在活细胞、甚至活体动物中观察到一些分子。荧光蛋白技术也使得人们可以研究某些分子的活性,而不仅仅是其存在与否。 对于有些研究来说,荧光蛋白的作用可以形容为“起死回生”:原来有些方法,需要把生物变成死物才能研究一些现象和过程,而荧光蛋白为主要支柱之一的现代成像技术,使科学家在活的细胞中观察和研究这些过程,使一部分“死物学”变成“生物学”。 2008年的诺贝尔化学奖 正因为GFP家族如此巨大地改变了生命科学的研究进程,瑞典皇家科学院将2008年的诺贝尔化学奖授予对GFP的发现、表达和开发做出了杰出贡献的三位科学家:下村修(Osamu Shimomura,1928-)、马丁·查尔菲(Martin Chalfie,1947-)和钱永健(Roger Yonchien Tsien,1952-2016)。 上图从左至右分别为:美国科学家马丁·查尔菲(Martin Chalfie)任职于哥伦比亚大学、日本科学家下村修(Osamu Shimomura)当时任职于美国Woods Hole海洋生物学实验室(MBL)、美籍华裔科学家钱永健(Roger Y. Tsien),任职于加州大学圣迭戈分校 下村修首次从Aequorea victoria中分离出GFP。他发现该蛋白在紫外线下会发出明亮的绿光。 实际上,从绿色荧光蛋白的发现到荧光蛋白标记法的发明应用,过程相当复杂。可以说,如果没有众多科学家接力,GFP的火把就不会成功穿越间隔在发现与发明之间漫长的“黑暗”,荧光蛋白标记法就不可能获得普及。 在GFP发现和普及过程中的几个关键人物。其中下村修,查尔菲和钱永健获得2008年诺贝尔化学奖。 下村修:阿甘一样的执着和快乐 说到GFP,毫无争议的发现者是日本科学家下村修(Osamu Shimomura,下村脩)和已故美国科学家约翰森(Frank H. Johnson,1908-1990)。他们1961到1974年发现两种发光的蛋白质:水母素(aequorin)和GFP。 1962年,下村修和约翰森等在《细胞和比较生理学杂志》上报道,他们分离纯化了Aequorea victoria水母中发光蛋白水母素。据说下村修用水母提取发光蛋白时,有天下班要回家了,他把产物倒进水池里,临出门前关灯后,回头看一眼水池,结果见水池闪闪发光。因为养鱼缸的废水也流到同一水池,他怀疑是鱼缸排出的成分影响水母素,不久他就确定钙离子增强水母素发光。1963年,他们在《科学》杂志报道钙和水母素发光的关系。 1962年下村修和约翰森那篇纯化水母素的文章中,有个注脚,说还发现了另一种蛋白,它在阳光下呈绿色、钨丝灯下呈黄色、紫外光下发强烈绿色。其后他们仔细研究了其发光特性。1974年,他们得到了这个蛋白,当时称绿色蛋白、以后称绿色荧光蛋白(GFP)。Morin和Hastings提出水母素和GFP之间可以发生能量转移。水母素在钙刺激下发光,其能量可转移到GFP,刺激GFP发光。这是物理化学中已知最早的荧光共振能量转移(FRET)在生物中的发现。 下村修当时并没有料到,自己不经意间发现的GFP后来竟成了科学家们深入揭示生命活动奥秘的一个非常重要的工具。 下村修的童年少年时光都是在战乱中度过的。战后初期,他在长崎医科大学(长崎大学前身)附属药学专科部完成了三年的高等教育,(嗯,就是原子弹爆炸的那个长崎。原子弹在他16岁时爆炸,他曾数周失明。)1955年,下村被选派到名古屋大学理学院化学系天然有机化学研究室进修。在那里,他对发光海萤(Cypridina hilgendorfri)体内的荧光素提取出来并获得结晶,并为最终确定荧光素的分子结构奠定基础。由于此项工作在当时难度极大,普林斯顿大学哈维(Newton Harvey,1887-1959)教授带着学生干了好多年仍未取得成功。于是,引起了哈维的弟子——普林斯顿大学生物学系教授约翰逊(Frank Johnson,1908-1990)的注意,他盛情邀请刚被名古屋大学破格授予理学博士学位的下村于1960年9月来到普林斯顿,开始从事为期三年的关于多管水母(Aequorea victoria)的博士后研究。 下村修在演讲中展示的水母图片 其中下左图为日光状态、下右图为黑暗中状态 他们提取到了5毫克高纯度多管水母发光物质,对其进行分析后发现,该发光物质确实是一种蛋白质,加微量钙离子后会发蓝光,而且在真空状态下也能发光。下村等人将这种特殊蛋白质命名为“aequorin”,即水母素。在纯化水母素过程中,下村等人还发现了一个副产品——一种含量很低、在自然光的照射下发浅绿色荧光的新型蛋白质。于是,在该年投给《细胞和比较生理学学报》的论文脚注中,下村等人首次公开了这项发现。当时,他们将这种新型蛋白质称为“绿色蛋白质”,也就是今天的GFP。 加微量钙离子后会发蓝光的“绿色蛋白质” 来源:下村修演讲报告 1963年初,下村修和约翰逊等把水母素对钙离子敏感的相关研究整理成文,发表在美国的《科学》杂志同年6月刊上。 为获得研究所用的足量的水母素,从1960年代开始,下村修每年夏天都要带上家人开车足足七天,横跨美国到到美国西北海岸的星期五港湾(Friday Harbor)去大量捕捞多管水母。没想到,一捞就是19个夏天。过程虽然非常辛苦,但他乐此不疲。糟糕的是,期间发生了一件事,下村等人多年积攒起来的多管水母GFP被“猪队友“约翰逊带去参加学术会议时丢失了。而当时的生物技术还不甚发达,做一次GFP结构分析实验需要上百毫克的GFP。所以,此后数年下村不得不仍旧带着家人去星期五港湾大量捕捞多管水母。但他没有气馁,直到1979年,他才攒足100毫克GFP。推测出了多管水母GFP发光基团的化学结构,并在《欧洲生物化学学会联盟通讯》上公开了这一研究成果。 如果想继续进行更深入的理化性质和分子结构研究,则需要在一个夏天抓2.5 吨共50000个发光的小水母!下村修带着自己的妻子儿女和几个帮手,整个夏天的早晚都拎着小桶在水边抓水母。回到实验室,他还要忙着把水母的伞盖下缘切下来,不厌其烦地分离和分析各种成分。剪切,挤压,过滤,搅拌,沉淀……图片来源:https://www.nobelprize.org 上图:多年后,下村修、钱永健带领助手及学生到星期五港湾故地重游。下村修:三排左起第三位,钱永健:二排左起第一位。 与钱永健的天才不一样 下村是一位阿甘型的科学家 52岁的他还只是个博士后,不但没有什么地位和知名度,似乎也没有什么特别的天分更不必说多么深远的眼光。尤其不懂包装和推销自己。就是在科学界,他也不是一个什么人物。在公众的眼里,可能就显得呆傻有余灵光不足。 如果不给他这个诺贝尔化学奖,这个日裔美国老者可能很快就和曾和他一起发现GFP后默然离世的恩师约翰森一样,很快被人彻底遗忘掉。昨天,下村修在获悉自己获得诺贝尔化学奖后,在美国的家中接受日本媒体采访时坦陈:“有传言说是生理学或医学奖,我本以为得化学奖的可能性为零。昨天几位日本人获物理学奖是当之无愧,我获奖只是偶然的幸运。” 下村是绿色荧光蛋白的第一个发现者。但他谦逊地把这一成果归之于一系列“幸运”。 ““我一生一共抓了85万只水母。从大量原材料中榨取一点点物质,这可是最传统的化学研究。” MBL(Marine Biological Laboratory at Woods Hole)的新闻发布会上,他说出来的也是尽人皆知的大白话:“如果你发现一个有意思的题目,要一直做下去,直到发现一些东西。如果你碰到困难,想办法克服。不要沮丧。科学研究中总有困难。”他在获奖后举行的新闻发布会上说,经历过苦难的人,不会轻易产生畏难情绪。他寄语后进说,年轻人遇到困难时容易产生畏难情绪,但是,一旦发现自己感兴趣的课题,应该排除万难,奋力攀登。 1980年,约翰森退休不久,下村修只有离开普林斯顿,直到这个时候已经52岁的下村修其实还是一个博士后。下村修在1961年33岁时作出了重要发现(1962年发表),到1974年46岁时,全部关键实验完成。在他学术生命的黄金时间里面,他一直只是博士后。 1982年至2001年,他到麻省Woods Hole海洋生物学研究所(MBL)工作,兼波士顿大学教授。2001年MBL退休后,他在没有任何资助的情况下,继续作研究,把家里的地下室作为“光蛋白实验室”,如今已经是80多岁高龄的耄耋老者,还用家庭地址发表文章。 承前继后的马丁·沙尔菲 将GFP表达到其他生物体这项工作,1994年由两个实验室独立进行:美国哥伦比亚大学做线虫的Marty Chalfie实验室,和加州大学圣迭哥分校、Scripps海洋研究所的两位日裔科学家Inouye和Tsuji。 其中,Chalfie等于1994年在《科学》上发表的文章就被引用了3349次。 1988年,绿色荧光蛋白在一次大会上被偶然提起,在座的哥伦比亚大学教授马丁·沙尔菲突然联想:何不让它走出水母,到其它生物中去发光?一个突发奇想,因为种种原因却在4年后才在实验室付诸实施;大肠杆菌被神速地变成了“绿色荧光蛋白生产车间”,产量颇高以至于细胞在日光下就呈绿色。沙尔菲继续将目光转向他最喜欢的科研物种——线虫。这种一毫米长的低等小生物通体透明,全身的900多个细胞清晰可辨。经过沙尔菲的改造,整条虫仅有的6个触觉感受细胞开始“生产”绿色荧光蛋白,在紫外光的照耀下,这6个细胞在蠕动的小虫体内就好像用荧光笔描画出来了一样。 GFP家族“照亮了生物学研究的未来” 后来,钱永健等人拓宽了多色的荧光蛋白,先后变出了蓝色系列、青色系列、黄色系列、橙色系列的荧光蛋白。 之后的十几年中,绿色荧光蛋白又被用到了病毒、酵母、小鼠、植物甚至人类等各种生物——它们前所未有地在生命活着的状态下被涂上了颜色:癌细胞装载了绿色荧光,就与周围细胞区别开来,它们扩张领地的脚步一览无余;小得难以追踪的HIV病毒被镶了荧光,它们如何进入细胞、躲在细胞哪个角落、怎样从细胞中冒出去的种种过程就都被暴露在世人眼前…… 研究还可以进入更微观的层次。一枚细胞中的蛋白成千上万,不仅长相相似,而且都是“隐身”的,科学家将绿色荧光蛋白专门连在他们喜欢的蛋白上,就像在蛋白后边拖了一颗灯泡。小灯泡在黑暗的细胞中熠熠发光,看到它们跑来跑去,你就知道蛋白躲在哪里,大约在做什么事情。 委员会成员在评论绿色荧光蛋白的功绩时说,它“照亮了生物学研究的未来”,不仅如此,它也扩展了我们视野所及的范围。 著名生物科学家饶毅评价说“这个领域,最重要的工作显然是下村修和约翰森做的。钱永健在两个方面做出了重要的贡献,如果钱与下村修合得奖也很合理。第三重要的是普瑞舍。他承前启后,有助于推广应用下村修的发现。” 细胞里的彩虹 尽管有许多成功的例子, 但是野生绿色荧光蛋白毕竟是为水母而非实验室而设计。它有时候不够亮,有时候灭得太快,有时候在细胞里扎成一团给细胞造成麻烦,还有时甚至不听话地把科学家喜欢的蛋白拽到错误的地方;更严重的是,激发野生绿色荧光蛋白需要用高能量的紫外线,这就使得观察的过程不可避免地对细胞造成了损害。幸好第三位诺贝尔奖得主钱永健出场了,他是第一位致力于改造绿色荧光蛋白的人。今天,改造工程仍在世界上若干实验室继续,但是荧光蛋白的应用范围已经得到大大拓宽。 除了让绿色荧光蛋白变得更加完美,钱永健等人还用它做模板,先后变出了蓝色系列、青色系列、黄色系列、橙色系列的荧光蛋白。再后来,一些科学家从一种海葵中分离出了红色,人们亲切地将其衍生出的红粉系列命名为草莓、樱桃、甜瓜、香蕉、橙子、梅子和覆盆子。至此,荧光蛋白终于能在细胞中画出一道完整的彩虹。 上图:用产生不同颜色荧光蛋白的细菌创作的图画。来源wiki 一组科学家让这道彩虹华丽升空。他们用多种颜色的荧光蛋白“标记”了小鼠大脑中上百个细胞。一个个拖着长长神经纤维的神经细胞就像一个个 五颜六色的风筝,整齐排布或者彼此相交。科学家们可以看出红色细胞如何同绿色细胞并行不悖,蓝色的又如何和紫色的相互纠缠,他们调侃地将小鼠命名为脑虹——Brainbow(来自英语单词Rainbow,意为彩虹);而这只具有彩色大脑的小鼠也让实验室外的普通人一睹荧光蛋白的魅力。 绿色荧光蛋白在地球上已存在了一亿六千万年。直到公元一世纪,“发光的水母”才第一次被文字记载。又过了两千年,神秘的荧光蛋白终于爬出海洋,钻进了其它动物的细胞。 至今也没有人知道那些在那不勒斯港随波徜徉的水母究竟如何享用自然送给它们这个闪耀的礼物,然而它无疑已经深入我们所在的“异域”,并帮助人类照亮了周围那些本不可见的世界。 参考文献 1. Shimomura O, Johnson FH, Saiga Y (1962). Extraction, purification and properties of aequorin, a bioluminescent protein from the luminous hydromedusan, Aequorea. J. Cell. Comp. Physiol. 59:223-239. 2. Shimomura O, Johnson FH, Saiga Y (1963). Microdetermination of calcium by aequorin luminescence. Science 140:1339-1340. 3. Morise H, Shimomura O, Johnson FH, Winant J. (1974). Intermolecular energy transfer in the bioluminescent system of Aequorea. Biochemistry 13:2656– 62. 4. Prasher D, McCann RO, Cormier MJ (1985). Cloning and expression of the cDNA coding for aequorin, a bioluminescent calcium-activated protein. Biochem. Biophys. Res. Commun. 126:1259–1268. 5. Inouye, S., Noguchi, M., Sakaki, Y., Takagi, Y., Miyata, T., Iwanaga, S., Miyata, T. & Tsuji, F.I. (1985) Cloning and sequence analysis of cDNA for the luminescent protein aequorin. Proc. Natl Acad. Sci. U.S.A. 82, 3154–3158. 6. Prasher DC, Eckenrode VK, Ward WW, Prendergast FG, Cormier MJ. (1992). Primary structure of the Aequorea victoria green-fluorescent protein. Gene 111:229-33. 7. Chalfie M, Tu Y, Euskirchen G, Ward WW, Prasher DC (1994). Green fluorescent protein as a marker for gene expression. Science 263:802-805. 8. Inouye S, Tsuji FI. (1994). Aequorea green fluorescent protein. Expression of the gene and fluorescence characteristics of the recombinant protein FEBS Lett. 341: 277– 80. 9. Heim R, Prasher DC, Tsien RY (1994). Wavelength mutations and posttranslational autoxidation of green fluorescent protein. Proc Natl Acad Sci USA 91:12501-12504. 10. Matz, M.V., Fradkov, A.F., Labas, Y.A., Savitsky, A.P., Zaraisky, A.G., Markelov, M.L. & Lukyanov, S.A. (1999) Fluorescent proteins from nonbioluminescent anthozoa species. Nature Biotechnol. 17:969–973. 11. Tsien RY (1980). New calcium indicators and buffers with high selectivity against magnesium and protons: design, synthesis, and properties of prototype structures. Biochemistry 19:2396-2404. 12. Tsien, R.Y. (1981). A non-disruptive technique for loading calcium buffers and indicators into cells. Nature 290:527–528. 13. Brooks S (2005). The discovery of aequorin and green fluorescent protein. J. Microscopy 217:1-2. 14. Green Fluorescent Protein-GFP History -Osamu Shimomura. Science News. 15. 饶毅.美妙的生物荧光分子与好奇的生物化学家.《科学时报》10-6,2008. 16. 2008年诺贝尔化学奖. 《生命科学》. 17. 他用荧光蛋白“照亮”了细胞 科通社 18. 饶毅.下村修-只为好奇而科研. 19. 黄波,吴祺,曾成鸣. 绿色荧光蛋白——2008年诺贝尔化学奖简介 20. 《中学化学教学参考》, 2009(5):62-63 21. 今年诺贝尔奖化学奖得主下村修的水母故事.科学松鼠会. 22. 晓小.下村修与他的发光水母.《科学启蒙》 2009年Z1期 23.Kwanghun Chung, Structural andmolecular interrogation of intact biological systems. nature.1.2107(2013) 




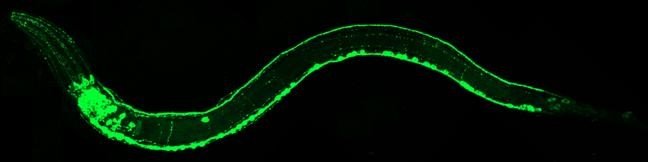
Martin Chalfie证明了GFP作为多种生物学现象的发光遗传标记的价值。在最初的一项实验中,他用GFP使秀丽隐杆线虫的6个单独细胞有了颜色。
钱永健的主要贡献在于让人们理解了GFP发出荧光的机制。同时,他拓展出绿色之外的可用于标记的其他颜色,从而使科学家能够对各种蛋白和细胞施以不同的色彩。这一切,令在同一时间跟踪多个不同的生物学过程成为现实。 






| 标签: | 钱永健 |
