
诚信认证:
工商注册信息已核实! 扫一扫即可访问手机版展台
扫一扫即可访问手机版展台
项目文章Cancer Res. | 四川大学华西医院运用多层组学研究非编码RNA在肝癌的发生和转移
前言
鹿明生物合作客户四川大学华西医院在医学一区期刊《Cancer Research》(IF:8.378)发表题为“LncRNA SNHG10 Facilitates Hepatocarcinogenesis and Metastasis by Modulating Its Homolog SCARNA13 via a Positive Feedback Loop”的研究论文。该研究运用RNA-seq测序分析、TMT定量蛋白质组学的多层组学方法报道了SNHG10通过miR-150-5p / RPL4-c-Myb阳性反馈环调节SCARNA13的表达,而SCARNA13通过调节HCC中的SOX9促进肝癌细胞的增殖、侵袭和迁移。揭示了非编码RNA在肝癌发生和转移中的作用,为肝癌确定诊断和治疗靶点提供新的途径。

|
标题:LncRNA SNHG10通过正反馈环调节其同源基因SCARNA13促进肝癌的发生和转移
研究对象: 肝癌肿瘤及配对癌旁组织、细胞系、BALB/c裸鼠
期刊:CANCER RESEARCH
影响因子:8.378
发表时间:2019年7月
合作单位:四川大学华西医院
运用生物技术:RNA-seq测序分析、TMT定量蛋白质组学(由上海鹿明生物科技有限公司提供技术支持)
研究背景
肝细胞癌(HCC)是常见的恶性肿瘤之一,也是癌症相关死亡的第三大主要原因。尽管临床检测和治疗策略不断进步,但由于早期诊断,术后高复发率和转移,HCC患者的预后仍然很差。由于尚未完全阐明HCC的肿瘤发生和转移的分子机制,因此鉴定关键的促癌分子将有助于了解HCC的发病机理并确定潜在的治疗靶标。近期研究发现lncRNA和小RNA之间存在复杂的相互作用,其中一些lncRNA可以产生或调节小RNA。作为小RNA的亚类,大多数snoRNA编码在SNHG (small nucleolar RNA host genes)的内含子中,而来自SNHG的初级RNA转录本外显子被剪接成lncRNA并转运到细胞质中,表明snoRNA与从SNHG转录的同源lncRNA之间可能存在潜在的相关性。本文作者对lncRNA和同源snoRNA之间的特定关系以及它们在HCC发生中的特定作用加以研究。
研究思路
|
实验结果
1.SNHG10和SCARNA13在肺转移灶以及HCC组织中升高,并且与HCC患者的预后不良有关
在利用RNA-seq比较异种移植HCC细胞和亲代HCC细胞之间的表达。有101种lncRNA发生了至少2倍变化的差异表达(图1aB)。此外,作者发现与亲代HCC细胞相比,异种移植HCC细胞中有6种snoRNA上调,而2种snoRNA下调。
此外,分析了癌症基因组图谱(TCGA)肝细胞癌(LIHC)数据存储库,以进一步研究这些候选lncRNA和snoRNA在肝癌发生中的作用。与相邻非肿瘤组织相比,在HCC组织中总共有3,592个lncRNA和113个snoRNA失调(图1aB和C)。在交集部分,发现了24个lncRNA(包括SNHG10,DLGAP1-AS2,TMEM161B-AS1,LINC01004和NNT-AS1)和6个snoRNA(SCARNA13,SNORD6,SNORD100,SNORD3A,SNORD94和SNORA71C)可能起关键作用,这其中包含了SNHG10和SCARNA13基因。而SNHG10和SCARNA13基因是来自同一初级RNA转录本的不同产物,这表明SNHG10和SCARNA13可能协同促进HCC的发生和发展。因此,作者将重点放在对lncRNA SNHG10及其同源SCARNA13的研究上。

|
图1a | SNHG10和SCARNA13的鉴定及其与HCC患者预后不良的关系模型、结构、流程图
(A)建立肺转移筛查小鼠模型的图解模型。
(B)和(C)通过RNA序列结果与TCGA-LIHC数据存储库的交叉选择候选lncRNA和snoRNA的流程图。
(D)人类14号染色体(hsa-chr14)上SNHG10和SCARNA13的基因组结构。
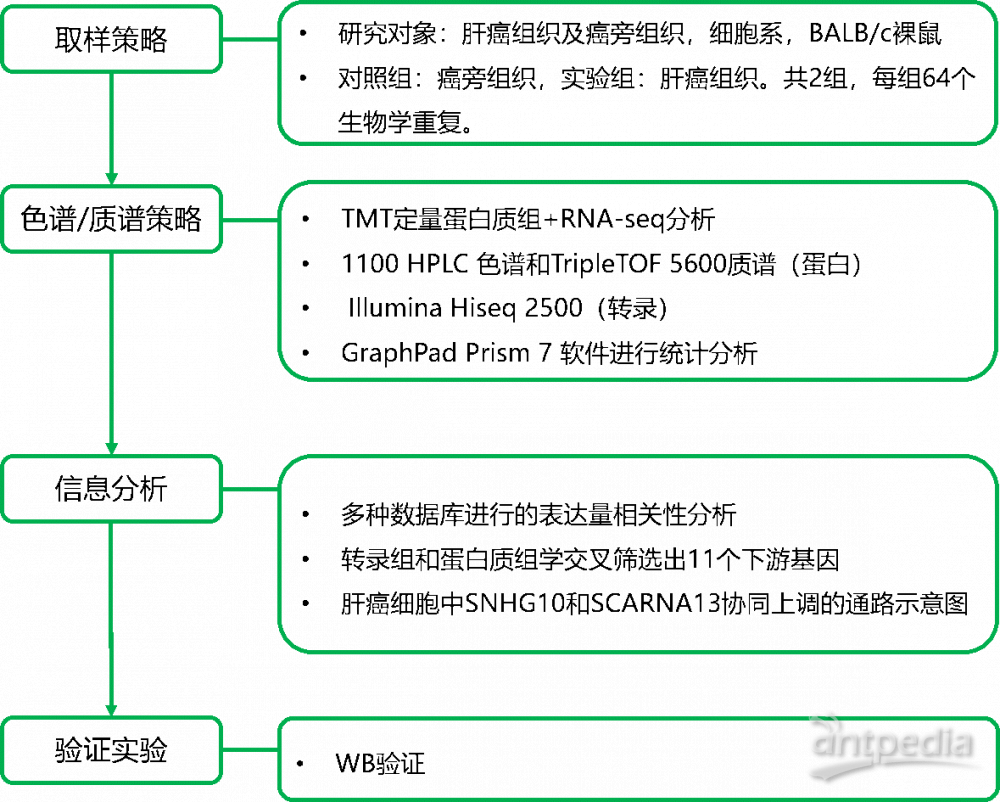
一方面,分析确认SNHG10和SCARNA13属于LncRNA,没有蛋白质编码潜力。另一方面,通过对64对HCC组织及其邻近正常组织中SNHG10和SCARNA13的表达水平分析发现:与邻近的正常组织相比,HCC组织中SNHG10和SCARNA13的水平均升高,并且它们之间在统计上呈正相关关系。通过基因敲除实验证明SNHG10和SCARNA13两者之间存在调控关系,SNHG10可能是SCARNA13的上游调节因子。
|
图1b | SNHG10和SCARNA13的鉴定及其与HCC患者预后不良的关系
(E)TCGA-LIHC数据仓库中SNHG10与SCARNA13表达的散点图。
(F)和(G)应用qPCR检测64对肝癌组织及癌旁正常组织中SNHG10和SCARNA13的表达。
(H)WCH数据库中SNHG10与SCARNA13表达的散点图。
(I)和(J)64例肝癌患者SNHG10或SCARNA13表达水平与总生存率的相关性。
(K)qPCR法检测SNHG10在不同肝癌细胞系中的表达。
2.SNHG10促进肝癌细胞的发生和转移
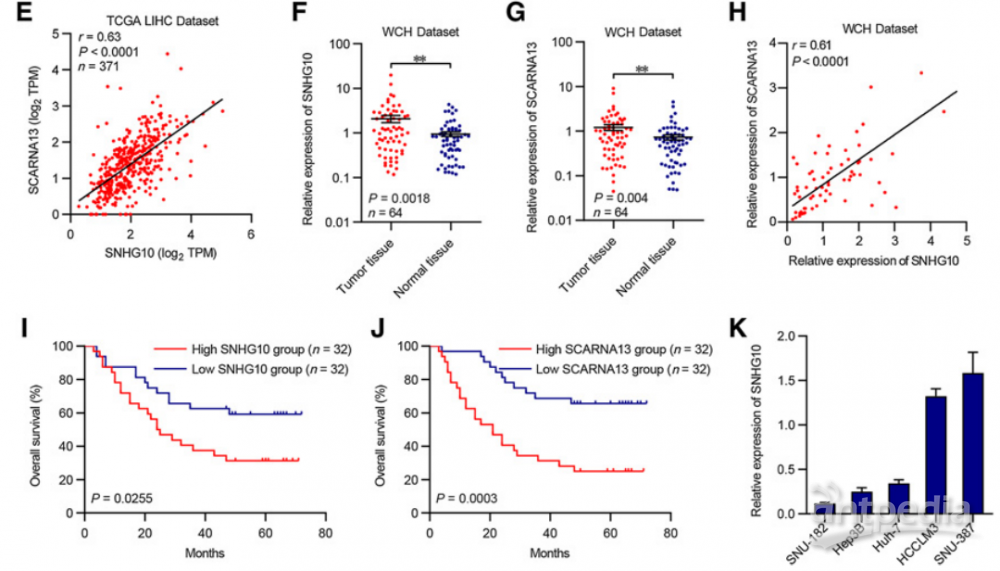
为了阐明SNHG10在肝癌发生和转移中的致癌作用,作者研究了SNHG10对细胞表型的影响。SNHG10的减少会显著抑制SNU-387和HCCLM3细胞的周期和增殖,并诱导凋亡(图2A和B)。此外,SNHG10的沉默极大地削弱了SNU-387和HCCLM3细胞的侵袭和迁移能力(图2C和D)。
将SNU-387和HCCLM3细胞皮下注射到裸鼠中。LV-shSNHG10组的肿瘤体积和重量均显著低于LV-shCtrl组(图2E–G),表明SNHG10增强了体内HCC细胞的致瘤性;将指定的SNU-387和HCCLM3细胞移植到裸鼠的肝脏中,以构建原位植入模型进行肝转移测定。与LV-shCtrl组相比,LV-shSNHG10组的肝转移结节的荧光素酶信号强度显著下降(图2H),表明SNHG10增强了HCC细胞的肝内转移能力;
荧光素酶标记SNU-387和HCCLM3细胞,并直接接种到裸鼠的尾静脉中进行肺转移测定。LV-shSNHG10组小鼠的萤光素酶信号强度明显低于LV-shCtrl组(图2I),表明SNHG10可以促进HCC细胞的肺转移潜能;H&E染色显示,LV-shSNHG10组的转移灶在肺和肝的组织切片中显著降低(图2J和K);
综上所述,这些观察结果表明,SNHG10在肝癌的发生和转移中起着致癌作用。
|
图2 | 抑制SNHG10对肝癌细胞在体内外的增殖和转移
(A)和(B)转染了SNHG10-siRNAs和对照处理的SNU-387细胞和HCCLM3细胞的EdU免疫荧光染色分析。
(C)和(D)SNHG10-siRNAs转染和对照处理的SNU-387和HCCLM3细胞的跨孔侵袭试验。
(E-G)SNHG10基因敲除对小鼠皮下移植瘤体积和肿瘤重量的影响。
(H)原位肝移植术后6周各组肝脏荧光素酶信号强度的变化。
(I)各组小鼠尾静脉注射6周后荧光素酶信号强度。
(J)和(K)H&E染色显示肺和肝组织切片中SNU-387细胞的转移灶。
3.SCARNA13可促进肝癌细胞的发生和转移
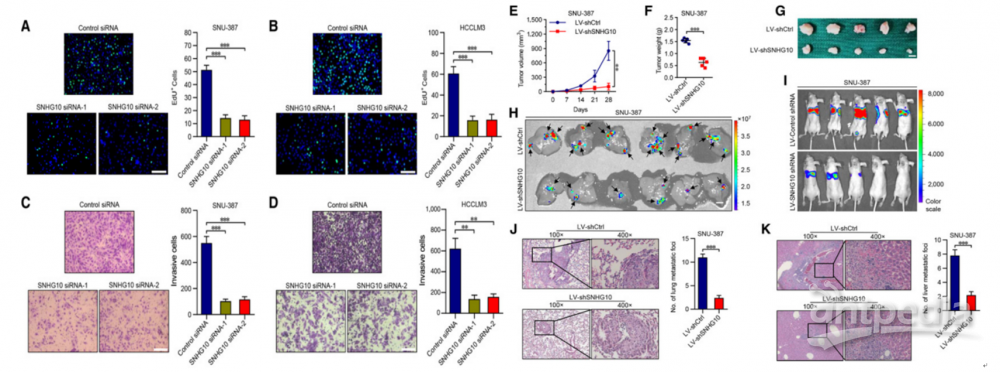
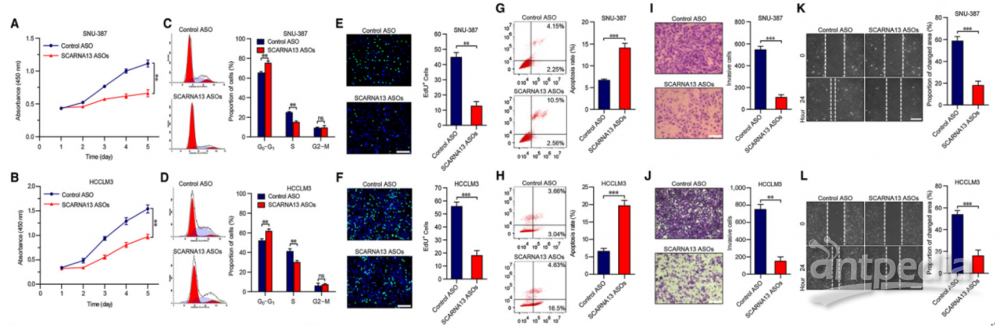
由于SCARNA13和SNHG10在HCC组织中同时上调,因此作者评估了SCARNA13对HCC细胞恶性表型的影响。与SNHG10相似,敲除SCARNA13可以极大地抑制细胞周期和增殖,并诱导SNU-387和HCCLM3凋亡(图4A–H)。此外,SCARNA13的下调实质上损害了SNU-387和HCCLM3细胞的侵袭和迁移能力(图4I–L)。这些结果确定了SCARNA13是肝癌中的致癌启动子。
|
图4 |抑制SCARNA13对肝癌细胞的增殖和转移有抑制作用
(A)和(B)CCK-8检测转染SCARNA13-ASOs的SNU-387和HCCLM3细胞及对照组。
(C)和(D)用碘化丙啶染色法测定转染SCARNA13-ASOs的SNU-387和HCCLM3细胞的细胞周期分布,并与对照组比较。
(E)和(F)转染SCARNA13-ASOs的SNU-387和HCCLM3细胞及对照组的EdU免疫荧光染色分析。
(G)和(H)用FITC Annexin V和碘化丙啶染色在SnAU-137和HCCML 3细胞中用SCARN13 ASOS或对照转染细胞,然后用流式细胞仪分析细胞凋亡。
(I)和(J)SCARNA13-ASOs及对照转染SNU-387和HCCLM3细胞的跨孔侵袭实验。
(K)和(L)SCARNA13-ASOs及对照转染SNU-387和HCCLM3细胞的伤口愈合迁移实验。
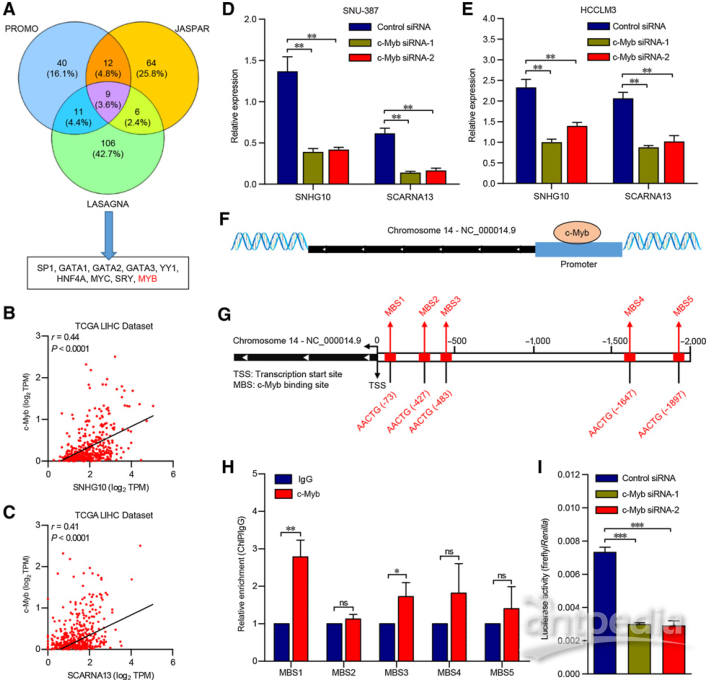
4.转录因子c-Myb上调SNHG10和SCARNA13水平
转录因子(TF)在识别并动态结合位于启动子上的简并序列基序中的作用在转录中起关键作用。因此,作者推测某些TF可能负责SNHG10和SCARNA13的异常表达。不同数据库的交集确定了9个TF,它们可能与SNHG10基因的启动子区域结合(图4A),而在9个TF中,c-Myb表达与SNHG10和SCARNA13表达相关性最高(图4B和C)。c-Myb的敲除显著降低了SNU-387和HCCLM3细胞中SNHG10和SCARNA13的表达(图4D和E),确定c-Myb是SNHG10和SCARNA13的上游调节子。
随后的生物信息学分析预测了SNHG10启动子区域中的五个c-Myb结合位点(MBS)(图4F和G)。ChIP分析证实了S-NHB10启动子区域中c-Myb在MBS1和MBS3上的高度富集(图4H)。总之,c-Myb可以直接结合于SNHG10的启动子区域,从而导致HCC细胞中SNHG10和SCARNA13的上调。
|
图4 | C-Myb调节SNHG10和SCARNA13的表达
(A)通过SJPAR、PROMO和LASGANA数据库交叉得到的9个TFs可能与SNHG10基因启动子结合。
(B)和(C)TCGA-LIHC数据库中SNHG10或SCARNA13和C-Myb表达的散点图。
(D)和(E)SNHG10和SCARNA13在c-Myb-siRNAs转染的SNU-387和HCCLM3细胞中的表达。
(F)和(G)预测c-Myb与SNHG10基因启动子结合的示意图及启动子区的假定结合位点。
(H)芯片法检测c-Myb在SNHG10启动子区MBSs上相对于IgG的富集。
(I)c-Myb-siRNAs和荧光素酶报告子pEZX-PL01-SNHG10共转染HEK293T细胞的荧光素酶活性。
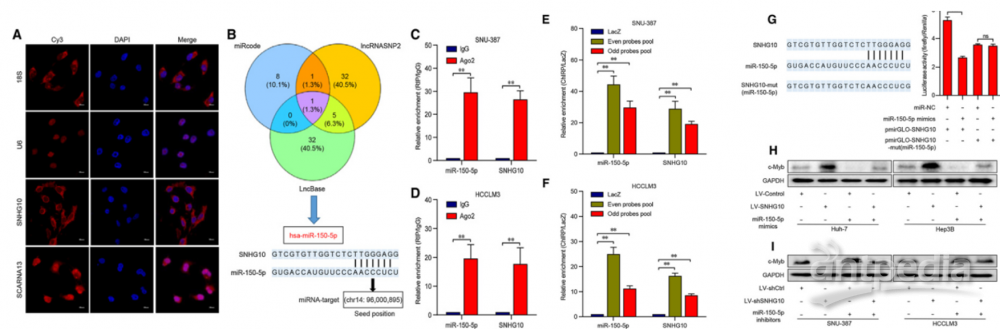
4.SNHG10充当miR-150-5p的海绵以增加c-Myb表达
生物信息学分析表明,miR-150-5p可以结合SNHG10的309-315 nt位点(图5B),分析证实SNHG10对miR-150-5p有充当海绵的作用。而前期大量文献研究表明,miR-150-5p的过表达下调c-Myb mRNA和蛋白水平,因此可以确定c-Myb为miR-150-5p的直接靶标。作者推断:SNHG10介导的miR-150-5p的螯合可能是c-Myb上调的关键。最后通过实验该推断得以证实。简而言之,SNHG10充当miR-150-5p的海绵,以降低其对c-Myb的抑制作用,从而增强c-Myb的表达。同时c-Myb又可以直接上调SNHG10的表达,所以SNHG10,miR-150-5p和c-Myb可能形成一个正反馈回路来维持SNHG10在肝癌中的高表达。
|
图5 | SNHG10作为miR-150-5p的海绵
(A)SNHG10和SCARNA13的RNA-FISH分析。细胞核用DAPI染色。
(B)应用生物信息学分析预测SNHG10与miR-150-5p的结合位点。
(C)和(D)RIP法检测SNHG10和miR-150-5p对SNU-387和HCCLM3细胞IgG的富集作用。
(E)和(F)ChIRP法测定SNHG10和miR-150-5p在偶数和奇数探针池中的富集程度,并与SNU-387和HCCLM3细胞中设置的对照LacZ探针进行比较。
(G)miR-150-5p-mimics和荧光素酶报告子pmirGLO-SNHG10或pmirGLO-SNHG10-mut(miR-150-5p)共转染HEK293T细胞的荧光素酶活性。
(H)和(I)miR-150-5p模拟物或抑制剂对肝癌细胞c-Myb的Western blot分析。
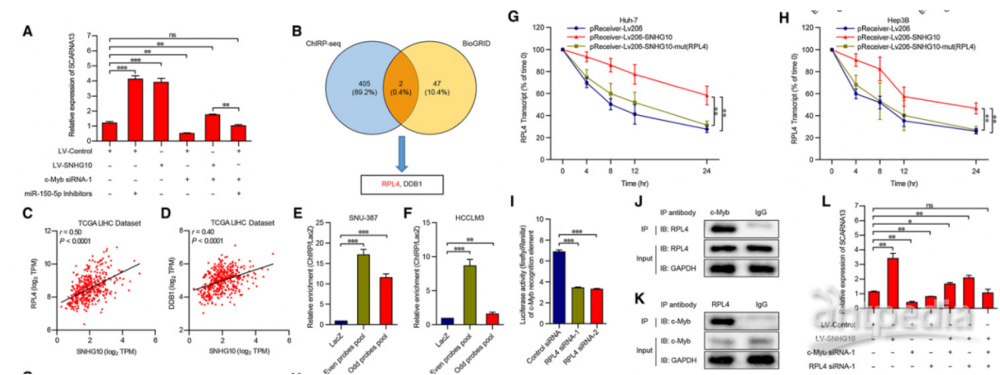
5.SNHG10通过miR-150-5p / RPL4-c-Myb正反馈环调节SCARNA13的表达
SCARNA13是由SNHG10,miR-150-5p和c-Myb组成的正反馈环的下游效应子。作者通过一系列的实验数据分析表明SNHG10一方面通过吸收miR-150-5p来促进c-Myb的表达,另一方面通过RPL4与c-Myb相互作用并正向调节c-Myb的转录活性,从而最终形成一个正反馈环路,不断刺激SCARNA13的表达。
|
图6 | SNHG10通过miR-1505p/RPL4-c-Myb-正反馈环调节SCARNA13的表达
(A)SCARNA13在有或无c-Myb siRNA和/或miR-150-5p抑制剂的肝癌细胞中的表达。
(B)从ChIRP-seq结果和BioGRID相互作用数据库的交叉点中筛选出RPL4和DDB1。
(C)和(D)TCGA LIHC数据库中SNHG10与RPL4或DDB1表达的散点图。
(E)和(F)ChIRP法检测SNU387和HCCLM3细胞中与对照LacZ探针相对的偶数和奇数探针池中RPL4 mRNA的富集。
(G)和(H)用2mg/mL)阻断SNU-387和HCCLM3细胞的新RNA合成后,用qPCR分析所示时间点RPL4 mRNA的RNA水平。
(I)RPL4-siRNAs和含12个MRE的荧光素酶报告子共转染HEK293T细胞的荧光素酶活性。
(J)和(K)RPL4在c-Myb上的富集和c-Myb在RPL4上相对于IgG的富集。
(L)SCARNA13在有或无c-Myb-siRNA和/或RPL4-siRNA的肝癌细胞中的表达。
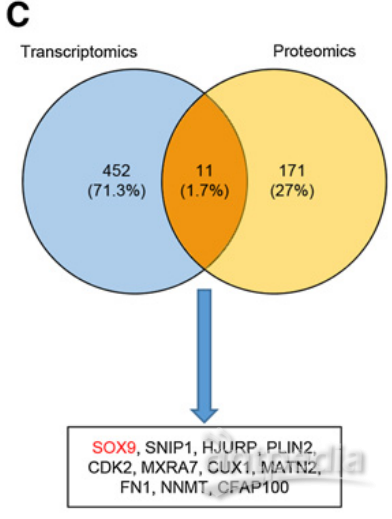
6.SCARNA13通过调节SOX9介导SNHG10驱动的HCC细胞增殖,侵袭和迁移
为了进一步鉴定SCARNA13的候选下游因子,作者使用TMT蛋白质组技术敲除SCARNA13后HCC细胞的蛋白水平变化,发现了182种差异表达蛋白,其中11种基因同时被转录组学和蛋白质组学检测出差异。
|
图7 | 转录组学和蛋白质组学交叉鉴定了11个下游基因
SOX9的蛋白质表达水平在SCARNA13敲除后下调最显著。因此,作者选择SOX9作为SCARNA13的候选下游蛋白并加以验证。
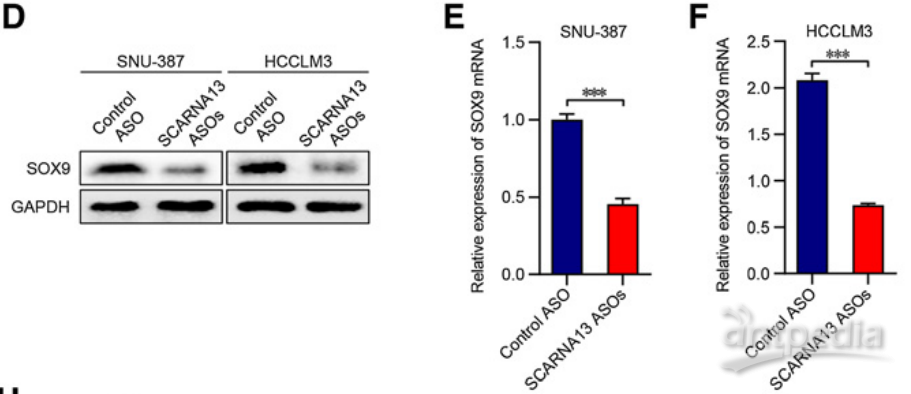
|
图8 | 转染SCARNA13-ASOs的SNU-387和HCCLM3细胞在RNA和蛋白水平上SOX9的表达
大量研究表明,SOX9对癌细胞的细胞周期和EMT产生巨大影响。因此,作者检测了SCARNA13敲低对细胞周期和EMT的分子标记物表达的影响。结果发现,在抑制SNU-387和HCCLM3细胞中SCARNA13后,CDK2,CDK3,细胞周期蛋白D1,细胞周期蛋白D3,ZEB1,波形蛋白,N-钙黏着蛋白和纤连蛋白的表达水平显著下降。相反,用SCARNA13 ASOs转染导致HCC细胞中p21,p27和E-钙黏蛋白的表达显著增加。
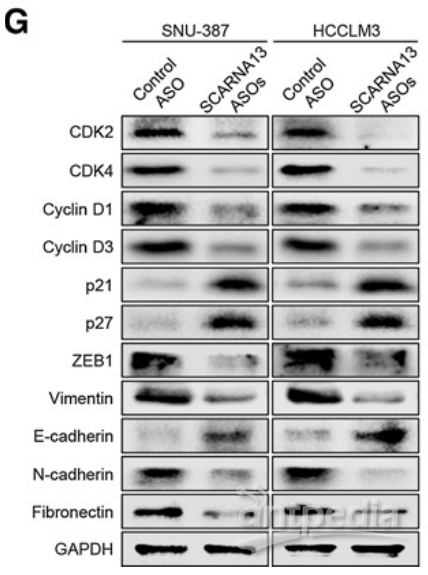
|
图9 | SCARNA13-ASOs及对照转染SNU-387和HCCLM3细胞周期和EMT分子标记的Western blot分析
实验结论
在本篇文章中,通过高通量RNA测序(RNA-seq),作者确定了ncRNA小核仁RNA宿主基因10(SNHG10)及其同源snoRNA SCARNA13在HCC发生和发展中的作用。SNHG10和SCARNA13均与HCC细胞的恶性生物学行为和HCC患者的不良预后密切相关。
这些研究发现表明SNHG10对肿瘤发生和转移的促进作用是由SCARNA13介导的,其通过在HCC细胞中上调SOX9来促进细胞周期和EMT。
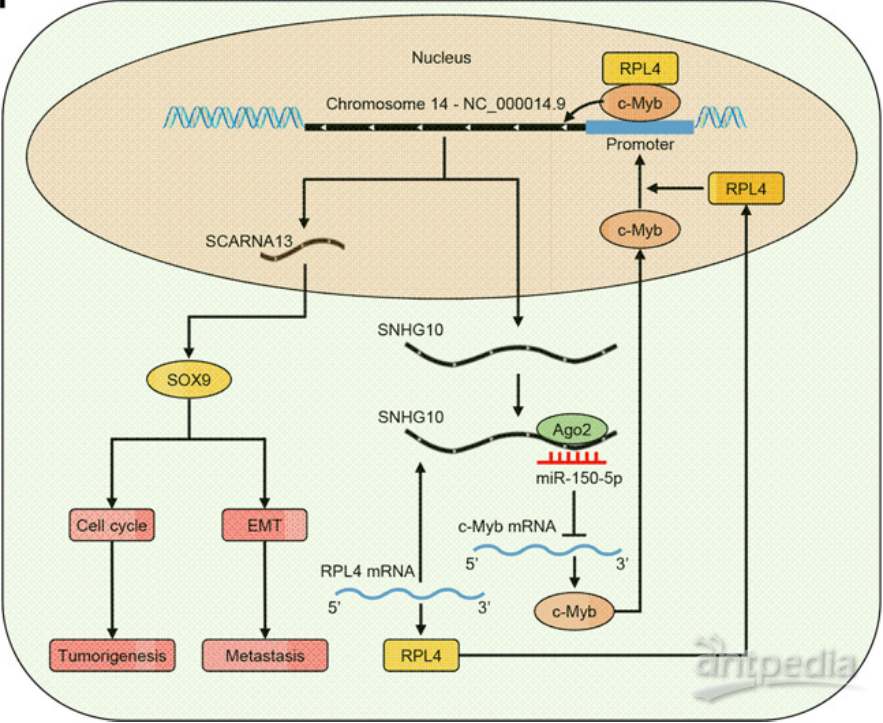
|
图10 | 肝癌细胞中SNHG10和SCARNA13协同上调的复杂电路的示意模型
小鹿推荐
了解非编码RNA在肿瘤发生和转移中的作用将为鉴定诊断分子和治疗靶点建立新的途径。本文目的为确定肝细胞癌(HCC)特异性ncRNA,并研究它们在HCC发生和转移中的作用。作者通过RNA-seq鉴定肺转移产生的异种移植HCC细胞,发现lncRNA SNHG10及其同源物SCARNA13可作为HCC发展和转移的新驱动因子。在64例HCC病例中,SNHG10表达与SCARNA13表达呈正相关,而SNHG10或SCARNA13的高表达预示着患者不良预后。由于SCARNA13在SNHG10过表达和敲低后显示出显著的上升和下降,作者假设SNHG10可能是SCARNA13的上游调节因子。功能实验发现SNHG10和SCARNA13协同促成HCC细胞的恶性表型,其中SNHG10充当miR-150-5p的海绵并与RPL4 mRNA相互作用以增加c-Myb的表达和活性。而上调和过度活化的c-Myb会调节SNHG10启动子活性从而增强SNHG10和SCARNA13的表达,形成正反馈循环并持续刺激SCARNA13表达。SCARNA13通过调节SOX9促进HCC细胞的细胞周期和上皮间质转化(EMT)。作者通过多层组学技术手段,发现了在HCC发生和转移过程中起重要作用的复杂调节网络。
部分文献参考
Lan T , Yuan K , Yan X , et al. LncRNA SNHG10 Facilitates Hepatocarcinogenesis and Metastasis by Modulating Its Homolog SCARNA13 via a Positive Feedback Loop[J]. Cancer research, 2019, 79(13):3220.
猜你还想看
◆技术小科普 | 3分钟读懂LM精准靶向代谢组学、非靶向、广靶/拟靶的区别特点及研究策略
◆重磅发布|基于AB SCIEX 6500+的130种黄酮酚类物质的精准靶向代谢组学
END
