
诚信认证:
工商注册信息已核实! 扫一扫即可访问手机版展台
扫一扫即可访问手机版展台
客户文章 | 甘肃农业大学王延秀教授课题组运用多层组学联合分析探究垂丝海棠应对盐碱胁迫适应性机理
编者按:
由于土壤盐碱化逐年增加造成可耕作面积逐年减少,使盐碱等非生物胁迫已成为严重影响我国粮食生产的重要因素。同时针对抗盐碱功能机理的研究也是选育耐盐碱新品种的关键。
因此,本篇通过蛋白质组学、代谢组学联合分析的方法,研究垂丝海棠叶中发生的代谢变化和可能的防御机制,并构建了网络图。并且本篇也是第一个使用多层组学联合方法进行垂丝海棠适应盐碱环境的分子机制研究。
前言
2019年,欧易/鹿明生物合作客户甘肃农业大学王延秀课题组在Horticulture Research杂志发表题为“垂丝海棠应对盐碱胁迫适应性的生理、蛋白质组学和代谢组学的整合分析”的文章。该文章作者通过蛋白质组学、代谢组学以及生理学数据,对可耐受盐碱的垂丝海棠中参与植物胁迫反应的植物途径及其调控机制进行深入研究,为使用基因工程提高该植物的耐盐碱性提供了重要依据。
基本信息
英文标题:Integrated physiologic, proteomic, and metabolomic analyses of Malus halliana adaptation to saline–alkali stress
中文标题:垂丝海棠应对盐碱胁迫适应性的生理、蛋白质组学和代谢组学的整合分析
材料:垂丝海棠叶片
发表期刊:Horticulture Research
主要运用欧易/ 鹿明生物技术:蛋白质组学、代谢组学

|
研究背景
土壤盐碱化是影响植物生长的主要非生物胁迫因素。在中国西北地区,盐碱胁迫已成为限制苹果产量的主要因素。选择耐盐碱的苹果砧木是减少土壤盐碱化问题的有效策略,垂丝海棠是一种中国西北本地苹果,已发现比其他品种更加耐盐碱,因此迫切需要探索垂丝海棠如何应对盐碱胁迫的可能分子机制。以前研究多集中于植物对盐胁迫或碱胁迫的耐受性的潜在机制,但是很少进行关于盐碱协同胁迫的研究。在这篇文章中,作者整合了代谢组学和蛋白质组学分析,通过鉴定植物对盐碱胁迫应答相关的不同蛋白质和代谢物,获得对垂丝海棠调节和响应分子机制,以提供有效的基因工程策略来提高植物对盐碱的耐受性。
研究思路

|
实验方法
1. 实验分组及采样
培养垂丝海棠健康幼苗对其进行盐碱胁迫,使用添加100mM NaCl + NaHCO3(1:1,pH = 8.2)的Hoagland溶液处理幼苗,为了避免盐冲击反应,在压力开始时浓度从0 mM开始每天增加25mM直到100mM浓度,随后测量所有生理参数。
根据盐碱胁迫下垂丝海棠的表型变化,确定了蛋白质组和代谢组的取样时间。在盐碱胁迫下,植物叶片在0-2天内不会明显改变;在第4天时观察到已长出的叶子有黄化和脱水迹象,但是新叶子仍可正常生长;胁迫6天后,新叶子发生了黄化,老叶变得干枯且产生褶皱,反映了胁迫诱导产生了严重损害,甚至导致植株死亡(图1)。因此在表型变化最明显的时期采集样品。

|
图1 |盐碱胁迫下垂丝海棠的表型变化
2.检测方法
(1) 光合作用参数测定
(2) 蛋白质组iTRAQ分析
(3) LC / MS非靶向代谢组学分析
(4) 定量qRT-PCR分析
(5) 统计分析:方差分析进行检验和比较平均差比较Duncan检验(P <0.05)、主成分分析(PCA)和(正交)偏最小二乘判别式分析OPLS-DA。
实验结果
1.盐碱胁迫下垂丝海棠叶片的蛋白质组学分析结果
用iTRAQ定量蛋白质组学技术分析垂丝海棠叶片。定量分析结果显示,鉴定出与2454种蛋白质相对应的19,092个特有肽段。作者以倍数变化(大于2或小于0.5)和p值<0.05为阈值,共筛选出179种丰度有显著变化的表达差异蛋白(DEP);在这些DEP中74个含量下调,105个含量上调。经过GO富集分析,这些差异蛋白被分为三类,包括生物过程(BP)、细胞成分(CC)和分子功能(MF)(图2a)。通过映射到KEGG发现,这些差异蛋白主要参与以下代谢途径:氨基糖和核苷酸糖代谢、和二羧酸酯代谢、抗坏血酸和藻酸盐代谢、生物合成、碳代谢、光合生物中碳固定、色氨酸\丙氨酸、天冬氨酸和谷氨酸代谢(图2b)。这些结果表明,参与代谢产物合成的蛋白质还可以调节各种代谢途径,以应对盐碱胁迫。

|
图2 |(a) 盐碱胁迫下已鉴定蛋白质的GO分类,三个主要GO类别的结果:BP、CC和MF;(b)参与垂丝海棠叶片对盐碱胁迫响应的差异表达蛋白KEGG途径
2.盐碱胁迫下垂丝海棠叶片的代谢组学分析结果
作者通过非靶标LC-MS代谢组技术鉴定出11,135种代谢物,通过OPLS-DA模型VIP> 2.5的且p值<0.05的标准,筛选出140种差异表达代谢物(DEM),主要包括糖、葡糖苷、氨基酸、有机酸和次生代谢物。通过层次聚类发现共有59种DEM被上调、81种被下调,在上调和下调植物叶样本之间,代谢物有明显的区分(图3a)。将这些代谢物映射到KEGG途径,发现主要集中在吲哚生物碱的生物合成、苯丙氨酸的生物合成、托烷-哌啶和吡啶生物碱的生物合成、苯丙氨酸代谢、ABC转运系统、 莽草酸途径衍生的生物碱生物合成、碳水化合物的消化吸收、生物素代谢矿物质吸收、苯丙氨酸、酪氨酸和色氨酸的生物合成(图3b)。这些代谢物和代谢途径的变化提供了关于垂丝海棠如何响应盐碱胁迫的重要信息。
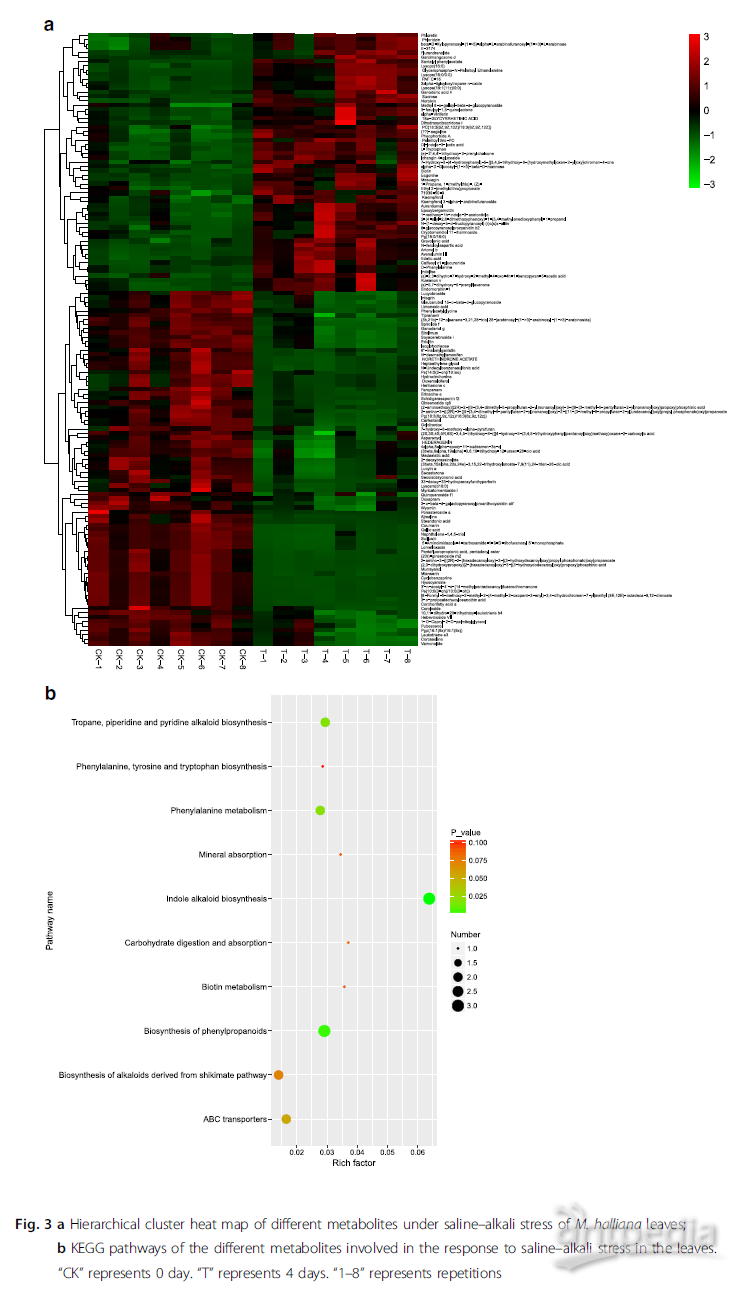
|
图3 |(a)盐碱盐胁迫下垂丝海棠叶不同代谢物的层次聚类分析热图;
(b)参与了应对盐碱胁迫响应物的不同代谢物的KEGG途径,“CK”代表0天,“T”代表4天,“1–8”表示重复
3.盐碱胁迫下垂丝海棠叶片的蛋白质组学和代谢组学整合分析
通过差异蛋白质和代谢物的KEGG途径分析,我们发现盐碱胁迫诱导与11种代谢途径相关,这些途径为:2-氧代羧酸代谢、氨基酸生物合成、α-亚麻酸代谢、甘氨酸,丝氨酸和苏氨酸代谢、苯丙氨酸-酪氨酸和色氨酸生物合成、苯丙氨酸代谢、次生代谢产物的生物合成、莨菪烷-哌啶和吡啶生物碱的生物合成、色氨酸代谢、生物合成和综合代谢途径(表1)。作者还根据代谢物相关酶和DEP进行了KEGG定位分析,这些蛋白质和酶主要参与能量代谢以及二羧酸酯代谢、次生代谢产物的生物合成、丙氨酸-天冬氨酸和谷氨酸代谢、生物合成和硫胺素代谢(图4a)。
表1 盐碱胁迫下参与常见途径的差异蛋白质和代谢物

|
通过对DEP、DEM和酶的综合分析,作者构建了垂丝海棠对盐碱胁迫响应的互作图(图4b)。在互作网络中BGLU13蛋白不仅表达变化最大而且还与XYL2、CWINV6和At1g73050直接作用,并且它还参与淀粉和蔗糖代谢以及类生物合成途径。另外综合代谢途径、二羧酸酯代谢以及氨基糖和核苷酸糖代谢具有最大的-log(p值)。PSBP1可以直接与PSBQ、PSBO2、PSAH2和PSAK相互作用,它们各自调节垂丝海棠的光合作用。与XYL2、RFSA和AGAL3相互作用的只有一种代谢产物——蔗糖,并形成集成网络。

|
图4 |(a)参与了叶片盐碱胁迫应答的代谢产物相关酶和表达差异蛋白的KEGG通路;
(b)使用IPA软件进行的差异蛋白\代谢物和酶的网络分析。
实线:表示直接相互作用或调控;虚线:表示由其他分子介导
4.整合代谢途径分析
为了进一步探索垂丝海棠调节和适应盐碱胁迫分子机制,作者结合表1和图5a的KEGG途径构建了一个全面的系统性代谢途径图。如图5所示,31种蛋白质和13种代谢物映射到该图中,图中显示了如下几条途径相关的蛋白质与代谢物:

|
图5 | 垂丝海棠叶盐碱胁迫应答的主要生物途径
通过结合差异代谢物、酶和蛋白质的KEGG途径,将蛋白质(↑)和代谢物(□)映射到整个代谢系统的途径图。DEP和代谢物以粗体标记;红色表示上调;绿色表示下调。
①糖代谢途径:与淀粉和蔗糖代谢有关的UGE3、XYL2、At2g31390、AMY1、BGLU13、BGLU44和蔗糖的表达上调。UGE3上调催化了UDP-葡萄糖和UDP-半乳糖的相互转化,这是蔗糖转化的第一步。BGLU13的表达增加13.965倍,蔗糖增加了7.105倍。相反在盐碱胁迫下,参与甘露糖和半乳糖代谢的PMM、At5g28840和VTC4的表达下调(表2)。作者还发现和磷酸戊糖途径(PPP)相关的PDH2、ALDH2B4和EMB2024表达上调。EMB2024参与图5的步骤2,并从PPP中的6-磷酸葡萄糖合成6-磷酸-D-葡萄糖酸酯,后者的前者是的前体,可进入TCA循环。此外ALDH2B4和PDH2催化EMP中转化为乙酰CoA和CO2的总体转化。
表2 糖代谢相关蛋白质和代谢物

|
②氨基酸和代谢途径:作者发现与苯丙氨酸代谢有关的D-苯丙氨酸显着上调(5.873倍)以及ASP3、苯乙酰基甘氨酸和L丝氨酸的下调(表3)。参与生物合成的BGLU13和BGLU44的表达上调,而香豆素和过氧化物酶超家族蛋白(PER)12、PER53、PER52、PER17和PER3的表达下调。BGLU13和BGLU44催化将β-D-葡萄糖基-2-香豆素转化为香豆素,然后转化为香豆素。PER是木质素合成中涉及的关键蛋白之一,可以催化木质素单体前体用于生产愈创木脂基(G),丁香基(S)和对羟基苯基(H)木质素(图5,表4)。作者进一步观察到,在盐碱条件下与黄酮类生物合成有关的和CYP75B1的表达上调(表4)。
表3 氨基酸代谢相关蛋白质和代谢物

|
表4 代谢相关的蛋白质和代谢物

|
③吲哚和莨菪烷、哌啶和吡啶生物碱代谢途径:参与吲哚生物碱生物合成的色氨酸(7.364倍)和长春花碱(6.220倍)明显积累,但TAR1、CAT2和阿玛琳水平降低。作者发现T31B5_170参与植物激素信号转导,并且表达提高至5.822倍(表5)。光合作用方面,PSBO2、PSBP1、PSBQ2、PSAH2和PSAK的表达显著上调,但PSBR表达下调。此外相对于卟啉和叶绿素代谢,PPD、PAO和脱镁叶绿酸a的表达上调(表6)。
表5 吲哚和莨菪烷、哌啶和吡啶生物碱代谢相关的蛋白质和代谢物

|
表6 光合作用和叶绿素代谢相关的蛋白质和代谢物

|
5.通过qRT-PCR验证DEG分析结果
为了进一步评估结果的有效性,作者选择了糖代谢、氨基酸代谢、代谢吲哚和托烷,哌啶和吡啶生物碱代谢以及光合作用和叶绿素代谢中涉及的16种蛋白质进行实时定量PCR分析(qRT- PCR)。结果表明,有15个基因(93.75%)在qRT-PCR结果和iTRAQ分析之间显示出相似的趋势,但qRT-PCR分析的ASP3与iTRAQ数据不一致(图6)。有趣的是,我们发现在盐碱胁迫下,ASP3在苯丙氨酸代谢中被下调,在天冬氨酸和谷氨酸合成中被上调(图5)。这些结果表明,iTRAQ分析是高度可靠的。

|
图6 | 使用qRT-PCR技术对两个时间点(0天和4天)对16种蛋白质进行确认
结果讨论
1. 生理指标,光合作用相关蛋白和叶绿素代谢的关系
盐碱胁迫导致植物光合作用功能受损甚至死亡。作者进行的生理实验数据结果显示,在盐碱胁迫下垂丝海棠的光系统II(PSII)反应中心诱导了光抑制作用,导致光能利用效率的降低;同时光合系统遭受损害,最终导致了叶绿体中电子传输链的失衡,从而加速了ROS的形成并引起氧化性损害。植物已经进化出许多光保护机制,例如能量耗散机制。本研究发现,胁迫并未触发垂丝海棠的能量耗散机制,因此推测是其它应激响应机制避免在叶绿体中产生过多的ROS。
为了验证这一假设,作者通过蛋白质组学和代谢组学联合分析的方法,构建了系统性的代谢途径图,以探索应垂丝海棠应对盐碱胁迫的分子调控机制(图5)。该图显示,累积的脱镁叶绿酸a分别通过PPD和PAO转化为焦脱镁叶绿酸a和红色叶绿素,这是叶绿素分解的关键步骤。在拟南芥中抑制ACD1表达导致脱镁叶绿酸表达异常的过程与叶衰老有关,其积累最终导致细胞死亡。因此可以推断垂丝海棠叶的表型变化可能是由脱镁叶绿酸a的积累引起的。叶绿素是主要的光合色素,能够收集、传输和转换光能。叶绿素的分解导致其含量降低,从而影响光合作用效率并加剧光抑制作用。
光电系统包括光电系统I(PSI)和光电系统II(PSII)。本研究中发现有六种蛋白质与垂丝海棠的光合作用和盐碱胁迫相关,包括四种PSII蛋白(PSBR,PSBO2,PSBP1和PSBQ2)和两种光系统I(PSI)蛋白(PSAH2和PSAK)(表6)。有报道PSBR表达的降低了光诱导的非光化学猝灭(NPQ)的幅度。叶片中NPQ的降低可能是PSBR下调的结果。PSBO2、PSBP1和PsbQ2是真核PSII的氧气释放增强剂(OEE)蛋白,是光合水氧化所需的蛋白。OEE蛋白在维持稳定性和修复PSII反应中心的损伤以减轻盐碱胁迫中起着重要作用。先前研究表明ROS抑制光损伤的PSII的修复,但不会加速对PSII48的破坏。然而作者研究证实,盐碱胁迫会增强PSII的光抑制作用,表明ROS直接损害PSII。OEE蛋白的显着上调表明,垂丝海棠试图通过调节D1蛋白的更新来修复PSII。此外实验数据表明PSBP1与PSBQ、PSBO2、PSAH2和PSAK相互作用(图4b),因此作者认为PSAH2和PSAK可能是PSI保护蛋白,但其功能未知。需要进一步研究加强对盐碱胁迫诱导变化的认识。简而言之,光合作用相关蛋白的上调有助于维持光合作用水平以应对盐碱胁迫。
2. 盐碱胁迫下糖代谢的重要作用
蔗糖是光合作用的主要产物,被广泛认为是植物代谢活动的能源。本研究发现盐碱胁迫诱导了蔗糖的大量积累和UGE3蛋白的表达(图5和表2)。蔗糖有调节渗透压和解毒作用,表明在盐碱胁迫下植物通过积累蔗糖适应渗透压变化并保护自己免受ROS的伤害。在盐碱胁迫下垂丝海棠的光合作用降低了(图7a)。可以推测UGE3上调促进了多糖的降解,导致产生额外的蔗糖来抵消盐碱胁迫。此外蔗糖还起调节生物和非生物应激反应的信号分子的作用,即作为信号分子的蔗糖可能调节许多重要的代谢过程并激活其他抵抗途径。本研究中包括XYL2、AMY1、BGLU13和BGLU44在内的4种显著上调的蛋白以三种不同的途径参与了葡萄糖的合成(图5,表2),表明在盐碱胁迫下葡萄糖的合成途径增强。
有研究表明水稻中EMP和PPP是葡萄糖降解的重要机制,它们在产生能量以及初级和次级代谢产物的碳骨架中也起着关键作用。有趣的是,在本研究样本中也未检测到葡萄糖。盐碱胁迫下,垂丝海棠叶片中参与EMP和PPP的三种蛋白质ALDH2B4、PDH2和EMB2024的表达显著上调(图5,表2),表明这些蛋白质促进了葡萄糖的降解。葡萄糖是主要的能源,为垂丝海棠其他代谢产物的合成提供了底物和能量,可以解释为什么葡萄糖在盐碱胁迫下不会积聚。

|
图7 | 盐碱胁迫下垂丝海棠的生理参数:
a净光合速率(Pn);b气孔导度(Gs);c蒸腾速率(Tr);d 叶绿素a含量;e叶绿素b含量;f类胡萝卜素含量(Car);g初始荧光(F0);h最大荧光(Fm) i最大光化学效率(Fv / Fm);j非调节能量耗散(Y(NO));k光诱导的非光化学猝灭(NPQ);l光化学猝灭系数(qN)
3. 氨基酸代谢在提高垂丝海棠的盐碱耐受性中起关键作用
许多研究表明糖代谢为氨基酸代谢提供了足够的能量,并且EMP的中间体也可以用作氨基酸合成的前体。本研究表明通过莽草酸途径合成的D-苯丙氨酸和色氨酸在盐碱胁迫下大量积累(表3)。值得注意的是,作者发现半乳糖代谢和α-亚麻酸代谢中所有相关蛋白和代谢产物(如PMM、At5g28840、VTC4和AOC2和硬脂酸)的水平均下调(图5,表2)。表明两个途径均受盐碱胁迫的抑制。这种现象可能是由于减少了半乳糖的消耗和硬脂酸的合成,以及氨基酸代谢的能量供应增加。
在高等植物中,氨基酸响应各种胁迫而积累,并在植物生长中具有多种功能。但是本研究结果表明相关蛋白质水平没有改变(图5)。蔗糖作为一种信号分子,可以将应激信号传递到其他途径,并调节相关蛋白质和代谢产物的表达以应对逆境。之前糖代谢分析表明蔗糖含量上调。因此作者推测D-苯丙氨酸和色氨酸的积累可能是由蔗糖信号响应盐碱胁迫引起的。D-苯丙氨酸可逆地转化为苯丙氨酸,在苯丙氨酸代谢中进行一系列反应后产生苯乙酰基甘氨酸。ASP3下调导致苯乙酰基甘氨酸减少,这表明垂丝海棠通过限制苯丙氨酸代谢以抵抗盐碱环境(图5,表3)。相反参与天冬氨酸和谷氨酸合成的ASP3上调表明ASP3可能是信号相关蛋白。ASP3的表达上调可以启动氨基酸防御反应以抵抗盐碱胁迫。多种氨基酸(脯氨酸、丝氨酸、苯丙氨酸和苏氨酸)的积累可以通过介导去除ROS以及控制损伤和修复来提高植物对盐胁迫的耐受性。此外这些氨基酸还是许多次生代谢产物的前体,包括色素、生物碱、激素和细胞壁成分。
4. 蔗糖信号传导通过诱导类和类黄酮生物合成途径调节ROS稳态合成
黄酮类化合物和木质素生物合成所需的苯丙氨酸也是苯丙素的重要前体。本研究中显著上调,通过上调CYP75B1转化为槲皮素,从而增强了类黄酮的生物合成(图5,表4)。槲皮素和是众所周知的黄酮醇苷,在清除过量ROS起积极作用。先前的文献报道证明蔗糖信号传导可调节类黄酮合成,以控制盐碱胁迫下ROS的稳态。作者实验结果表明,在生物合成途径中大量蛋白质和代谢产物被下调,尤其是参与木质素合成的蛋白质,例如PER3、PER17、PER12、PER52、PER53(PER,过氧化物酶超家族蛋白)和ALDH2C4(图5,表4),表明木质素的合成受盐碱胁迫抑制。木质素为植物次生细胞壁提供了机械强度,不仅保护细胞免受非生物胁迫,而且还可以作为首先感知并响应环境胁迫的结构,木质素生物合成的下调可能是抵抗非生物胁迫的防御机制。这些结果表明,细胞壁损伤和响应盐胁迫改变的成分是可能的盐敏感机制,将进一步触发植物对盐的响应。此外木质素生物合成过程中类化合物是碳和能量流的重要途径。因此类生物合成的减少可能会维持黄酮类生物合成能量和碳骨架。本研究中BGLU13和BGLU44在类生物合成途径中被上调,该途径参与香豆碱的合成。但是香豆碱在盐碱胁迫条件中下调(图5,表4)。该结果表明BGLU13和BGLU44可能是防御相关蛋白,防御蛋白在修复氧化损伤中起关键作用,它们的上调可能保护植物免受盐碱胁迫。以上结果代谢是关键的防御信号传导途径。
表7 用于垂丝海棠基因qRT-PCR分析的引物列表

|
5.蔗糖信号通过诱导生物碱代谢和植物生长素的合成来调节ROS的稳态
生物碱是色氨酸和谷氨酸合成的次生代谢产物。在防御胁迫(如盐和水胁迫)中发挥作用。本研究中长春花碱含量上调很多,但在吲哚生物碱途径中未鉴定到相关蛋白(图5,表5),表明长春花碱的积累可能是对盐碱胁迫的防御反应,长春花碱的积累增加了ROS的清除能力,从而提供了抗氧化损伤的作用并减少了植物的代谢紊乱。但在作者研究中,西萝芙木碱表达水平被下调,并且未在该途径发现相关蛋白(图5)。一个可能的解释是色氨酸是吲哚生物碱合成的第一步,它的积累为长春花碱和西萝芙木碱提供了基础。西萝芙木碱的降低可为垂丝海棠的长春花碱合成提供能量。作者认为生物碱水平的变化可能受到蔗糖信号的调节,长春花碱和作为非酶清除剂,可以减轻由ROS引起的损害,从而增强垂丝海棠的盐碱耐受性。
在这项研究中,蔗糖信号传导也影响中的生长素生物合成。最近的一些研究发现生长素除了调节植物生长和发育还调节植物对胁迫的反应(如干旱和耐盐度)。作者观察到,生长素反应性GH3家族蛋白T31B5_170的表达在盐碱胁迫下显著上调,并参与IAA合成(图5,表5)。GH3家族蛋白在植物生长素稳态调节中起着关键作用,T31B5_170可能诱导生长素信号转导途径,从而增强了垂丝海棠对盐碱胁迫的抵抗力。
实验结论
在本研究中作者发现盐碱胁迫诱导了ROS的积累,垂丝海棠依靠信号和代谢途径重新建立ROS的平衡。光合作用相关蛋白的表达上调提高了垂丝海棠光合作用能力,有助于维持光合作用水平以应对盐碱胁迫。蔗糖充当信号分子,直接介导氨基酸代谢、代谢以及吲哚、莨菪烷、哌啶和吡啶生物碱的代谢。这些途径在维持渗透平衡和去除ROS中起关键作用。此外蔗糖信号转导通过激活CYP75B1的表达来调节ROS稳态,从而诱导类黄酮生物合成,并通过激活T31B5_170的表达来增强垂丝海棠对盐碱胁迫的抗性,进而促进生长素信号传导。木质素合成过程中PER和ALDH2C4的降低进一步触发了植物盐碱应答(图8)。这是第一个使用联合方法进行垂丝海棠适应盐碱环境的分子机制研究,这项研究为进一步了解苹果对盐碱耐受性的反应提供了基础。

|
图8 | 植物盐碱胁迫应答过程中ROS的信号转导途径
推荐语
本文是一篇结合蛋白质组学和代谢组学技术的文章,作者进行了蛋白质组学和代谢组学的联合分析,结合生理学数据阐述了在盐碱胁迫条件下,垂丝海棠叶中发生的代谢变化和可能的防御机制。作者结合了大量文献,推断出一些关键的代谢途径,并构建了网络图,是一项典型的多组学联合分析工作。
往期回顾
老司机开讲 | 拥有11项基金申请经验老师,愿意“手把手”教您国自然基金申请秘籍
【爆品上市】 强力攻克:石蜡/甲醛处理的组织样本及微量样本的蛋白组学难题----PCT-DIA技术
【多层组学汇总】平均IF:22 高质量期刊文章,您值得拥有~
【胰腺癌、肝癌、前列腺癌】多层组学在癌症分型和治疗靶点中的应用
【盘点】13分的植物多层组学是怎么做的?看看这些科学家的研究~~
参考文献
(1) Martínez-Cuenca, M. R., Iglesias, D. J., Forner Giner, M. A., Primo-Millo, E. & Legaz, F. The effect of sodium bicarbonate on plant performance and iron acquisition system of FA-5 (Forner-Alcaide 5) citrus seedlings. Acta Physiol. Plant. 35, 2833–2845 (2013).
(2) Jin, H. et al. Comparative EST profiles of leaf and root of Leymus chinensis, a xerophilous grass adapted to high pH sodic soil. Plant Sci. 170, 1081–1086 (2006).
(3) Guo, R. et al. Comparative metabolic responses and adaptive strategies of wheat (Triticum aestivum) to salt and alkali stres. BMC Plant Biol. 15, 170–182 (2015).
(4) Guo, R. et al. Ionomic and metabolic responses to neutral salt or alkaline salt stresses in maize (Zea mays L.) seedlings. BMC Plant Biol. 17, 41–53 (2017).
(5) Kawanabe, S. & Zhu, T. C. Degeneration and conservation of aneurolepidium chinense grassland in Northern China. J. Jpn. Grassl. Sci. 37, 91–99 (1991).
(6) Martínez-Ballesta, M. C., Alcaraz-López, C., Muries, B., Mota-Cadenas, C. & Carvajal, M. Physiological aspects of rootstock–scion interactions. Sci. Hortic. 127, 112–118 (2010).
(7) Jia, X. M. et al. Comparative physiological responses and adaptive strategies of apple Malus halliana to salt, alkali and saline–alkali stress. Sci. Hortic. 245, 154–162 (2018).
(8) Hasegawa, P. M., Bressan, R. A., Zhu, J. K. & Bohnert, H. J. Plant cellular and molecular responses to high salt. Annu. Rev. Plant Physiol. Plant Mol. Biol. 51, 463–499 (2000).
(9) Yu, J. et al. Physiological and proteomic analysis of salinity tolerance in Puccinellia tenuiflora. J. Proteome Res. 10, 3852–3870 (2011).
(10) Fricke,W., Akhiyarova,G., Veselov, D. & Kudoyarova, G. Rapid and tissue-specific changes in ABA and in growth rate response to salinity in barley leaves. J. Exp. Bot. 55, 1115–1123 (2004).
END
