
诚信认证:
工商注册信息已核实! 扫一扫即可访问手机版展台
扫一扫即可访问手机版展台

“技”往开来 -- 浅谈4D-蛋白组学技术发展史(一)

截至目前,人类蛋白质组计划收录的质谱数据可覆盖人类约90%的蛋白,同比可映射至其他物种的蛋白。尽管如此,复杂体系单针蛋白组学鉴定深度依旧受限于液相分离能力、质谱扫描速度和灵敏度等因素。近些年,基于离子大小和结构在气相中进行分离的技术成为质谱领域的关注焦点。该技术不仅在高效性和便捷性上点燃了大众对离子淌度的兴趣,更因其能结合传统液相 (LC) 和质谱 (MS) 的技术优势而备受瞩目。为了能将基于新型捕集离子淌度的4D-蛋白质组学技术讲清楚,我们将通过一系列的文章,携各位共同回顾捕集离子淌度结合飞行时间质谱的发展历程和最新的进展。
01) TIMS和PASEF技术的发展
离子淌度谱 (Ion mobility spectrometry, IMS) 是通过额外加入一维离子淌度从而将离子根据大小和形状在气相中分离。传统漂移IMS中离子受弱电场中惰性缓冲气体阻尼效应,与惰性气体分子的碰撞会延缓运动。离子穿过漂移管的迁移时间由离子与缓冲气体的碰撞频率决定。因此离子迁移时间与结构、大小、质荷比及缓冲气体性质相关,根据迁移时间即可换算出离子碰撞截面积值 (Collision cross sections,CCS),CCS值小的离子相较于CCS值大的离子能够更早的到达检测器。自1960年代起,IMS和MS检测器实现耦合,随后各种IMS方法被研发出来并不断更新。这其中包括漂移时间淌度谱(DIMS)、行波离子淌度谱(TWIMS)和捕集离子淌度谱(TIMS)等。尽管IMS在毫秒级的分析时间尺度增加了其在蛋白组学研究中的应用潜力,但仪器和数据的复杂度高及灵敏度低限制了IMS的广泛应用。
目前,布鲁克专注于TIMS (trapped ion mobility spectrometry, TIMS) 和PASEF (parallel accumulation-serial fragmentation, PASEF) 联合技术。尽管从离子淌度发展的悠久历史来看,TIMS和PASEF兴起于十年前,属于相对新颖的技术,但新一代技术能够大幅增加离子传输效率和扫描速度,具有应用于蛋白质组学研究的无限潜力。
2011年TIMS的推出 (Fernandez-Lima,et al. 2011) 颠覆了传统IMS技术,用气体吹动离子逆电场迁移并根据离子淌度将其分批释放。这种设计使离子淌度分辨率可不受设备物理尺寸限制大幅提升从而实现空间紧凑设计,也可在比常规低一个数量级的电压下运行。目前商业配置的设备拥有双TIMS配置,第一个TIMS具有10cm的离子通道主要用于离子捕集,而与其串联的第二个TIMS负责离子的分批释放。由于双TIMS能够将离子捕集和释放周期形成闭环,从而提升离子利用率至100%。在100ms极短时间内TIMS可对特定淌度区间的离子富集并将其压缩至1~2ms半峰宽的淌度峰,这就为TIMS结合TOF质量分析器实现快速检测提供了可能性。impact II平台配备了一个TIMS,成为新一代timsTOF仪器的前身。
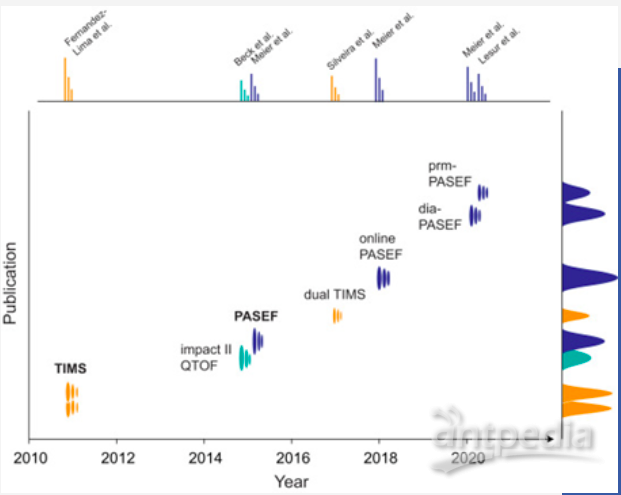
图一. TIMS和PASEF发展里程
02) TIMS和PASEF技术原理
TIMS将离子捕获在一个电动通道中,通道从入口到出口充斥着2~3 mbar的气流 (图二A)。气流对各离子产生的吹力会因其空间横截面积产生差异,横截面积越大则受到的吹力越大。这种气流吹力促使离子往前运动,而沿通道增强的直流电场阻力方向则恰好相反,当受到的气体吹力和反向电场力相等时,离子将会稳定淌度管在这一特定位置,即离子被捕集住。由于相同离子淌度离子会稳定在相同位置上,这就使得在离子源区域和传输过程中呈现发散状态的离子实现时间和空间上的聚焦,有利于提高仪器灵敏度和扫描速度。分析过程中,通过逐渐降低电场强度将离子在淌度维度上逐级洗脱,离子受到气体推力不变,而随着电场力下降,离子就由大到小分批释放。电场强度的调节是通过保持出口电压不变,以恒定的用户定义的频率增加通道入口电压来实现。
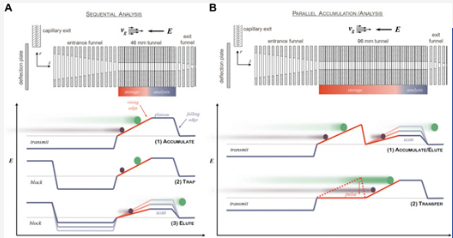
图二. 捕集离子淌度质谱原理示意图
在相同累积时间的情况下,单TIMS会损失超过一半的离子,因为离子在释放的时候需要阻止离子源过来的离子进入淌度管,以免打乱其中离子分布稳态,而离子源端离子是持续存在的。因此,Silveira等人提出增加为双TIMS设计解决了该问题,该设计将整个通道分区为离子捕获区、离子传输区和TIMS分析区三个区域 (图二B)。这种双TIMS的配置将离子累积和释放划分在不同区域完成,也使得累积和释放能够实现时间上的并行。离子在捕获区被捕获累积,随后通过一步简单的传递将其转移至分析区进行离子淌度分析。同一时间,捕获区会再次被下一批离子填满,从而实现离子零浪费 (Silveira et al. 2017)。近些年,串联TIMS成为了发展趋势。
PASEF的设计理念是利用离子累积和释放同步进行来提高MS/MS实验的效率。多肽离子通过捕集型离子淌度分析器进行分离,洗脱(~100ms)并在QTOF中检测,生成TIMS MS热图。在PASEF方法中,离子在淌度分析器中的分离和四级杆隔离同步进行,四级杆能快速切换到下一个母离子。timsTOF Pro采用了一种先进的分段四极质量过滤器,以提高离子传输和隔离效率。由于其超快的质量轴切换时间(<1毫秒),使得PASEF技术达到最好的性能。采用平行累积连续碎裂技术(PASEF)技术,可以实现120Hz以上的的扫描速度,而且可以多次选取低丰度肽段进行二级分析,以提高其谱图质量。
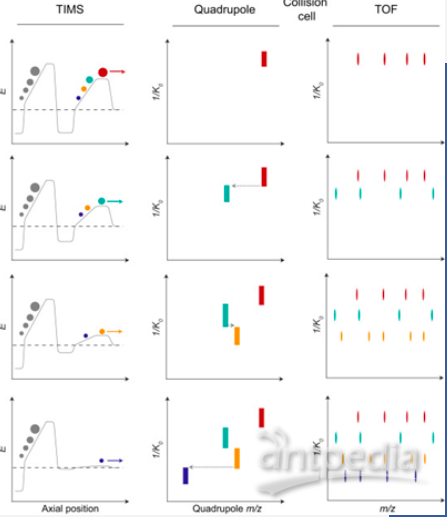
图三. PaSEF原理示意图
03) 4D-蛋白质组学的诞生
2018年12月01日,德国Max Plank Institute生化研究所的 Matthias Mann团队在新一期的《Molecular Cellular Proteomics》上在线发表了研究论文《Online Parallel Accumulation–Serial Fragmentation (PASEF) with a Novel Trapped Ion Mobility Mass Spectrometer》,文章中对timsTOF Pro平台在蛋白质组学分析中的表现进行了详细评估,也让4D-蛋白质组学正式进入大众视野,超快的灵敏度、超高的采集速度和超好的稳定性,让人们印象深刻。

图四. 4D-蛋白质组学首发文章
离子淌度首次被引入到大规模蛋白质组学分析,这使得蛋白质组学进入了4D新时代。4D-蛋白质组学是在3D分离即保留时间(retention time)、质荷比(m/z)、离子强度(intensity)这三个维度的基础之上增加了第四个维度,离子淌度(mobility)的分离(图5),进而大幅度的提高峰容量、扫描速度和检测灵敏度,带来蛋白质组学在鉴定深度、检测周期、定量准确性等性能的全面提升。
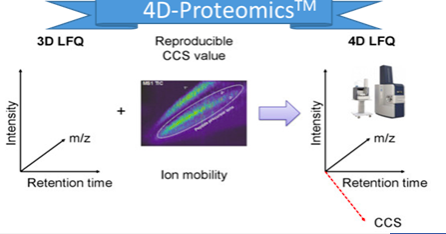
图五. 4D-蛋白质组学示意图
相信到这里,大家对4D-蛋白质组学技术研发背景有了一个全面的了解。小编在这里也提前做一个预告,在的面的几期,我们将进一步对全4D的采集模式(dda-PASEF®,dia-PASEFF®,prm-PASEF®)及其应用优势、4D-数据处理等方面进行详细的讲解。
参考文献
Florian Meier, et al., Online Parallel Accumulation–Serial Fragmentation (PASEF) with a Novel Trapped Ion Mobility Mass Spectrometer. Molecular & Cellular Proteomics, 2018
Florian Meier, et al.,Trapped Ion Mobility Spectrometry and Parallel Accumulation-Serial Fragmentation in Proteomics. Molecular & Cellular Proteomics, 2021
Fernandez-Lima, et al., Gas-phase separation using a trapped ion mobility spectrometer. Int.J. Ion Mobil. Spectrom. 2011

| 标签: | 布鲁克,蛋白质组学,4D,TIMS,PASEF |












