
诚信认证:
工商注册信息已核实! 扫一扫即可访问手机版展台
扫一扫即可访问手机版展台

人物专访 | Andrew Webb教授谈基于质谱的疾病蛋白质组研究

澳大利亚沃尔特和伊丽莎霍尔研究所(Walter and Eliza Hall Institute, WEHI)的Andrew Webb教授近日接受了《News Medical》的专访,对人类疾病相关的翻译后修饰研究的问题进行深入探讨,介绍了Andrew Webb教授所在的实验室是如何采用4D-Proteomics™技术进行翻译后修饰的解析和临床疾病的研究。

捕集型离子淌度(Trapped Ion Mobility Spectrometry, TIMS)与高分辨质谱的联合使用,建立了4D-Proteomics™研究的新标准,带来了检测灵敏度、扫描速度、仪器稳定性的全面提升。
4D-Proteomics™的核心是离子淌度技术,布鲁克timsTOF Pro质谱仪采用捕集型离子淌度技术,具有独一无二的离子富集和淌度分离功能,有效地提升了仪器的灵敏度,并且能准确、稳定地测量离子的CCS值,保证了4D数据的可信行。此外,离子的淌度分离能促进了共流出组分的同分异构体区分,减少二级混合谱图,尤其有利于翻译后修饰位点的精确分析。timsTOF Pro具有跨时代的覆盖深度、灵敏度、快速高通量的蛋白质组分析性能,适合临床高通量样本的研究。
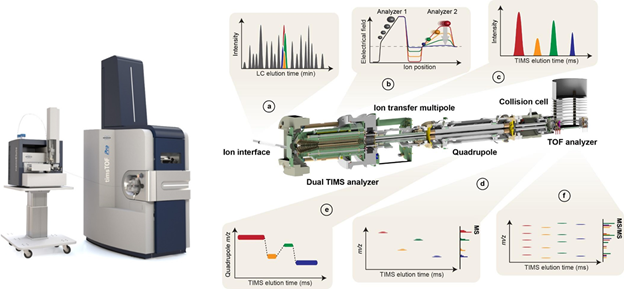
图:timsTOF Pro的结构示意图
Q:为什么对于翻译后修饰(PTMs)的理解是如此重要?
A:翻译后修饰导致蛋白形成不同的变体,调控着蛋白的功能和定位。细胞或者临床样本可以鉴定到11,000到13,000个基因产物,已报道的翻译后修饰类型超过107种,平均每个蛋白质存在于八种不同的翻译后修饰形式,具有极高的复杂性,仪器检测到的仅仅是冰山一角。我们推测一个细胞内大约存在10,000,000个蛋白变体。我的实验室采用质谱技术来解析蛋白质翻译后修饰(post-translational modification, PTM)在人类疾病中的作用,我们的目标是深入挖掘并尽可能多地关注这些基于PTM的蛋白质变体。
Q:如何将蛋白质组学的分析应用于人类疾病状态的研究?
A:在传统的Shotgun蛋白质组学中,当我们将肽段信息映射回蛋白质时,会丢失大量的信息,比如去除或忽略了离群肽。在我们的研究中,试图保留这些肽段,甚至根据不同问题进行肽段分级统计,并进行足够的实验重复。这样做时,仪器性能显得非常重要。另一方面是将关注的蛋白或者翻译后修饰进行富集,可以在蛋白质或肽段水平实现,显著提高检测的灵敏性。在我的团队中,我们致力于以肽段为中心的分析方法,通过代表性的修饰肽进行蛋白变体的定性、定量分析。
Q:您认为蛋白质组学和质谱法在哪些应用中最有潜力?
A:蛋白质组学是一个非常强大和动态的发现工具,它的潜力只受研究者创造力的限制。令我兴奋的领域之一是探索如何利用质谱技术帮助医学研究,比如药物的发现和生物学机制的解析。布鲁克timsTOF Pro捕集型离子淌度质谱的出现,推动了临床生物标志物的研究。它的信号具有卓越的长期稳定性,连续运行6到12个月后,仅仅需要一次毛细管清洁。我相信这是MS领域最新的进展之一,将对临床生物标志物研究产生重大影响。
Q:您在研究中使用的高敏感仪器有什么局限性吗?
A:高灵敏仪器有助于我们发现更多的离子特征,但不一定意味着更多的鉴定量。我们发现有大量的母离子共洗脱现象,导致匹配的肽段数目只有较低水平的增长。这个限制因素是仪器的硬件,不管是在数据依赖(DDA)或非依赖(DIA)的采集模式下运行。另一方面,离子利用率也是很重要的。在DDA或DIA采集模式下,只使用一部分母离子通过四级杆进行后续的采集,其余离子被损失掉,导致离子利用率低。此外,扫描速度也显著制约蛋白鉴定、定量。比如在DIA采集时,需要对低质量到高质量的窗口逐个扫描,大部分情况下一个循环接近4秒,周期较长。
Q:您认为如何提升数据采集模式?
A:使用短梯度纳升液相时,色谱峰宽较窄,如果采用上述4秒周期的采集方法,就难以覆盖到完整的色谱峰形态,导致鉴定失败或定量不准确。几年前,Joshua Coon提出了一个观点,认为蛋白质组学比以往任何时候都需要更好的色谱方法。我认为更大的问题是,采用更好的色谱和更高灵敏度的仪器,可能会意味着我们将看到更多共洗脱的等质量肽段,不利于精确的鉴定。然而,我相信随着离子迁移率的增加,引入了一个正交的分离步骤可以显著提高仪器的有效峰容量,减轻共洗脱的影响,促进蛋白质组的深度鉴定。
Q:为什么离子迁移率(IMS)不能在所有质谱仪上实现?
A:这归结为仪器的复杂性、离子损失和利用率等因素。我认为TIMS设备是难以置信的突破性技术,它是迄今为止我在职业生涯中看到的最激动人心的仪器发展。它的尺寸紧凑,使它能够放置在仪器的前端,保持一个合理的占地面积,并具有优越的稳定性。此外,淌度的引入增加了有效分辨率,简化了样本复杂性。另一个显著的优点是TIMS具有离子捕获累积功能,duty cycle接近100%,提高了仪器的灵敏性。
Q:通过提高离子的数量可以实现怎样的目标?
A:通过TIMS的离子累积作用最大化离子束,并利用正交分离来进行蛋白质组的深度鉴定,一定有很多团队在进行相应数据采集、分析方法的开发。timsTOF Pro根据淌度、m/z筛选母离子,并将碎片离子与母离子进行匹配。根据母离子的信号强弱,判定二级采集的次数并将二级信号进行累积,从而增强检测的灵敏度,并且由于多维分离,二级谱图的归属性更加特异。当我们查看数据时,印象深刻的一件事是图谱的高保真度和MS2碎片的丰富性。
Q:准确的CCS值也有助于实现临床应用吗?
A:碰撞截面积(Collision Cross Section, CCS)是肽段固有的离子特征,CCS值的准确、稳定测量,为肽段的检测提供了多一维的信息,这一点是非常重要的,将有助于分析方法的发展。我们采用CCS值进行母离子的匹配和分析,能够有效提高匹配的准确性。我相信这将开辟一个机会,开发新的工具和软件,使我们不仅深入挖掘蛋白质组。我们还需要进行非常大的样本队列测量,很期待看到未来有哪些进展的发现。
| 标签: | 布鲁克,质谱,疾病,蛋白质组,Andrew Webb教授 |
