布鲁克纳米表面仪器部 刘曜纶 博士
生物分子的化学结构特性决定了它们在各种生物化学过程中的相互作用,从而进一步决定了它们在生物化学过程中的具体功能。目前基于AFM的纳米红外成像方法已被应用于表征生物分子结构的过程中,且其测量分辨率已达纳米尺度。然而,获得单分子水平的红外振动吸收光谱,仍然是研究的热点方向。
最近,剑桥大学的研究人员在《Nature Communications》期刊上发表了一项利用纳米红外光谱法测定单个蛋白质分子二级结构的研究,该研究使用了非共振、短脉冲、低功率(off resonance, short pulse, low power)的纳米红外光谱(ORS-nanoIR)方法,在单分子水平上获取了纳米尺度的红外吸收光谱和化学图像,且测量速度快、信噪比高。这种高灵敏度的测试方法使得精确测定单个蛋白质分子的二级结构特性成为可能。该项研究的结果为直接探索单个生物分子的化学结构特性以及它们在广泛的化学和生物系统中的相互作用铺平了道路。
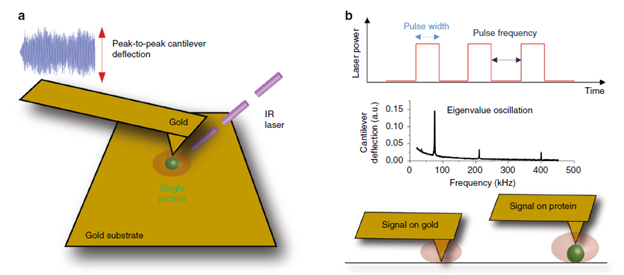
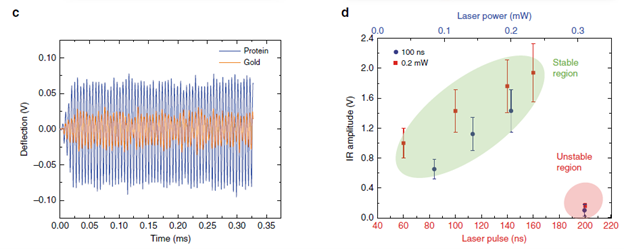
不同波数下的红外吸收强度与悬臂梁和样品的接触共振振幅成正比(如图1a)。为了提高AFM-IR的分辨率和灵敏度,可以使用镀金的硅探针和平坦的金基底(粗糙度≤ 0.4 nm)从而利用“避雷针效应”,增强探针与单个蛋白质分子接触的尖端电场,使红外信号增强。在以往的研究中,通过将激光器的脉冲重复频率与悬臂梁和样品接触的接触共振频率相匹配,可以提高测试的灵敏度(如图1b)。使用这种方法能够测量纳米尺度的蛋白质聚集物或只有几纳米厚度的单层薄膜。图1c所示为当探针分别处于金基底和基底上的单个蛋白质分子上时的悬臂梁的振动响应信号,如果蛋白质分子的直径小于探针针尖的曲率半径(约20-50 nm),则探针的很大一部分会暴露在金基底上,为避免信号过强出现不稳定状态(如图1d中的红色区域),研究者在激光器端添加了一个滤光镜,将激光功率衰减了一个数量级。然后,通过改变激光功率和脉冲宽度,确定在激光诱导下的悬臂梁弯曲程度在线性响应范围内的工作区域(如图1d中的绿色区域)。获得该线性响应条件可以在最大程度上避免悬臂梁的强激励,这对于在测量过程中避免对软生物分子造成损伤具有重要意义。
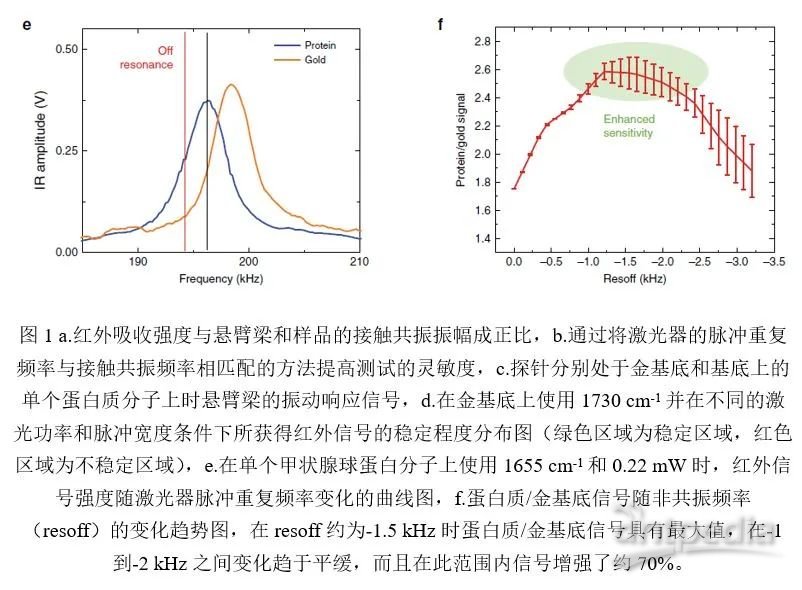
为了量化基底带来的影响,研究者对蛋白质和金基底信号的比例(蛋白质/金基底)与激光脉冲重复频率的关系做了深入研究。如图1e所示,黑色竖线的频率对应于悬臂最大振幅的接触共振频率,红色竖线的频率则是研究中使用的非共振频率(off resonance frequency,resoff),研究中发现蛋白质/金基底信号与激光脉冲重复频率的关系呈现非单调趋势,在resoff约为-1.5 kHz时(图1f中的绿色区域内)蛋白质/金基底信号具有最大值,观察到其响应在-1到-2 kHz之间趋于平缓,而且在此范围内信号增强了约70%。这些结果表明引入非共振方法可以对单个蛋白质分子的红外吸收信号进行有效测量。
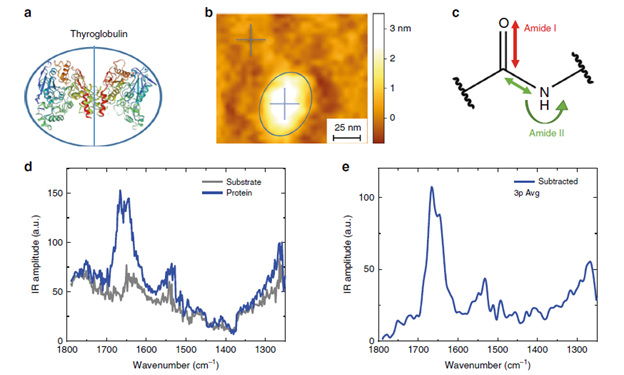
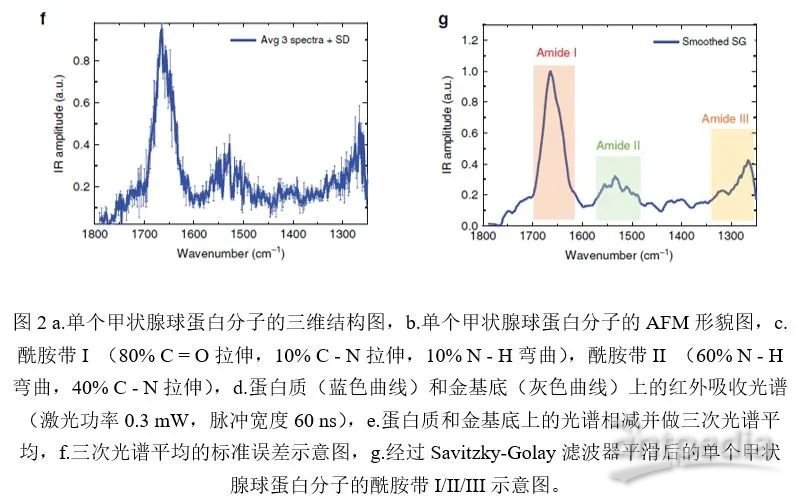
图2a和图2b所示为单个甲状腺球蛋白分子,图2a显示了其三维结构,图2b为AFM形貌图,图2c所示为与酰胺的红外吸收谱带(I/II/III)对应的分子键的运动方式。酰胺I谱带是多肽二级结构最常用的谱带,因为它大部分来自于主链C = O的伸缩振动,而这种振动与蛋白质的二级和四级结构密切相关。在蛋白质沉积后,由于二次溶质以及可能残留蛋白质的存在,样品的表面粗糙度会增加,而且在测量过程中,探针也可能受到污染。图2b所示为单个蛋白质分子的AFM形貌图,其中的十字叉显示的位置代表分别在蛋白质(蓝色)和金基底(灰色)上采集的红外吸收光谱的位置,其吸收光谱则对应到图2d中的蓝线和灰线。通过将蛋白质和金基底上的光谱相减,可以去除样品表面和探针附着污染物的贡献,同时通过对同一位置取多次光谱做平均,可以降低光谱的噪声水平(如图2e和2f)。平均光谱再通过Savitzky-Golay滤波器进一步平滑,可以清晰地显示出蛋白质分子的特征酰胺带I/II/III(如图2g)。
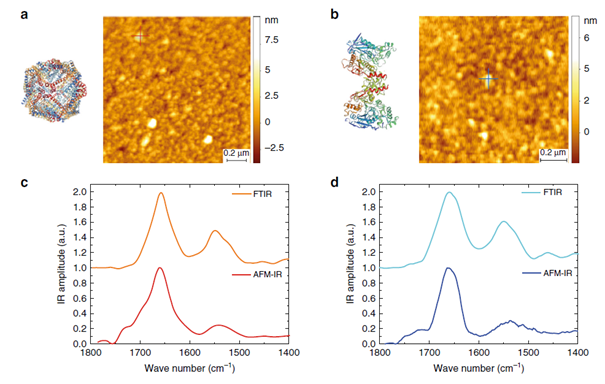
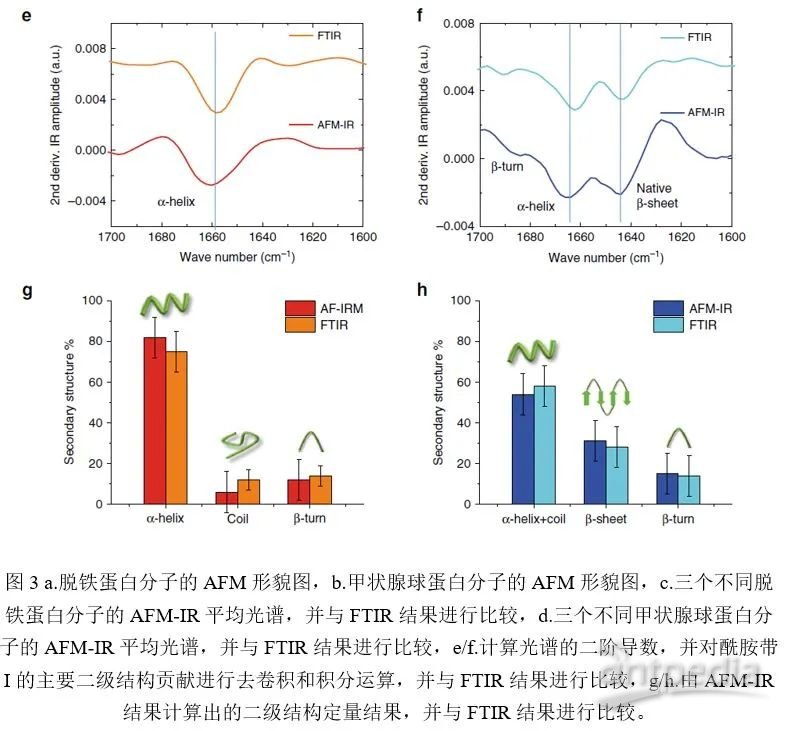
根据文献报道显示,脱铁蛋白的α螺旋结构含量为75%(如图3a),而甲状腺球蛋白α-螺旋结构含量为55%,β转角结构17%,分子内β折叠结构为28%(如图3b)。研究中使用ORS-nanoIR方法测量了脱铁蛋白和甲状腺球蛋白单分子的平均光谱(如图3c和3d),计算了光谱的二阶导数,并对酰胺带I的主要二级结构贡献进行去卷积和积分运算(图3e和3f)。结果表明,使用ORS-nanoIR方法测量出的脱铁蛋白和甲状腺球蛋白二级结构的光谱和FTIR的结果十分吻合,并且由光谱确定的单分子二级结构定量结果与之前的文献结果非常一致(如图3g和3h)。
综上所述,该研究介绍了针对单个蛋白质分子的ORS-nanoIR检测方法,该方法可以直接获取单个蛋白质分子的纳米红外吸收光谱和图像,为观察单个生物分子的化学结构特性开辟了新的途径。未来对涂层金属材料和探针尖锐程度的技术改进,可以使该检测的灵敏度和分辨率得到进一步的提高。此外,这一技术将为生物分子及其在大气或液体环境中的相互作用提供更加丰富的研究途径。

本文相关链接:
原文连接:
https://www.nature.com/articles/s41467-020-16728-1
nanoIR3/nanoIR3-s/nanoIR3-s Broadband介绍:https://www.bruker.com/products/surface-and-dimensional-analysis/nanoscale-infrared-spectrometers.html

扫码关注
布鲁克纳米表面仪器部
服务热线
400-890-5666
BNS.China@bruker.com




