诚信认证:
工商注册信息已核实! 扫一扫即可访问手机版展台
扫一扫即可访问手机版展台
Biacore 助力禽流感病毒感染与进化机制研究
新冠病毒国内疫情明显缓解,湖北省外的新增确诊也回落到个位数,湖北各市现存确诊数也持续下降,3 月 1 日武汉首家方舱医院休仓(最后一批患者出院)。这与忘我奋战在疫情一线的医务工作者和社会各界的努力是分不开的。而科研工作者们也放弃了假期,争分夺秒对新冠病毒的致病机理和传播进化机制进行深入研究。

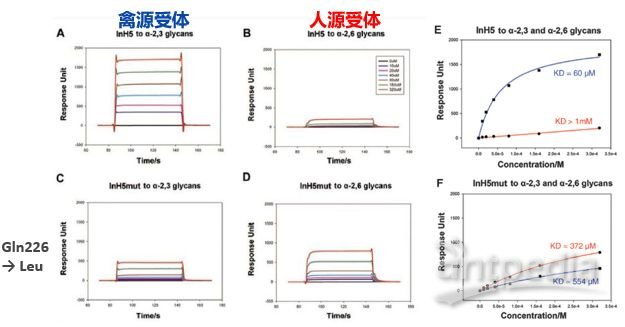
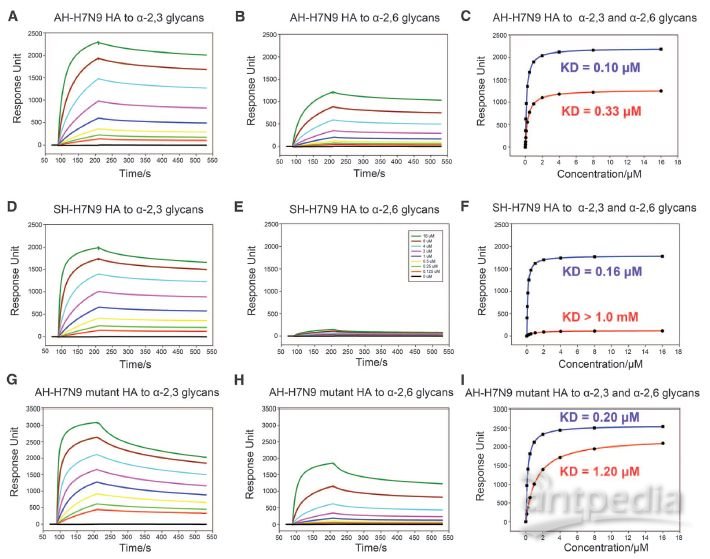
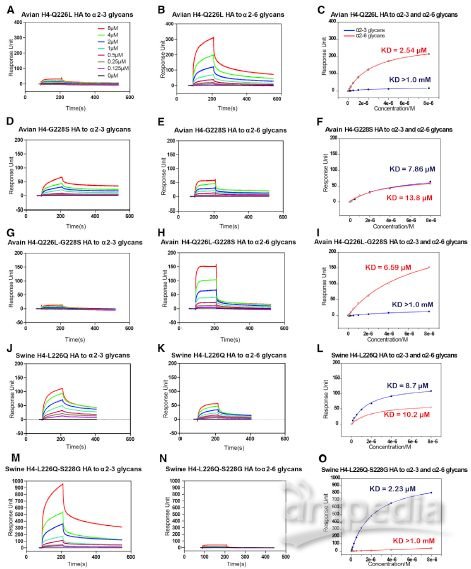
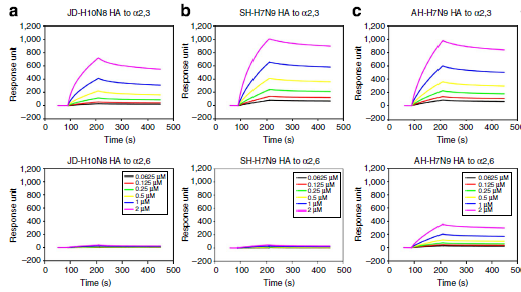
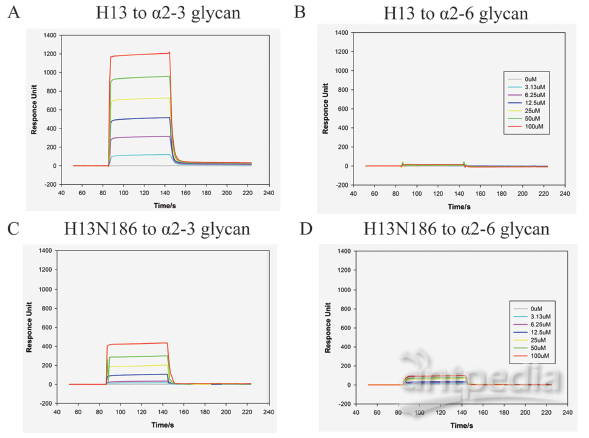
2020 年 2 月 20 日,美国德克萨斯大学奥斯汀分校的 McLellan 团体在 Science 在线发表题为「Cryo-EM Structure of the 2019-nCoV Spike in the Prefusion Conformation」的研究论文,该研究通过冷冻电镜解析了新冠病毒 2019-nCoV 侵染细胞的关键组分刺突糖蛋白(S 蛋白)的 3.5Å分辨率的结构,并通过 Biacore 发现 2019-nCoV S 结合细胞上的 ACE2 受体的亲和力比 SARS-CoV S 高 20 倍,解释了新冠病毒传染性之强的主要原因。而新冠病毒是如何从蝙蝠传播到人的目前仍是未解之谜,特别是中间宿主仍众说纷纭。 而作为分子互作检测的「金标准」的 Biacore 技术,则在禽流感跨种传播的机制研究中发挥了巨大作用。 本文将通过以下几篇文章的解读,和大家分享 Biacore 在禽流感跨种传播机制研究中的应用,希望科研工作者能从禽流感病毒从禽-猪-人的跨种传播与进化机制研究中得到灵感,加快新冠病毒不同亚型的进化与传播机制研究,从而助力本次疫情的防控,让大家的生产生活早日回复正规。 禽流感通常是在野禽中传播,但如果野禽和家禽接触可能会传染给家禽。而家禽会进一步传染给猪,其间禽流感或再次变异并最终传染给人。或者在家禽中发生变异直接传染给人。 流感病毒是一个带囊膜的 RNA 病毒,外膜上的血凝素(HA)蛋白负责识别宿主表面蛋白。 由于人和禽细胞表面受体不同,研究 HA 如何识别不同物种的细胞表面受体,对研究病毒的传播和进化机制尤为重要。HA 蛋白的受体为唾液酸,唾液酸是一种 9-碳单糖的衍生物,因糖苷键不同而分为α-2,3 糖苷键唾液酸和α-2,6 糖苷键唾液酸。α-2,3 糖苷键唾液酸主要为禽受体,而α-2,6 糖苷键唾液酸则为人上呼吸道表皮细胞受体。一旦禽流感病毒的 HA 发生变异,能识别α-2,6 糖苷键唾液酸,就有了传染人的可能。 2013 年中科院微生物所的研究人员在 Science 上先后发表两篇文章,详细阐述了禽流感病毒 H5N1 与 H7N9 跨种传播机制。 其中,在高致病性禽流感病毒 H5N1 的研究文章中,作者利用 Biacore 检测了禽流感病毒 H5N1 的 HA 及其点突变蛋白分别与禽源受体和人源受体的结合能力。结果表明未变异的 HA 蛋白只能与禽源受体结合(图 1 A)而不与人源受体结合(图 1B),但是当 HA 的第 226 位的氨基酸发生突变后(Q226L),该突变的 HA 蛋白则获得了与人源受体结合的能力(图 1D),并且亲和力明显提高。从这组 Biacore 数据中,我们可以非常清楚的看出 H5N1 禽流感传染人的直接原因:只需要其 HA 蛋白上一个氨基酸残基的突变(Q226L),便可以使 H5N1 获得感染人受体的能力。 图 1. H5N1 HA 及突变体与禽受体,人受体的互作 而在对禽流感病毒 H7N9 的研究文章中,作者同样利用 Biacore 详细分析了当时所分离到的两株人 H7N9 病毒:上海 SH-H7N9(含有禽特征残基 Gln226)和安徽 AH-H7N9(含有哺乳动物特征残基 Leu226)上的 HA 蛋白的受体结合特异性。他们将生物素化的禽受体和人受体分别固定在 SA 芯片上,将不同病毒来源的 HA 及点突变蛋白进行浓度梯度进样,方便快捷的得到互作结果。 研究发现 SH-H7N9 的 HA 偏向与结合禽受体(图 2 D-F),而 AH-H7N9 的 HA 既能结合禽也能结合人受体(图 2 A-C)。此外,AH-H7N9 的 HA 第 L226Q 位点突变同样能结合两种受体(图 2 G-I), 表明该氨基酸残基的突变,并不是 H7N9 获得传染人的直接原因,而是由其它氨基酸的变化影响了受体结合倾向的变化。由此可见,同为禽流感的 H7N9 跨物种传播和进化机制并不像 H5N1 那样简单粗暴,此间更有玄机。 图 2. SH-H7N9 HA,AH-H7N9 HA 及突变体与禽受体,人受体的互作 2019 年作者团队在 Cell 子刊再发文章,从不同年代的 H7N9 病毒株 HA 蛋白的序列上找到了端倪。结合结构生物学的比对(图 3)发现,SH-H7N9 和 AH-H7N9 的糖蛋白 HA 的受体结合位点有四个氨基酸残基的差异(138S/A,186 G/V,221T/P,226Q/L),分别位于受体结合位点的三个关键区域(130-loop,190-helix 和 220-loop)。既然之前 AH-H7N9 的 HA 突变 L226Q 仍然能结合人和禽受体,说明 H7N9 禽流感病毒获得人、禽受体结合兼容性可能的原因是另外三个位点。 图 3. AH-H7N9 和 SH-H7N9 的结构比对 图 4. AH-H7N9,SH-H7N9 HA 四突变体与禽受体人受体互作 首先,作者通过四突变发现: ■ 引入四个疏水氨基酸(A138/V186/P221/L226)的 SH-H7N9 的 HA 能以高亲和力结合人与禽受体; ■ 而引入四个亲水氨基酸(S138/G186/T221/Q226)的 AH-H7N9 的 HA 失去了结合人受体的能力但保留了与禽受体结合的高亲和力(图 4)。 为了更好的确定四个残基在决定 H7 各种亚型 HA 受体结合活性中的作用,作者基于 SH-H7N9 的 HA 蛋白做了一系列四个位点的不同组合的突变体,来评估它们对人和禽受体的结合能力的影响。 Biacore 结果显示: ■ 一个 G186V 的单点突变可以使禽特异的 SH-H7N9 HA 结合人受体,而不影响到其与禽受体的亲和力; ■ 即使其它三个位点已被替换为疏水残基(S138A,T221P,Q226L),如果 G186V 不突变,也不会结合人受体; ■ 说明 V186 是禽特异 H7N9 HA 获得人受体结合能力的关键。 ■其它两个位点(S138A 或 T221P)的单点突变不会造成明显的受体结合变化,仅保留了禽受体结合特异性。 ■ 此外,Q226L 单点突变会显著消除 SH-H7N9 HA 对禽和人受体的结合; ■只有当其它三个位点全是疏水残基(A138/V186/P221)时,Q226L 突变可以结合人受体并且仍保留对禽受体的高亲和力,与 AH-H7N9 的性质相符。 在这篇文章中,作者借助 Biacore 详细分析了 H7N9 HA 受体结合位点关键氨基酸的不同组合对其受体结合能力的影响,并且结合生物信息学和结构生物学研究结果,推断出了 H7N9 病毒自然的分子进化机制(图 5):在快速的传播过程中,H7N9 的 HA 蛋白在不断的发生氨基酸突变,其中 G186V 突变是禽特异 H7N9 HA 获得人受体结合能力的关键因素,在进化中也许比 Q226L 更早被选择。这些发现可以帮助理解禽流感病毒不同亚型的进化,为禽流感的防控和治疗提供了重要基础。 图 5. H7N9 病毒 HA 可能的进化机制 从上述两个例子我们可以看出,结构生物学解析与 Biacore 互作研究永远是一对「黄金搭档」,两者相辅相成,精确阐释了 H7N9 禽流感病毒从禽-猪-人感染的进化与传播机制。 X 射线晶体学或冷冻电镜技术能提供一个精细的蛋白复合物的三维结构,但是一个静态的瞬间;而 Biacore 数据能给出一个动态的结合解离过程。晶体结构中会给出结合界面一些重要的位点信息,而这些信息需要利用 Biacore 进行进一步验证,并且 Biacore 检测的准确性和高效低成本优势更是得以充分发挥。 在这篇 2019 年发表的对 H7N9 研究的文章中,作者就做了近 20 种突变,但仅利用一张芯片固定禽受体和人受体,同时还做了阴性对照,通过 10 mM NaOH 对芯片进行再生反复使用,20 个突变体在 Biacore 上按照多个浓度梯度全自动上样完成。无论是时间成本还是实验成本都是其他任何技术所无可比拟的。 除了 H5N1 与 H7N9 禽流感病毒以外,中科院微生物所的研究人员,以结构生物学+Biacore 分子互作为手段,还做了大量禽流感病毒其它亚型的研究工作(见下表总结),详细阐明了不同禽流感病毒跨种间传播的机理,并且为禽流感跨种间传播的预警与防控提供了理论基础。 ▼ 左右滑动查看全部文章 文章一 Avian-to Human receptor-binding adaptation by influenza A virus hemagglutinin H4. Hao S, et al., Cell Rep. 2017 Aug 1;20(5):1201-1214. Biacore 数据 文章二 Structural basis for preferential avian receptor binding by the human-infecting H10N8 avian influenza virus. Min W, et al., Nat commun. (2015) 6:5600 Biacore 数据 文章三 Adaptation of avian influenza A (H6N1) virus from avian to human receptor-binding preference. Fei W, et al., EMBO J. (2015)34(12):1661-73 Biacore 数据 文章四 Structure and receptor binding specificity of hemagglutinin H13 from avian influenza A virus H13N6. Lu X,et al., J Virol. 2013 Aug;87(16):9077-85. Biacore 数据 目前,新冠病毒疫情已在全球持续蔓延,国外确诊病例快速增长期已经到来,尤其是韩国,意大利,日本,伊朗,美国等国家。在这场没有硝烟的战争中,医务工作者毫无疑问是一线最可敬的人,而科研工作者奋战在实验室,同样是拯救生命的战场。 我们相信,有了 Biacore 分子互作的利器,再借助已经发表的新冠病毒的结构生物学研究成果,新冠病毒跨种传播及进化的分子机制的揭示,指日可待。 武汉加油! 湖北加油! 中国加油! 世界加油! Biacore 与你们一起共度难关! 参考文献: 1,An airborne transmissible avian influenza H5 hemagglutinin seen at the atomic level. Zhang W,et al., Science. 2013 Jun 2,Structures and receptor binding of HA from human-infecting H7N9 influenza viruses. Yi Shi et al . Science 342,243(2013) 3,Avian-to-Human Receptor-Binding Adaptation of Avian H7N9 Influenza Virus Hemagglutinin. Xu et al., Cell Reports 29, 2217–2228, November 19, 2019 4,Structure and receptor binding specificity of hemagglutinin H13 from avian influenza A virus H13N6. Lu X,et al., J Virol. 2013 Aug;87(16):9077-85. 5,Adaptation of avian influenza A (H6N1) virus from avian to human receptor-binding preference. Fei W, et al., EMBO J. (2015)34(12):1661-73 6,Structural basis for preferential avian receptor binding by the human-infecting H10N8 avian influenza virus. Min W, et al., Nat commun. (2015) 6:5600 7,Avian-to Human receptor-binding adaptation by influenza A virus hemagglutinin H4. Hao S, et al., Cell Rep. 2017 Aug 1;20(5):1201-1214.