硫乙醇酸盐流体培养基的前世今生
2020-07-20 09:05:40 默克生命科学
FTM(Fluid Thioglycollate Medium)的发明
在药品检验中,无菌与微生物限度检查培养体系中有一个最大的差别:无菌类产品必须关注厌氧菌的污染风险,而非无菌类产品此类风险较小。为了能在有氧气的普通环境中培养厌氧菌,前人经过很多的尝试。世界上公认FTM培养基是由Brewer在1940年发明,并在影响因子影响因子IF为29.978的权威杂志《美国医学会杂志》(The Journal of the American Medical ,medium for the "aerobic" cultivation of anaerobes)的论文。这在当时,完全就可以看成秘方。
配方中各成分的相爱相杀
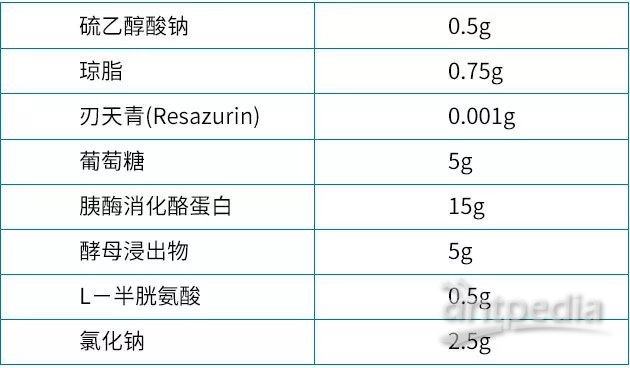
为了实现在有氧培养环境下对厌氧菌的有效培养,配方中各成分进行了不断优化,FTM于1955年被USP正式收录。下表就是现在各国药典中通用的配方清单——很多前人研究的精华。
硫乙醇酸盐对含汞防腐剂有中和作用,保证了培养基的氧化还原电势,但对梭状芽孢杆菌的孢子有抑制作用。
微量的琼脂增加了其还原环境的稳定性,琼脂比例也有发明之初的0.5g提高到了0.75g。
刃天青是一个良好的氧化还原指示剂,但同时对细菌的生长有抑制。0.001g这个浓度就是在氧化还原的指示功能和对细菌的生长没有显著影响两者间取得的平衡点。
葡萄糖提供了碳源并对氧化还原电势影响最小,同时降低了硫乙醇酸盐对梭状芽孢杆菌的孢子的抑制作用。
酵母浸出物和胰酶消化酪蛋白的最佳浓度为0.5%和1.5%,黄金比例有很好的促生长作用。
L-半胱氨酸能使梭状芽胞杆菌生长。
氯化钠维持均衡的渗透压。
正因为配方中各成分的关系是如此紧密,用量是如此精确,不同批次FTM的质量稳定性才如此关键。
现实的烦恼
3.1 讨厌的絮状沉淀
有研究表明,FTM灭菌后出现的絮状沉淀很有可能是琼脂。由于FTM配制时没有将琼脂溶解完全并分散均匀,灭菌后恢复室温会出现琼脂的沉淀。
推荐做法:温水中加入FTM干粉,文火加热煮沸并搅拌均匀,煮沸后保持1分钟(1分钟是国外培养基的推荐时间,由于琼脂质量的差别,国内培养基适当延长煮沸时间)。
是否一定要加热到培养基中氧气消失(俗称赶气)呢?研究表明赶气与否,灵敏度没有差别。
3.2 营养性不够的质疑
图中是国外FTM质量标准中的营养性接收标准,拿浑浊度(Turbidity)来说,普遍为+++,甚至有两种菌是++。
那国产培养基的营养性又是如何呢?有研究表明,使用乙型溶血性链球菌进行检测国产FTM培养基的灵敏度时,部分国产培养基对乙型溶血性链球菌的促生长能力表现较差。很有可能是配方中的酵母浸出物和胰酶消化酪蛋白的原料质量没有得到很好的控制。
甚至有人提出,药品用FTM培养基应该仿照临床用培养基,在配方中添加富营养的物质,比如羊血、组织浸液等等。从风险控制的角度来说,可以终端灭菌的无菌产品应该更关注灭菌控制,而无菌工艺生产的产品确实需要关注培养基的适用性。
无菌培养基完美方案
培养基作为无菌试验的一个组成部分作用不言而喻,没有促生长性能优异而稳定的培养体系,获取到经受消毒、辐照、除菌而残存的极少量微生物时,是不可能得到期待中肉眼可见的浑浊微生物的。无菌试验用的样品本身就是概率取样,在试验过程中应最大程度的避免由试验的误操作、设备风险或耗材不利引发的各种假阴性或假阳性的结果。因此在培养基与无菌耗材验证时应进行交叉验证。
默克无菌RTU(Ready to Use)培养基的胶塞穿刺验证
无菌RTU培养基验证项目
配合无菌套筒Steritest隔垫穿刺测试
Test summary:无菌套筒Steritest配合验证
针对薄膜过滤法的无菌试验
Following controls were conducted on the medla septum 一n order to ensure its functionality, particularly during sterility testing by membrane filtration:
a)最小穿刺针的强度以确保可穿刺操作顺利进行
The strength for piercing needles should be minimized to facilitate operatlon. A measure of the force (in Newton) required to pierce the septum with Steritest needles was performed.
b)穿刺后的胶塞孔不得有颗粒进入培养基, 还须避免胶塞材质堵塞液体转移。
这些颗粒有可能引起交叉污染和针头堵塞,及假阳性。
Coring of the septum must be minimal to prevent the transfer of septum particles into the media and also to avoid needle clogging that could stop liquid transfer. These particles could lead to a false positive interpretation or a needle blockage during sterility testing.
Acceptance criteria: Absence of septum coring. 无明显的穿刺后胶塞孔
薄膜过滤后的促生长试验Fertility /
Growth promotion test by membrane filtration:
默克无菌RTU(Ready to Use)培养基的促生长验证是在经无菌套筒Steritest过滤后,接种14种微生物,包括6种USP/EP/JP推荐的常规微生物,8种在无菌生产环境常见的,以及对无菌培养体系敏感的难于培养的微生物。例如痤疮丙酸杆菌,是一种环境常见控制菌:革兰氏阳性杆菌,对厌氧环境敏感,特别是针对生物制品产品中存在有机汞成分作为防腐剂时。表皮葡萄球菌,是作为汽态过氧化氢(VHP)敏感的革兰氏阳性球菌代表,以及其他具有无菌环境和无菌试验阳性菌种代表。
外包装盒及螺旋盖易于分辨
默克自1974年与FDA共用开创封闭式薄膜过滤无菌检测方法,并发明Steritest无菌过滤系统,在44年间默克作为无菌试验设备和耗材的创新先驱,积累丰富的试验数据和经验。默克又作为制药行业中的一员,是无菌试验的执行者,深刻理解无菌试验每个环节的风险。更多关于无菌检查培养基的风险,及无菌检查系统的验证、培训相关问题,欢迎留言讨论。
04-07 市场部
清明祭祖,链接祖先 承接力量感与价值感04-04 SHINE
如何在环境监测的背景下,全面掌握三维荧光光谱?【4月16日 | 在线讲座】04-03 HORIBA
尽显仪器人才未来风采—— 厦大学子HORIBA学习实践圆满结束!04-03 HORIBA
【设备更新仪器推荐】 显微光谱测量系统 ——SMS04-03 HORIBA
新品发布丨LH-F112化学需氧量(COD)智能回流消解仪,智能高效!04-03
新品发布丨清淼系列LH-T6VFA挥发性脂肪酸测定仪,无需蒸馏快速出值!04-03
新品发布丨LH-BOD606生物化学需氧量(BOD5)测定仪,开启四屏互联时代!04-03
新品发布丨LH-S600红外测油仪,主机一体化设计,开机即用!04-03
新品发布丨新羽系列LH-C700便携式多参数水质测定仪,全能选手!04-03
新品发布丨清澜系列LH-P3VFA便携式挥发性脂肪酸测定仪,快速灵活!04-03
健康科普|安杰科技带您揭开“碘”的神秘面纱——碘元素检测的重要性及日常应用04-03
海能技术2024年渠道商交流会——郑州站04-03
可视化风味分析工具——气相离子迁移谱联用仪(GC-IMS)04-03
4月13-16日,法国CODRA & 宏集将参与香港InnoEX国际创科展,诚邀您的莅临!04-03 宏集科技
【百特小课堂】各种粒度测试方法的优势和不足04-03
BeNano 90 Zeta 纳米粒度及 Zeta 电位分析仪04-03
四月展讯,百特与您不见不散!04-03
使用BeNano 180 Zeta检测BSA溶液流变学信息04-03
ICP-MS法在茶叶非金属元素分析中的应用04-03 管理员