【徕卡课堂】利用激光显微切割分离植物细胞和组织用于微量化学分析
2019-02-25 13:54:35 徕卡显微系统(上海)贸易有限公司
在各种植物生理和生化过程中,都存在植物次生代谢物,这些物质能够令植物与其生物环境和非生物环境顺利实现相互作用。上述化合物在组织和细胞水平中的分布类型显示了植物防御系统如何组织起来,从而以一种定向、精确的方式控制所面临的环境挑战的。在本文中,我们主要介绍运用激光显微切割 (LMD) 技术分离不同植物细胞类型的相关论文,给读者以全面的认知。
激光显微切割系统 Leica LMD6和Leica LMD7用于切割特定细胞、细胞群,以及不同植物的微小组织块,例如,Dilatris 属(血皮草科)[1]、挪威云杉(欧洲云杉,松科)[2,3]、金丝桃属(金丝桃科)[4]、油菜籽(欧洲油菜、十字花科)[5]、火把草(唇形科)[6]和大麻(大麻科)[7]。本文展示了LMD流程、样本制备(A)、激光显微切割(B)、样品后处理(C)的一般流程,以及靶向植物次生代谢物分析(D),并对样品进行逐个探讨(表 1)。

表1:LMD 程序的工作流程。
利用LMD探索挪威云杉(欧洲云杉)树皮中的植物化学成分
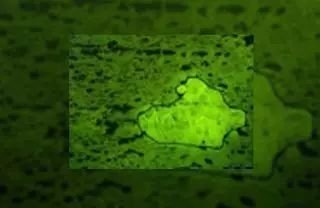
欧亚大陆寒带和温带森林中最为丰富的松柏科植物当属挪威云杉(欧洲云杉)了。这种生态和经济价值都很高的松柏科植物可以合成一系列化学防护化合物,例如,油性树脂,单核、倍半和双萜类的粘性混合物,不同的酚醛树脂,包含苯丙素类、芪类、黄酮类,这些次生代谢物产生于植物抵御病原菌和食草动物过程中。大量资料都在探讨油性树脂的防御作用,而极少文章阐述多酚类的防御作用,而这一问题却是 Schiebe 等人研究的焦点[11]。运用 LMD 和冷冻 NMR 光谱技术相结合,对挪威云杉树皮(图 1)的短石细胞(硬化细胞)进行微量化学分析。通过对比提取物与参照物的 NMR 光谱以及 MS 数据,鉴定两个酚类化合物、芪类化合物(stilbene astringin)和黄烷酮醇 dihydroxyquercetin 3''-O-β-D-葡萄糖苷[2]。
(A) 从室外生长树木的不同高度(5、15 和 20 米)处获取树皮块样本。用一块新的刀片在地上 1.5 米处纵向切割上述样品。将冰冻的带状物送到实验室,并浸入冰冻包埋剂中,并用液态氮立即冷冻,随后将其保持在 -20°C 温度条件下。然后,在 -20°C 条件下,采用冷冻切片技术将样品块切成 30 um的切片,并放在载玻片上,随后将其放置在 Leica AS LMD 系统中,并保持切面向下。
(B) 在荧光模式(激发光波长:450–490 nm;二向色镜:510 nm;发射光波长:515 nm)下,可以从周围的韧皮部细胞中区分短石细胞。利用重力作用,将激光显微切割的样品收集在微量离心管的管帽中。须等待两至三天时间,才能对各个样品进行切割操作。过量包埋剂可以避免短石细胞的收集延伸至切面边缘。
(C) 对收集管进行离心,使样品沉淀在容器的底部。将样品放在黑暗处、4ºC 下含有硅胶的 TLC 箱中干燥处理 48 小时。温和的条件能够确保彻底干燥,并将 NMR 光谱中的残余 HDO 信号最小化。
(D) 在 NMR 管中进行提取操作,在该管中加入植物样品和氘代甲醇,并对其进行声波处理 5 分钟。然后,立即记录 1H-NMR、1H-1H COSY 和 HSQC 光谱,以确定两种酚类化合物(如上所述的 astringin 和 dihydroxyquercetin 3''-O-β-D-葡萄糖苷)。芸香苷用作 1H-NMR 对两种酚类化合物进行定量分析的内部标准。
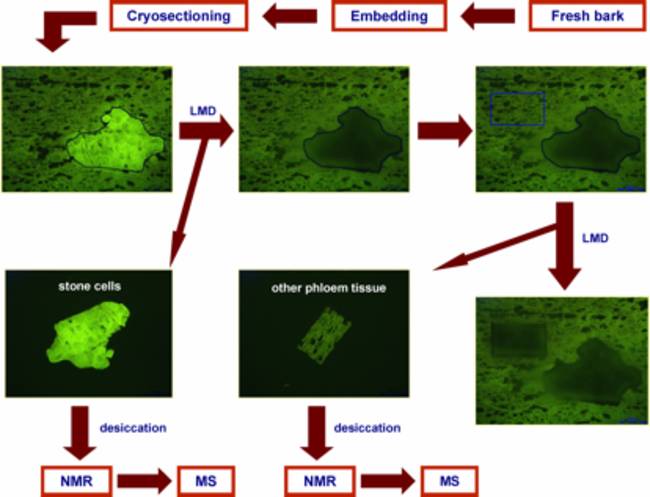
图 1:激光显微切割 (LMD)/NMR/MS 组合方案流程图([2] 后予以修改)。
经过以下单位许可:Springer Science + Business Media:Li S-H, Schneider B, and Gershenzon J:Microchemical analysis of laser-microdissected stone cells of Norway spruce by cryogenic nuclear magnetic resonance spectroscopy.Planta 225 (3):771–79 (2007); doi:10.1007/s00425-006-0376-z.
尽管成熟的挪威云杉树常会遭到树皮甲虫--云杉八齿小蠹及其蓝色真菌的侵袭而致枯萎,该种松柏科植物的某些基因型对树皮甲虫及其相关真菌的抵抗力比其他要高[12]。云杉树皮的特定韧皮薄壁细胞发生膨胀,并在树皮甲虫及其微生物菌体的侵袭下,改变其植物化学成分。将 LMD 与 1H-NMR 搭配使用,以便比较正常韧皮薄壁细胞的植物化学成分与云杉树皮受到蓝变真菌的韧皮薄壁细胞的植物化学成分进行对比(图 2)[3]。
(A) 分别从正常对照组中获取树皮块,并从同一棵树上收集受感染的韧皮薄壁细胞,在使用前,将之放在 –80ºC 温度条件下存储。将样品嵌入冰冻包埋剂中,用液氮速冻,采用冷冻切割技术将之切割为厚度为 40 µm 的薄片。
(B) 在 Leica LMD6000 系统下进行激光显微切割操作。在已受到蓝变真菌的感染的样品中,不收集已受到细菌感染的细胞,而选择受感染部位附近的细胞进行切割分析。选择两层健康韧皮薄壁细胞之间的细胞层用作筛胞的来源。
(C)样品直接通过氘代甲醇进行提取,并转移到 NMR 试管中。
(D) 立即记录提取物的 1H-NMR 光谱,并与苯酚参照物的光谱进行对比。研究显示,芪类葡萄糖苷 astringin 属于韧皮薄壁细胞中的主要次生代谢物,在周围筛胞中,浓度明显较低。韧皮薄壁细胞受到蓝变真菌感染后,显示黄酮类 (+) 儿茶酸,相比未受感染的细胞,其 astringin 水平将降低。
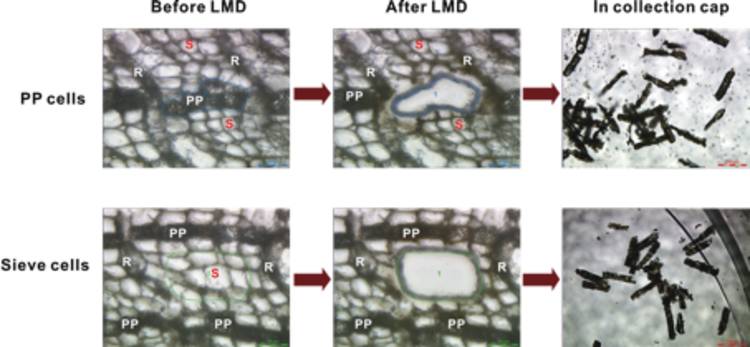
图 2:对多酚薄壁细胞进行激光显微切割 (LMD),从挪威云杉树的树皮中获取筛胞。显微照片展示了接受 LMD 前后的剖面(比例尺:50 mm),收集盖帽中的切口(比例尺:200 mm)。R = 射线薄壁细胞,S = 筛胞,PP = 多酚薄壁细胞([3] 后将予以更改)。经 Li S-H 等允许进行转载:Localization of phenolics in phloem parenchyma cells of Norway spruce (Picea abies).ChemBioChem 13:2707-13 (2012).Copyright © 2012 WILEY-VCH Verlag GmbH & Co. KGaA, Weinheim.
利用LMD 研究火把花盾状腺毛中具有防御功能的次生代谢物
唇形科植物的东南亚属火把花是二倍半萜化合物 Colquhounoids A–C 的来源,这是 C25 萜类化合物特殊类群的新类别 — 二倍半萜类 [15]。这种植物的树叶、蓓蕾和茎覆盖一层防御层,该防御层由许多非腺性毛状体、盾状和头状腺毛组成。采用 LMD 和超高效液相色谱法/串联质谱法 (UPLC/MS/MS) 相结合的方式,分析盾状腺毛的植物化学图谱(图 3)[6]。

图 3:中国科学院昆明植物研究所,单细胞水平植物次生代谢物研究平台。
(A) 将新获取的火把花叶片固定在专门的金属框架上。
(B) 将载玻片固定在 Leica LMD7000 系统上后,对腺毛进行显微切割,将其中 500 个收集到一个微管中。
(C) 进行短暂的离心分离(3000 g,4ºC,3 分钟),令腺毛沉淀在微管的底部。为进行提取,加入丙酮,并在 4ºC 下对小瓶进行超声波处理 10 分钟。
(D) 随后采用 UPLC/MS/MS 对上清液进行分析。三种主要化合物:二倍半萜化合物 Colquhounoids A–C,其已与火把花完整叶片材质的甲醇提取物分离,并通过 NMR 和 X 射线衍射法予以清晰鉴定,同时,在总离子色谱图中可以找到上述化合物,保留时间为 25.4、28.9 和 23.7 分钟,此外,在正 ESI 质谱中也可以找到上述化合物,分子量分别为 430、432 和 448(图 4)。

图 4:盛开的火把花,(B 和 C)位于叶背面的盾状和头状腺毛,(D–F) 采取激光显微切割技术收集盾状腺毛,(G–J) 采用 UPLC/MS/MS 方法对经过显微切割的盾状腺毛中的次生代谢物进行微量化学分析。([6] 后予以更改)。经过以下单位的批准后转载:Org.Lett.15:1694-98 (2013).Copyright 2013 Americal Chemical Society.
利用LMD 研究不同油菜籽组织(欧洲油菜)中次生代谢物分布规律
油菜籽(欧洲油菜)主要用于生产生物柴油、动物饲料和人类食用植物油。运用这种油料作物[16]制成的油产量在全球占比 15%。油脂主要存储位置是种子的胚芽。油菜籽种子的主要次生代谢物是芥子油甙和酚醛胆碱酯。尽管上述次生代谢物具有抗营养属性[17],但从生态学方面来说,它们在油菜籽与生物和非生物互作过程中是非常有用的[18]。采用 LMD 技术将油菜籽种子的四种组织成分(下胚轴和胚根、内子叶、外子叶、种皮和胚乳)互相分离开来[5]。
(A) 将油菜籽垂直嵌入冷冻包埋剂,在液氮中立即冷冻,并使用冷冻切片机在 –24ºC 下将其切分为厚度为 60 µm 的切片。
(B) 将这些切片直接固定在膜框式载玻片上,并采用 Leica LMD6000 激光显微切割系统对其进行切割。运用最强的激光光强和最慢的激光移动速度依次切割四个不同的组织部分,通过重力收集在单独的收集管中。
(C) 经过显微切割的材质随即将转移至 HPLC 小瓶中,加入 1 mL 80% (v/v) 甲醇,超声波浴 10 分钟,提取次生代谢物。此外,以提取溶液为内标,加入白芥子硫苷 (10 µM) 和肉桂酸胆碱酯 (10 µM),白芥子硫苷针对芥子油甙,肉桂酸胆碱酯针对芥子酸胆碱。随后,运用阴离子交换固相小柱将芥子油甙与其他化合物进行分离。
(D) 采用 LC-MS 方法进行非芥子油甙化合物分析。将 MS 数据、保留时间与这些参照物进行对比,从而采用 LC-DAD/MS 方法对去硫化形式下的芥子油甙进行分析。研究结果表明,在成熟的油菜籽胚胎组织中,芥子油甙呈均匀分布。作为显性酚类化合物的芥子酸胆碱呈均匀分布,此项特征能够支持其实现贮藏功能。此外,循环亚精胺等非芥子油甙碎片化合物,仅在下胚轴和胚根中结合,子叶中多半蕴含两种黄酮类。

图5、油菜籽组织激光显微切割流程图
下胚轴和胚根 (HR), 内子叶 (IC), 外子叶(OC), 种皮和胚乳(SE)。 标尺=1 mm. Fang J et al. (2012). PLoS ONE 7(10): e48006
使用LMD 分离大麻腺毛进行化学成分分析
大麻是一种一年生雌雄异株植物。大麻原产于东、中亚地区,一直以来,人们将其当做传统药物的来源[19]。研究发现,构成大麻生物药理作用的化合物似乎是大麻素 phytocannabinoids,是大麻植物中特有的含有烷基和一种单萜基团分子的独特组别。大麻素的主要贮存处和精油生产为腺毛,尤其是头状有茎腺毛。在为期八周的整体开花周期的后五周,大多会产生次生代谢物。因此,可以采用 LMD 技术在开花期的 4 至 8 周获取腺毛,并用 LCMS 和冷冻 NMR 分析大麻素分布。
(A) 将苞片和花朵切成小的片状(长度 0.2–0.5 cm),随后将这些切片固定在 4% 磷酸盐缓冲甲醛中,真空下放置 10 分钟,在 –4°C 温度条件下过夜放置实现浸透,然后固定在带钢框的载玻片上(PET 膜,25 mm × 76 mm)[20]。
(B) 使用 Leica LMD6000 显微镜切割完整的头状有茎腺毛、头部、茎部,以及完整的头状无柄腺毛。从每个样品中,切除 25–143 根腺毛,并利用重力作用收集在EP管中。经过显微切割的材质随即涡旋 1 分钟,并在微量离心管进行离心作用 5 分钟。为避免大麻素发生脱羧反应和降解作用,在 LMD 后,应将切割后的样品应直接存放在 –20°C 环境中[21]。
(C) 为进行 LC-MS 分析,在第 4、5、6、7、8 周分别向各个经过显微切割的样品中加入 60 µL 甲醇,超声波处理 10 分钟,并在室温下培养过夜。随后,将样品放在 H2O/MeOH (2/1, v/v) + 0.1% 甲酸溶液中稀释。为进行冷冻 NMR 测量,将最少剂量氘代氯仿加入切割后的头状有茎和头状无柄腺毛中(该腺毛于第 8 周获取)。超声波处理 1 分钟,随后将溶液转移到 NMR 试管中,进行分析。
(D) 经过 LC-MS 和 NMR 数据鉴定,Δ9-四氢大麻酚酸 (THCA) 和大麻二酚酸 (CBDA) 是头状有茎和头状无柄腺毛的主要化合物成分。对于在生长周期后 5 周收集的、经过显微切割的腺毛,可以通过 LC-MS 分析数据对其大麻素剖面进行全面研究。研究结果显示了受测样品的定性相似度。对开花期的所有样品,对其 THCA、CBDA、大麻萜酚酸 (CBGA)、Δ9-四氢大麻酚酸、大麻二酚和大麻萜酚进行鉴定。经检测发现,仅在第 8 周获取的完整头状有茎腺毛及其头部中,大麻色原烯和大麻酚属于次要成分。

图6、大麻腺毛形态
Nizar Happyana, et al., 2013, Phytochemistry

图7、对不同类型的腺毛和部位进行激光显微切割分离
Nizar Happyana, et al., 2013, Phytochemistry
结论
本文对我们发表的基于 LMD 的文献进行综述,展示了植物体的广泛多样性,可以使用这些植物体进行制备,以便在细胞水平上获取特定位置的植物化学信息(不同植物科、不同物种的树叶、茎部、花朵、种子材料)。基于 LMD 的化学分析能够展示在特殊组织中物质分布的不均匀以及取决于植物生长发育期的次生代谢物累积。因此,该技术可以用于测定器官依赖性的次生代谢物的生物功能。有关代谢物具体定位的更多信息,将有助于研究生物合成途径、代谢物修饰及其浓度调整。本文论述了针对 LMD 的不同植物体制备方法,但是,我们也意识到针对各类新样品修改或研发全新的分析策略所面临的挑战。分析方法的进一步完善,能够使得鉴定所需的材料量最小化。因此,在研究那些难以分离的样品材料时,可以减少分离组织和化合物分析的工作量。
鸣谢
感谢 Alexandra zum Felde 为本文编辑所提供的帮助。作者衷心感谢 Daniel Veit 为制备 LMD 专用切片做出的努力。
参考文献
1. Hölscher D, Schneider B: Laser microdissection and cryogenic nuclear magnetic resonance spectroscopy: an alliance for cell type-specific metabolite profiling.Planta 225:763-70 (2007).
2. Li S-H, Schneider B, and Gershenzon J:Microchemical analysis of laser-microdissected stone cells of Norway spruce by cryogenic nuclear magnetic resonance spectroscopy.Planta 225:771-79 (2007).
3. Li S-H, Nagy NE, Hammerbacher A, Krokene P, Niu X-M, Gershenzon J, and Schneider B:Localization of phenolics in phloem parenchyma cells of Norway spruce (Picea abies).ChemBioChem 13:2707-13 (2012).
4. Hölscher D, Shroff R, Knop K, Gottschaldt M, Crecelius A, Schneider B, Heckel DG, Schubert US, and Svatoš A:Matrix-free UV-laser desorption/ionization (LDI) mass spectrometric imaging at the single-cell level: distribution of secondary metabolites of Arabidopsis thaliana and Hypericum species.Plant Journal 60:907-18 (2009).
5. Fang JJ, Reichelt M, Hidalgo W, Agnolet S, and Schneider B:Tissue specific distribution of secondary metabolites in rapeseed (Brassica napus L.) PLoS One 7: e48006 (2012).
6. Li C-H, Jing S-X, Luo S-H, Shi W, Hua J, Liu Y, Li X-N, Schneider B, Gershenzon J, and Li S-H: Peltate glandular trichomes of Colquhounia coccinea var. mollis harbor a new class of defensive sesterterpenoids.Organic Letters 15:1694-97 (2013).
7. Happyana N, Agnolet S, Muntendam R, van Dam A, Schneider B, and Kayser O:Analysis of cannabinoids in laser-microdissected trichomes of medicinal Cannabis sativa using LCMS and cryogenic NMR.Phytochemistry 87:51-59 (2013).
8. Fang JJ,Schneider B:Laser microdissection: a sample preparation technique for plant micrometabolic profiling.Phytochemical Analysis (2013); doi:10.1002/pca.2477.
9. Cooke R,Edwards JM:Naturally occurring phenalenone and related compounds.Progress in the Chemistry of Organic Natural Products 40:153-90 (1980).
10. Gershenzon J, McCaskill D, Rajaonarivony JIM, Mihaliak C, Karp F, and Croteau R:Isolation of secretory cells from plant glandular trichomes and their use in biosynthetic studies of monoterpenes and other gland products.Analytical Biochemistry 200:130-38 (1992).
11. Schiebe C, Hammerbacher A, Birgersson G, Witzell J, Bordelius PE, Gershenzon J, Hansson BS, Krokene P, and Schlyer F:Inducibility of chemical defenses in Norway spruce bark is correlated with unsuccessful mass attacks by the spruce bark beetle.Oecologia 170:183-98 (2012).
12. Krokene P, Solheim H, Krekling T, and Christiansen E:Inducible anatomical defense responses in Norway spruce stems and their possible role in induced resistance.Tree Physiology 23:191-97 (2003).
13. Müller WE: Current St. John’s wort research from mode of action to clinical efficacy.Pharmacological Research 101–109 (2003)

04-30
致敬每一位辛勤的劳动者04-30
实践校企联合 | 院士团队师生到访兰友科技04-30
职业健康,与您同行 | 英盛生物助力《职业病防治法》宣传周04-29
欢迎来到聚合物的神奇世界04-29 Nouryon诺力昂
五一劳动节 | 致敬每一位追光人(内含互动游戏,点击参与)04-29 光电行业都会关注
“劳”有所获 “动”有所乐 | 卓立汉光五一放假通知请查收04-29
如何站在“小巨人”的肩膀上做好质谱产品?——ACCSI2024访衡昇质谱(北京)仪器有限公司总经理祝敏捷04-29
探索国产自主创新 | 国科大杭州高等研究院师生一行到访谱育科技参观学习04-29 点击关注→
热点应用丨“小”花粉“大”奥秘—RMS1000带你解密花粉热(下)04-28 天美
仪器推荐丨一体化全自动显微共聚焦拉曼光谱仪 RM504-28
仪器推荐丨科研级模块化显微共聚焦拉曼光谱仪RMS100004-28
HyperQuant与您一起破解呕吐毒素之谜04-28
用户速递 | 酸碱度对混合SOA 代理物-无机气溶胶液滴液-液相分离的影响04-28 光电行业都会关注
“元素分析自动化创新的一大步”---ACCSI 2024衡昇质谱展示革命性创新产品04-28 衡昇质谱
In China, For Global|微纯生物科技参加LAB-Indonesia 202404-28
中关村论坛之高端仪器创新,天隆智造再获殊荣04-28
天隆产品说丨天隆方案为动物健康保驾护航04-27
世界兽医日 | 与他们共同守护动物健康04-27
政策响应丨奥谱天成显微拉曼光谱仪重磅来袭!所有ATR8300用户免费升级04-26