
诚信认证:
工商注册信息已核实! 扫一扫即可访问手机版展台
扫一扫即可访问手机版展台

药物研发新利器——高级分子排阻色谱(Advanced SEC)
为应对全球来自竞争对手、投资者和不断膨胀的世界经济体量等巨大的全球性压力,制药行业正在积极努力寻求降低成本的方法和手段。为了使自己在市场上保持领先地位,各大公司不断进行药物储备,即保持新化学实体(NCEs)持续不断地进入市场和取得进展。从统计来看,这些公司的费用投资占比最大的便是用在研发部门(R&D)。然而,这一战略已经难以维继。潜在的NCEs耗尽,候选药物变得更加复杂,都令他们头痛不已。简化药物研发的技术因此变得极为重要。
缩短药品投入市场的时间和追求投资回报率最大化,是制药行业的两大重要目标。本文简要介绍一种可被用于制药行业的强大技术——分子排阻色谱(SEC),这一技术正在被越来越多地用于天然聚合物、合成聚合物和蛋白质的分离与表征。
重组靶向蛋白的探索
新药探索的目标仍然是鉴定新的具有稳定物化结构的化合物,要求其能够与生物靶点相互作用,以产生更好的疗效。偶然发现一种具有活性的药物的几率越来越小,尽管如此,制药公司还必须专注于对NCEs的探索,这种探索就只能通过真正从分子水平上理解疾病和传染行为的表现方式来实现。21世纪的靶向药物研发热潮由此兴起。
分子靶点很丰富,其中多数是蛋白质,特别是膜蛋白。一旦被识别和分离,有机小分子就被筛选出来测试靶向反应。理想情况下,有机小分子可能会增加蛋白质的信号通路或激活蛋白质的某种功能,从而阻止发病或者缓解症状。
不幸的是,小分子/蛋白质的相互作用往往是特定的,非选择性的小分子就会产生副作用,最初的候选药物能够直接达到治疗预期希望渺茫。因此,需要一定数量的基因操作才能达到预期。设计和测试这些重组蛋白质及其相互作用就成为了对现代分析方法的真正考验。
分子排阻色谱法(SEC)
在研究聚合物的科学家圈子里,SEC已经是应用广泛的成熟技术(他们更习惯于称这种技术为GPC)。而对于药物研发者而言,SEC还是一种未被广泛采用的新技术,它提供了一种快速纯化样品,并测量样品尺寸大小及多分散度的方法。在SEC实验中,样品溶液通过一组色谱柱(色谱柱由谨慎选择孔隙大小的固定相组成),较大的分子无法渗透固定相中的较小孔隙,因此,会更快地从色谱柱中洗脱出来。就这样,根据分子大小的不同,样品就被分成若干部分。比如一份蛋白质样品,就会通过色谱柱将折叠的、错误折叠的、未折叠的蛋白质片段分离出来。样品被分离后,进入到检测器。
传统的SEC系统通常使用紫外检测器(UV)或示差检测器(RI),以此来测量样品中不同成分的浓度,然后在系统校正的基础上,提供相对的分子量(MW)信息。然而,这类配置的系统具有极大的局限性,并不能充分发挥SEC这种分析方法的全部性能。
随着技术的进步,SEC分析方法有了长足的发展。目前最先进的SEC分析系统包含多种检测器,如小角光散射检测器(LALS)、紫外检测器(UV)、示差折光检测器(RI)和粘度计等,这些检测器所得结果可以相互结合,从而在极短时间内给出丰富的数据信息,如绝对分子量、分子尺寸,以及关于结构和支化等等的信息,同时并不依赖于任何假设、校正或者数据拟合,大大简化药物研发的成本。
在传统SEC设置中,色谱柱校正通常用普鲁兰多糖(水相)和聚苯乙烯(有机相)标准品来校准,用MW与洗脱体积的对应关系来确定每种新样品的MW相对值。当结合光散射检测器的时候,样品从色谱柱中洗脱出来,高级SEC可以直接测量样品的绝对分子量分布,无需依赖于洗脱体积。选择LALS(小角光散射)检测技术,还可以不依赖于数学模型直接得到准确结果。此外,配有光散射检测器的SEC提供MW的绝对测量,省去了复杂的预校正,只需简单运行一个窄分布标准品,就可以修正所有检测器延迟、峰展宽所引起的偏差。
将粘度计包含在检测器设置中,意味着可以直接测量特性粘度(η)和分子密度。利用这一信息,结合RI或UV检测器提供的浓度测量值,以及绝对MW数值,便可以得到流体力学体积(Rh)的真实数值。UV检测器提供了除RI检测以外的另一个浓度测量,使测量共聚物和共轭蛋白的MW绝对值成为可能。
在药物研发这类严格把控的行业,高级SEC系统的好处不言而喻,它可以提供直接的和丰富的测量数据。有能力解决与蛋白质、聚合物和辅料相关的多种应用。下面是一些使用这类系统的应用实例。
利用高级SEC纯化蛋白
一些候选药物是在大肠杆菌中重组蛋白得到的,这些蛋白质通常含有DNA碎片,必须清除和丢弃。光散射检测器可以用于分离和定量分析样本中的碎片和聚集体。
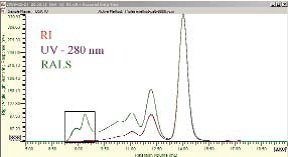
图1:牛血清白蛋白样品中聚集体分布图(使用带有RALS的三重检测器测量)
以牛血清蛋白(BSA)为例,如图1所示,用直角光散射检测器(RALS)(图中绿色曲线)测量散射光,其对聚合分子测量的灵敏度远高于RI(图中红色曲线)或UV(图中紫色曲线)。大量研究已经明确,BSA单体大约在保留体积(横坐标)14.00 mL处,二聚体约在11.80 mL处,三聚体在略多于11 mL处,更大的蛋白质聚合物大约在保留体积8mL处,还有一个未知的低聚物拖尾。在分析8mL处的蛋白质聚集体时,UV和RI两个浓度检测器几乎没有信号,RALS检测器则清楚地显示了在这段保留时间处存在两个不同的峰。这是因为光散射强度是MW和浓度的双重函数,而不只与浓度相关。
利用高级SEC定量蛋白质寡聚体
带有多重检测器的SEC还提供了一个收集纯化样品的定量数据的绝佳方法。从蛋白质研究角度看,这使得评估寡聚化成为可能。

图2 人血清蛋白(HSA)色谱图(使用三重检测器测量)
图2是一个人血清蛋白(HSA)分离样品RI浓度(图中红色曲线)和MW(图中黑色曲线)与保留体积关系的图。这些结果产生的定量数据如表1所示,展示了此方法的简洁。举个例子,单体的MW可以直接从表中读出,即66550道尔顿。
由于每个寡聚体的MW是可以获得的,因而所有四个峰值的重量分数(Wt Fr)也可以算出。表1显示该样品由94.5%的单体、5.1%的二聚体、0.4%的三聚体和0.1%的四聚体组成。这是一个用带有三重检测器的SEC获得深度定量信息的范例。即使初始浓度低至0.1%,光散射测量仍然可以得到准确的MW,如表1中四聚体峰的结果。
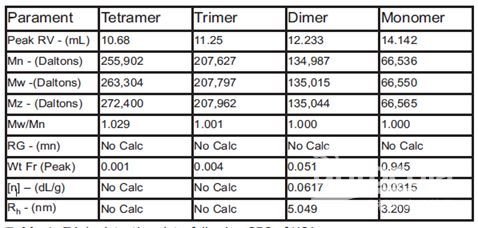
表1人血清蛋白(HSA)数据表(使用带三重检测器的SEC测量)
蛋白质/缓冲液匹配性的研究
所有的NCEs都需要测试其在不同缓冲条件下的稳定性。当盐种类和浓度不同时,一些蛋白质片段可能已经从根本上改变了构象。所以建立一个缓冲溶液体系来模拟样品原始条件至关重要。图3所示的例子显示,钙离子存在的体系中,一个多肽片段发生伸展。
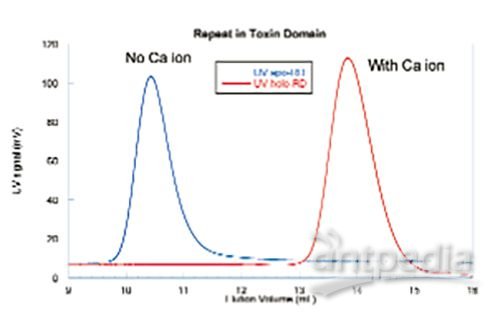
图3洗脱液中是否含有钙离子对结构域的影响
这种重复序列毒素的多肽结构域(RD)的构象,与钙离子有关。在这个实验中,同一种RD使用两种不同的流动相进样,浓度使用UV测量。第一种洗脱液中有钙离子,而第二种则没有。如图3所示,峰值从14 mL减小到大约10.5 mL。这表明RD发生了构象变化或者色谱柱中存在静电相互作用。

图4 RALS信号[红色曲线]和粘度计[蓝色曲线]的信号
至apo-RD[虚线]或holo-RD[平滑线]
区分蛋白质构象变化
在上面的例子中,尽管我们已经知道了变化,并理解了产生这一变化的可能原因,但传统的基于蛋白保留体积的SEC并不能对静电相互作用或构象改变做进一步区分。图4所示的结果表明,结合了RALS和粘度计的高级SEC清楚地显示了RD的apo-(未折叠的)和holo-(稳定的三级结构)状态是单分子结构。
表2显示了这个例子中apo-RD的特性粘度较高(0.35 dL/g),说明RD可能在缺钙时采取水合物和/或展开的构象。结合RALS数据,可以计算出绝对分子量。

表2 利用RALS、RI和粘度计测量的数据结果
数据结果表明,尽管它们的粘度不同,但是具有相同的绝对分子量,这证实了它们是单体。流体力学体积大小的差异暗示RD发生了解折叠。
结论
现在,想要在医药开发市场中生存并且壮大,需要高效的分析技术作为支撑。日渐兴起的高级SEC技术提供了验证和优化NCEs的新手段。随着研究中化学物质越来越复杂,对结果精确度的要求就会越来越高,依赖于假设或数学拟合算法得到的结果将逐步被直接测量所替代。配有多重检测器的SEC系统可以在相同的测试过程中收集更多的信息,它将有效缩短新药研发时间,有助于制药企业提升市场竞争力。

