
诚信认证:
工商注册信息已核实! 扫一扫即可访问手机版展台
扫一扫即可访问手机版展台
揭秘:新冠病毒比SARS病毒具更强感染力的原因
前言
疾疫无情,人间有爱,武汉肺炎疫情牵动着全国人民的心。全国各地医护工作者不顾危险奋战在前线,广大的科研工作者也在积极开展新冠肺炎病毒(SARS-CoV-2)研究,希望尽快了解其致病机理,为治疗和预防提供新方法。
近日,同济大学附属同济医院程黎明团队联合上海第二军医大学长征医院、长海医院及清华大学、沈阳药科大学等多家医院、科研院所,于bioRxiv网站在线发表题为“The insert sequence in SARS-CoV-2 enhances spike protein cleavage by TMPRSS”的论文[1]。
该研究通过序列比对、蛋白建模和单细胞RNA测序数据分析发现,相比SARS病毒(SARS-CoV),武汉新冠病毒(SARS-CoV-2)刺突蛋白S的4个氨基酸的插入导致其剪切效率提高,感染能力更强!换句话说,为武汉新冠病毒比SARS病毒具有更强的感染性提供了一个解释。
新冠病毒的分类
前期研究发现新冠病毒属于冠状病毒科β属冠状病毒,与来自蝙蝠的冠状病毒BatCoV RaTG13和Bat-SL-CoV ZC45有较高的基因组序列同源性[2]。导致非典型肺炎的SARS-CoV以及导致中东呼吸综合症的MERS-CoV同样属于β属冠状病毒。这些病毒在不到20年的时间已经三次导致人类重大传染病,说明β属冠状病毒是一类人高致病性病毒分支,需要进一步加强对该属病毒的研究,为未来的感染防治提供基础。
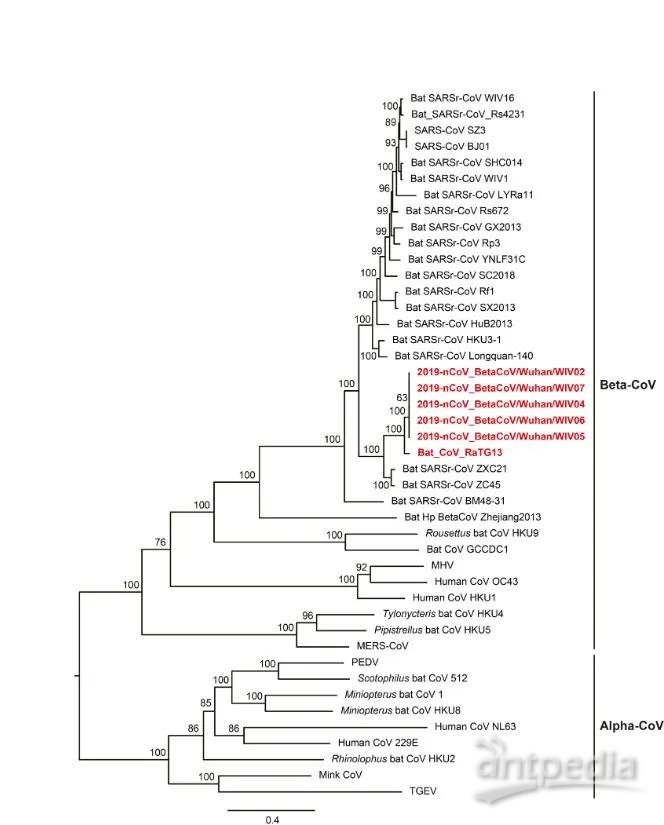
新冠病毒SARS-CoV-2系统发育进化树[2]
新冠病毒的基因结构
冠状病毒基因组为单链正义RNA,大小约30kb,在它的5’-端有帽状结构,3’-端有多聚腺苷酸尾。基因组含有6个开放阅读框ORF,第一个开放阅读框ORF1a/b约占基因组的三分之二,编码的蛋白可被加工为16个非结构蛋白NSPs,参与基因组复制、蛋白翻译、宿主细胞代谢修饰等过程[2,3]。
其它五个开放阅读框只占基因组的三分之一,主要编码四个结构蛋白,包括刺突蛋白S,膜糖蛋白M,小包膜蛋白E,核衣壳蛋白N。少数病毒还编码血凝素糖蛋白HE。结构蛋白参与子代病毒粒子组装和感染宿主细胞的过程。
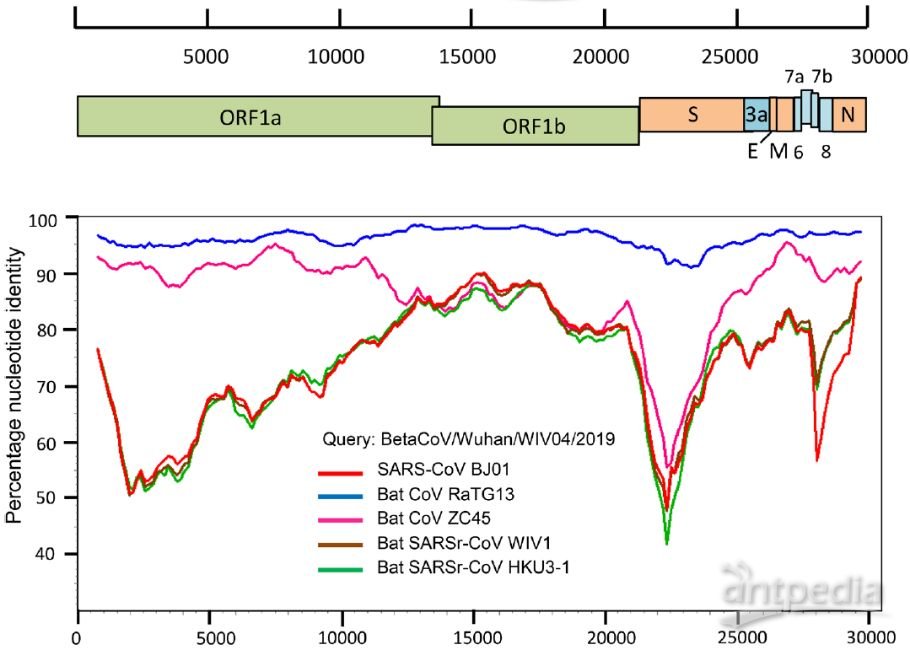
SARS-CoV-2基因组特征[2]
新冠病毒S蛋白序列结构特征
新冠病毒S蛋白有两个亚基:S1和S2,受体结合位点(RBD)位于S1亚基上[4]。它以三聚体的形式组成病毒粒子外膜表面的刺突,其主要功能是识别宿主细胞表面受体,介导与宿主细胞的融合[3]。
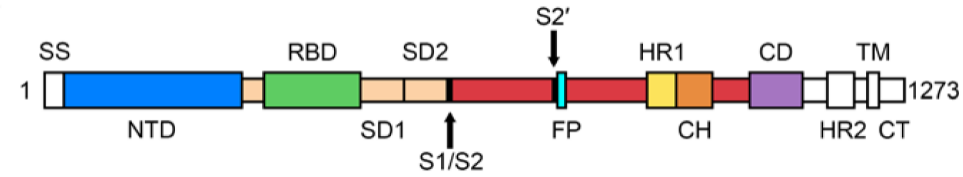
新冠病毒S蛋白结构[4]
将新冠病毒、MERS-CoV、SARS病毒和来自蝙蝠的SARS相关病毒BatCoV RaTG13等冠状病毒的蛋白序列比对发现,相比序列相对保守的非结构蛋白, S蛋白序列在不同病毒中变异较大,这可能与S蛋白参与宿主识别的功能有关。因此以S蛋白的基因编码序列为靶基因,设计特异性引物可以鉴定新冠病毒,这也正是新冠病毒诊断核酸检测试剂盒开发的理论依据之所在[2]。
冠状病毒如何识别细胞并进入胞内?
冠状病毒首先通过S蛋白的RBD与细胞表面受体(如ACE2)结合附着于宿主细胞,然后被酸依赖的蛋白酶(如TMPRSS2等)进行两次切割,第一次切割发生在S1/S2位点,主要是将RBD切除;第二次切割发生在S2’位点,目的是暴露出融合肽(fusion peptide),随后融合肽插入宿主细胞膜并与之融合,将核酸分子释放进入胞内,完成侵染过程。
S蛋白与受体相互作用的强弱是决定冠状病毒感染宿主能力强弱的主要因素,而前者又与S蛋白的切割效率有关。

冠状病毒侵染模式[1]
新冠病毒和SARS病毒使用相同的受体
先前的研究证实SARS病毒的受体为人黏膜细胞表面血管紧张素转化酶ACE2。虽然新冠病毒编码S蛋白的核苷酸序列与SARS病毒的序列同源性低于75%,蛋白序列也有较大变异[2],但两者三维结构依然十分相似[1,4]。武汉病毒研究所的实验研究表明,新冠病毒与SARS病毒的S蛋白都是通过与ACE2受体相互识别而感染人体细胞。
新冠病毒S1/S2酶切位点插入序列有助于S蛋白的识别和剪切
在最新的研究中,同济大学等研究人员将10个β冠状病毒属的S1/S2 和 S2' 剪切位点及附近序列比对后发现,新冠病毒比SARS病毒在S1/S2剪切位点多4个氨基酸(SPRR)。作者进一步通过酶切效率预测算法发现,新冠病毒比SARS病毒在S1/S2位点有更高的剪切效率。蛋白三维结构预测显示新冠病毒S1/S2位点多出的4个氨基酸会在蛋白表面形成一个延展的loop,而这个环状结构更容易被蛋白酶TMPRSS2识别[1]。
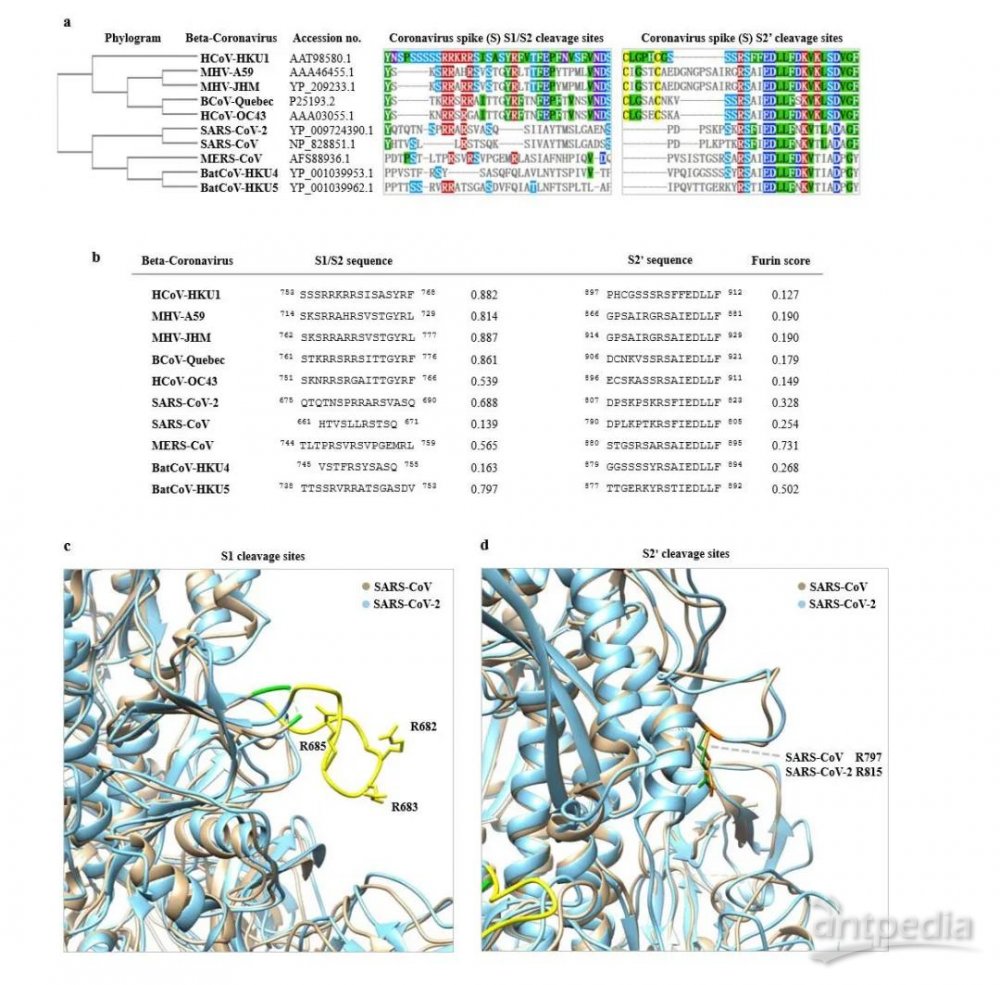
S蛋白的剪切位点序列和三维结构[1]
新冠病毒易感组织分析
受体和酸依赖蛋白酶的表达是病毒感染的前提条件,明确易感组织对于理解致病机理有重要意义。研究人员对正常肺组织单细胞RNA测序 (scRNA-Seq)数据进行分析,发现ACE2和TMPRSS2基因在肺泡细胞(如AT2细胞)中高表达。对食管、胃、小肠和结肠等组织单细胞数据分析也发现ACE2和TMPRSS2基因的高表达。这一分析结果表明除肺部组织,消化道也是病毒易感染的组织,与临床表型相一致。
结束语
截止2020年2月27日,新冠病毒累计确诊患者已超过7.8万人,远超2003年SARS病毒患者,也说明新冠病毒的感染能力要强于SARS病毒。最新的研究利用表面等离子共振技术(SPR)分析发现新冠病毒S蛋白与ACE2的亲和力是SARS病毒的10至20倍[4],再次佐证了新冠病毒具有比SARS病毒更高的传播能力。
随着科学研究的逐步深入,冠状病毒的神秘面纱也被一层层揭开。虽然新冠病毒具有很强的传染力,但是我们相信,在全国各地医护工作者、科研工作者及各行各业人员的不懈努力下,全国人民众志成城,同舟共济,一定能打赢这场疫情阻击战,迎接勃勃生机的春天!
参考文献
1. Meng, T., et al., The insert sequence in SARS-CoV-2 enhances 1 spike protein cleavage by TMPRSS. BioRxiv, 2020.
2. Zhou, P., et al., A pneumonia outbreak associated with a new coronavirus of probable bat origin. Nature, 2020.
3. Fehr, A.R. and S. Perlman, Coronaviruses: an overview of their replication and pathogenesis. Methods Mol Biol, 2015. 1282: p. 1-23.
4. Wrapp, D., et al., Cryo-EM Structure of the 2019-nCoV Spike in the Prefusion Conformation. Science,2020.10.1126/SCIENCE.ABB2507.
#END#
冬冬 撰文
部分内容来源网络侵删
转载请注明本文转自欧易生物


