诚信认证:
工商注册信息已核实! 扫一扫即可访问手机版展台
扫一扫即可访问手机版展台

徕卡课堂丨比率成像——通过测定荧光基团位移来分析离子浓度
作者:Thomas Veitinger 博士
细胞的很多基本功能主要取决于细胞质与细胞外间隙之间在离子(比如,钙、镁)、pH 以及电压电位上微妙的动态平衡,这些平衡的变化会显著改变细胞的行为和功能。因此,实时测定细胞内离子、电压和 pH 值的动态变化,是神经系统科学、细胞生物学以及细胞生理学研究人员的关注重点。但在很多情况下,采用常规的荧光手段很难对细胞或细胞通路中不同位置的实际离子浓度或相对变化量进行准确估算,产生这一问题的原因在于,这些方法没有考虑以下情况:单个细胞不同部位的细胞状态以及不同细胞类型之间的细胞通路都会存在差异,这会对发射光的质量和数量产生影响。当研究离子浓度、电压或 pH 值的动态变化时,上述问题会引发重大误释。采用比率成像技术后,即可观察荧光基团的发射波长位移,或对比荧光基团组合的发射光强。该技术并非只测定纯粹的光强变化,因而规避了上述问题。
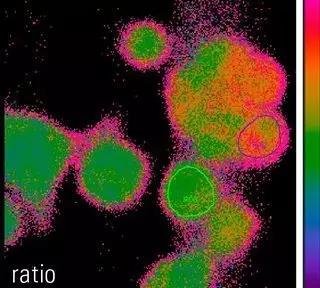
通过测定荧光基团发射位移,估算离子浓度、pH值 或电压变化
目前,研究的焦点愈来愈多地集中在局部“热点”的识别及其空间和时间分布上,以确定细胞或细胞通路中离子浓度、电压或 pH 值的动态变化。上述“热点”通常位于细胞特定部位或细胞通路内某些细胞之中。此外,相比样本的其他部分,这些区域通常在细胞代谢或结构方面具有不同的属性。用于研究动态生理状态的常规荧光基团会因离子结合、pH 变化或电压变化而改变它们的发射光强(例如,fluo-4 的发射光会随着钙离子结合而增加)。但这些标记物并未考虑以下情况:结构、直径或标记物摄取/表达的差异会引起发射光量的改变,但它们与实际离子浓度、电压或 pH 并不相关。要对细胞结构或不同细胞的变化进行定量对比检测,则需要采用对结构、直径以及荧光基团浓度都不敏感的方法。与非比率成像方法相反,通过比率成像技术,可以测定与细胞直径、荧光基团浓度和成像装置光学特性相关的细胞内离子、电压和 pH 的绝对水平/变化,该检测结果具有可重复性。然而,比率成像技术依赖于仪器激发波长或检测波长的快速变化、强光源和光学部件出色的透光率以及快速信号检测的功能。最新研发的超快荧光滤块转盘、经过紫外光穿透优化的物镜、高灵敏度的荧光基团以及全新的 CCD 照相机,能够确保对活细胞实现定量、高速成像,且图像具备高空间分辨率,此外,这些功能的性价比也很高。
波长激发/检测是测定荧光基团位移的关键
如上所述,比率成像技术测定的是发射位移而非纯粹的光强变化。要测定发射位移,必须采用两个不同的激发波长或在两个不同的发射波长上进行检测,以测定荧光基团或荧光基团组合的光强变化。如果使用常规的钙离子成像染料 fura-2,则必须用 340 nm 和 380 nm 波长处的光对染料进行激发,且检测波长为 510 nm。与之相反,钙离子成像染料 indo-1 通常受到 350 nm 波长处光的激发,且检测波长分别为 405 nm 和 485 nm(可参见《比率成像主要应用领域》中的图 1)。
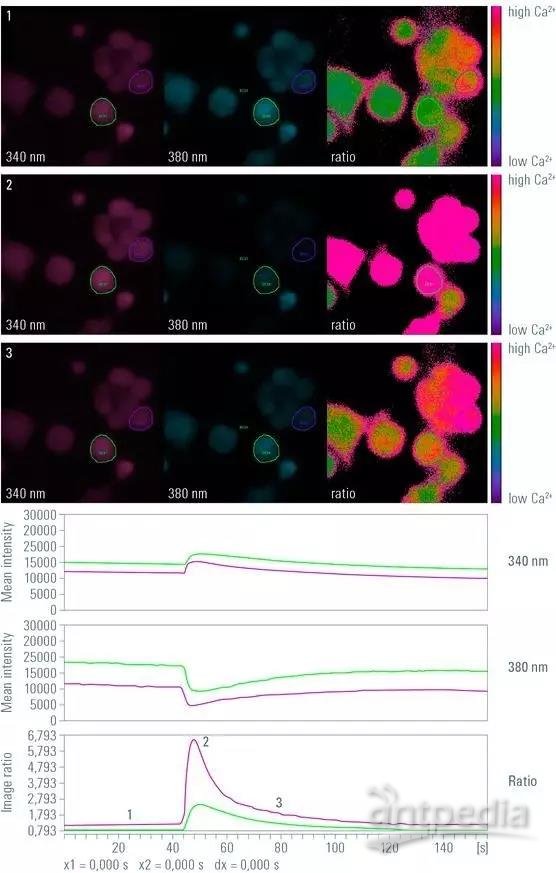
图 1:钙离子成像实验延时成像,所用比率成像钙指示剂为Fura-2。图示为 340 nm(左图)和 380 nm(中间)激发后的假彩色图像,以及计算出来相应的比率图像(右图)。该图像系列展示了三个时间点:在第一个时间点 (1) 上,细胞并未受到刺激,细胞内钙离子处于静息水平。在第二个时间点 (2) 上,细胞受到刺激,且钙离子处于最大水平。在第三个时间点 (3) 上,细胞内钙离子水平处于下降态势。在图中,已经对相应的时间点作了标记。上曲线图展示了 在340 nm 处图像的光强,而中图则展示了 在380 nm 处图像的光强,下图展示了比率光强。
但为什么说双激发或发射检测是必要条件呢?为什么不是简单地测定荧光基团光强的变化呢?
假设在一个实验中,用荧光基团检测离子水平、电压或 pH 值的变化,则发射荧光的光强取决于若干个特性,如以下公式所示:

F = 荧光光强;c = 荧光基团浓度;d = 样本直径(z 轴);K = 光通路中部件的光学常数(细胞特性、物镜、滤光片等);f(x) 描述了在发生离子结合或电压/pH 值改变等情况之后,指定荧光基团的发射行为。
该公式表明,光强很大程度上取决于光路中的荧光基团数量,而光路中的荧光基团数量则取决于细胞中荧光基团的实际浓度 (c;由标记物摄取或表达量来决定)以及待成像的样本直径 (d)。因此,如果只是简单地观察荧光光强,就很难直接估算出离子浓度、pH 水平或电压变化,例如,不能说:“光强为 100 相当于一个细胞内含有 100 nM 游离钙”。此外,很难计算样本直径 (d)、荧光基团浓度 (c)、样本及装置的光学特性 (K),但这些因素却对所检测的整体光强产生显著影响。此外,必须记住:上述公式对样本中的任意指定点均适用。由于一个样本甚至单个细胞中的直径 (d) 和荧光基团浓度 (c) 都无法保持统一,因此,在获取的样本图像中,每个像素的 c 和 d 数值都可能不同。比如,在样本的 "A" 点上,细胞直径较大,而游离钙浓度则较低,光强可能与 "B" 点相同,但 B 点的情况却与 A 相反。由于检测到的荧光光强相似,实验人员会错误地认为两个地方的钙离子浓度相似。
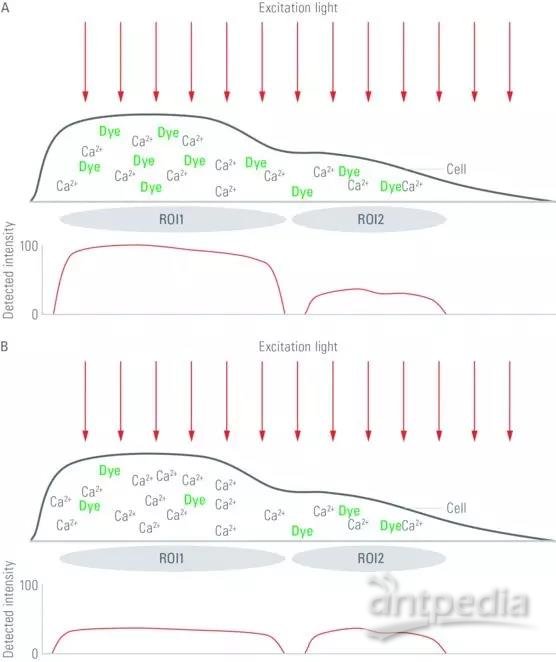
图 2:上图所示为通过非比率钙离子敏感型荧光基团的发射光强来判定细胞内钙离子浓度时,可能会发生的误释情况。图示下面的曲线代表了细胞不同部位中目标区域 (ROI) 的光强。在上图 (A) 中,不同区室的细胞厚度存在差异(公式中的 d),例如,结构非常微小的细胞突出部分(例如,神经元的树突和轴突)。由于光路中的所有荧光基团均受激发光的激发且其发射光最后都会被收集,因此,细胞较厚部分的亮度强于较薄部分。这会导致我们认为细胞较厚部分的钙离子浓度比较薄部分要高,但它们的实际钙离子浓度却是相同的。在下图 (B) 中则展示了不同的情况。在有些细胞中,荧光基团在细胞区室中占据的比例不同。在如图所示的情况下,细胞较厚部分的钙离子浓度(公式中的 c)较高,但本区域的荧光基团浓度却较低。这是由于钙敏感型染料的荧光光强不仅取决于细胞中的钙离子浓度,而且还取决于荧光基团浓度,就会让人认为:整个细胞中的钙离子浓度是相同的。
比率成像技术的研发,正是为了克服上述问题并且可以精确计算出绝对离子浓度、pH 水平或电压。所有比率测量方法都有一个共同之处:两次测定发射光的强度,并计算这些光强的比率 (R)。根据所用的荧光基团或荧光基团组合,荧光基团受到两个不同波长光的激发,并在其中一个波长处测定发射光强,或者,荧光基团或荧光基团组合受一个波长光的激发,并在两个不同波长处测定发射光强。简单地说,就是获取两个灰度值图像,并根据这两个灰度值图像推算出一个比率图像。这两个灰度值图像通常光强不同,但图像中每个单像素的光强均可通过以下公式来计算:

根据比率成像这个名称可知,两个同时获取的图像中,每个像素的比率值都是计算得出的。例如,如果使用的是常用钙离子敏感型染料 Fura-2(在 340 和 380 nm 处激发),则计算公式为:

根据简单的数学运算,可抵消 c、d 和 K,算出比率如下:

根据两个灰度值图像计算虚拟的比率图像
实际上,比率是由计算机算出来的,在很多情况下的延时实验中,比率是在线算出来的。通过计算两个独立获取的灰度值图像相应像素的灰度值比率,即可创建比率图像。要记住,灰度值图像基本上是灰度值矩阵,尺寸为照相机分辨率或目标区域 (ROI)(通常为 512x512,高达超过 1000 x 1000 像素)。在钙离子成像中,使用染料 Fura-2 进行延时实验(激发波长:340 nm 和 380 nm,发射波长:510 nm),即可得出如下结果(假设图像尺寸为 3x3 像素):
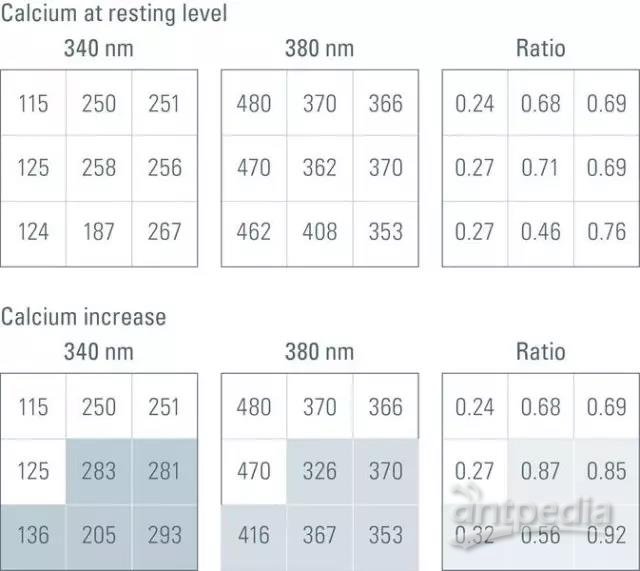
图 3:CCD 照相机在使用钙离子探针 fura-2的钙离子成像实验中,将光强传送到计算机上的强度值的简化说明。在这种情况下,图像的尺寸为 3 x 3 像素。上面三个矩阵代表在 340 nm 和 380 nm 激发波长处钙静止浓度上的光强读出值,以及相应的比率值。下面三个矩阵中,突出显示的像素表明,钙浓度增大时光强值随之改变。340 nm 激发波长处的数值增加,而 380 nm 激发波长处的数值降低。但是,相应的比率值也会增加。
在延时实验中,针对每个图像对应的每个像素进行上述操作,即可创建比率图像系列。最后,可将一个伪彩图施加于比率图像系列上,该系列图像可以像常规灰度延时视频一样,观看和进行定量分析。
除上述优势之外,计算比率还有一个优势。利用离子、电压或 pH 敏感型荧光基团进行活细胞成像时,相应波长处的荧光光强常常会发生微小变化。但在比率成像中,通常可观察到如下情况:一个波长处的光强增加,而另一个波长处的光强降低(无论探针是否由两个波长激发或检测)。如果随后可以算出所获取的两个图像的比率,则基准线和信号幅度之间的差异,相比纯粹的荧光基团光强变化会得到改善。因此,比率成像技术能够增强检测信号的幅度,这项优势引起了 FRET 检测领域的极大关注,在 FRET 检测中,受体蛋白的荧光光强降低,而能量转移期间的受体蛋白荧光光强增加。
作者简介:

Thomas博士毕业于德国波鸿鲁尔大学,主攻生物学,并获得发育神经生物学博士学位。在一篇博士论文中,他研究人精子中由气味驱动的亚细胞钙动态变化,在活细胞成像方法和生理学方面积累丰富经验。作为博士后,他曾在德国亚琛大学化学系工作。在那里,他使用膜片钳技术和活细胞成像来研究雄性干细胞。自2011年5月起,他作为产品经理加入徕卡显微系统,主要负责活细胞成像,电生理和神经科学方面的应用。

| 标签: | 徕卡课堂,比率成像 |